麦冬不同部位降血糖作用实验研究
张 杰,陈逢佳,于文博,詹伟华,徐江城,陈 郁*
(1. 杭州职业技术学院,浙江 杭州 310018;2. Mailman School of Public Health, Columbia University, United States, New York 10032)
麦冬为百合科植物麦冬[Ophiopogon japonicus(L. f) Ker-Gawl.]的干燥块根,始载于《神农本草经》,能养阴生津、润肺清心,用于治疗内热消渴、津伤口渴等症[1],是治疗糖尿病的传统常用中药[2]。麦冬的主要化学成分包括甾体皂苷类、高异黄酮类、氨基酸类、豆甾醇类、酚酸类和多糖类[3]。现代药理学研究表明,麦冬具有抗心脑血管疾病、降血糖[4-8]、降血脂、改善学习记忆能力、提高免疫调节能力、止咳、抗肿瘤、延缓衰老等多种作用[9]。为进一步明确麦冬不同部位活性组分的降血糖作用,本研究对麦冬不同部位对糖代谢关键酶的抑制作用及降血糖效果进行评价,以冀为开发新型降糖药物提供思路。
1 仪器与材料
1.1 仪器
Smart 2Pure UV/UF超纯水系统(美国Thermo公司);Sorvall ST 40R低温离心机(美国Thermo公司);Spectra MAX 190光吸收酶标仪(美国美谷分子公司);AE50电子分析天平(瑞士Mettler Toledo公司);KQ-400DB型数控超声波清洗器(昆山市超声仪器有限公司);高速多功能中药粉碎机(永康市铂欧五金制品有限公司);pH计(瑞士Mettler Toledo公司)。
1.2 药品与试剂
麦冬饮片购自浙江景岳堂药业有限公司,经浙江省杭州九洲大药房连锁有限公司副主任中药师朱整明鉴定为百合科植物麦冬Ophiopogon japonicas(L. f) Ker-Gawl.的干燥块根。α-葡萄糖苷酶(250 U/mg),α-淀粉酶(50 U/mg,上海源叶生物有限公司);对硝基苯基-α-D-吡喃葡萄糖苷(PNPG),3, 5-二硝基水杨酸(DNS),可溶性淀粉,阿卡波糖及其他试剂购自上海阿拉丁试剂公司。
1.3 实验动物
C57BL/6小鼠30只,雄性,8周龄,体重20±2 g,由杭州医学院提供,合格证号:20211108Abbb0100018943。实验前适应性饲养1周,自由饮食、摄水。
2 方法
2.1 麦冬不同部位提取物制备
称取麦冬适量,50 ℃烘干后粉碎,过100目筛,取麦冬粉末约10 g,精密称定,加入10倍量70 %乙醇溶液,回流提取2次,过滤,合并滤液,浓缩,得70 %乙醇提取物;将70 %乙醇提取物加水分散,在超声波辅助下分别用不同溶剂等体积萃取2次,合并有机溶剂层,浓缩后冻干,得正丁醇部位、石油醚部位、二氯甲烷部位、乙酸乙酯部位;取麦冬粉末,10倍量蒸馏水浸提2次,冷冻干燥后得水提物。
2.2 溶液的制备
2.2.1 供试品溶液的制备 精密称取10.00 mg提取物冻干粉,用70 %乙醇溶液溶解定容,配制为2 mg/ml储备液,用0.10 mol/L PBS缓冲液稀释至0.25 μg/ml,即为供试品溶液。
2.2.2 阳性药物溶液的制备 精密称取5.00 mg阿卡波糖,用水溶解定容,配制为1 mg/ml储备液。用0.10 mol/L PBS缓冲液稀释至0.5 μg/ml,即为阳性药物溶液。
2.3 麦冬提取物对α-葡萄糖苷酶的抑制活性测定
根据文献方法[10],测定麦冬不同部位对α-葡萄糖苷酶酶活力的抑制作用:向酶标板中依次加入0.10 mol/L PBS缓冲液(pH 6.8)60 μl,0.25 μg/ml供试品溶液40 μl或0.50 μg/ml阳性药物阿卡波糖40 μl,0.06 U/ml α-葡萄糖苷酶溶液40 μl,摇匀,37 ℃孵育15 min。加入2.5 mmol/L PNPG溶液20 μl,混匀,37 ℃孵育15 min,再加入0.2 mol/L碳酸钠终止液80 μl,405 nm波长处测定吸光度。
2.4 麦冬提取物对α-淀粉酶的抑制活性测定
根据文献方法[11],测定麦冬不同部位对α-淀粉酶活性的抑制作用:在EP管中依次加入0.1 mol/L PBS缓冲液(pH 6.8)50 μl,2 U/ml α-淀粉酶溶液10 μl,0.25 μg/ml供试品溶液20 μl,混匀,37 ℃孵育15 min。加入1 %可溶性淀粉溶液20 μl,混匀,37 ℃孵育15 min,再加入DNS试剂(称取酒石酸钠9.10 g,溶解于500 ml水,再加入DNS 0.35 g,氢氧化钠2.00 g,苯酚0.25 g,无水硫酸钠0.25 g,溶解并加水定容至100 ml)100 μl,沸水浴10 min,540 nm波长处测定吸光度。
为消除供试品和底物对测定结果的影响,以PBS代替供试品,检测供试品和底物的吸光度。按下式计算α-葡萄糖苷酶和α-淀粉酶活性抑制率。
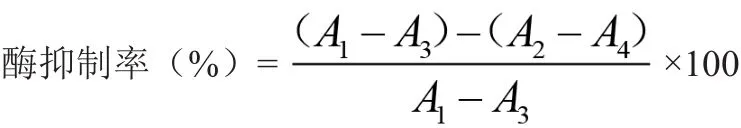
式中,A1为无抑制剂时吸光度;A2为加入抑制剂时吸光度;A3为底物背景吸光度;A4为供试品背景吸光度。
2.5 糖尿病小鼠模型的建立
将小鼠禁食(不禁水)约12 h后,腹腔注射50 mg/kg链脲佐菌素(0.2 ml/只),5 d后禁食(不禁水)12 h,尾静脉采血测血糖值,血糖值大于11.1 mmol/L的小鼠为实验性糖尿病小鼠。空白组小鼠给予等量生理盐水。
2.6 血糖的检测
按血糖值均匀分组为模型组和给药组,每组10只。给药组小鼠灌胃给予麦冬水提物(4 g/kg·d-1),模型组和空白组给予等量生理盐水。连续灌胃30 d,末次给药前禁食(不禁水)12 h,尾静脉采血测血糖值。
2.7 数据统计
用Excel 2010、Graphpad prism 8.0和SPSS 22.0软件进行组间比较,P<0.05表示差异具有统计学意义。
3 结果与分析
3.1 麦冬提取物对α-葡萄糖苷酶的抑制活性
麦冬各部位对α-葡萄糖苷酶的抑制能力差异有统计学意义,见图1。由图1可见,水提物对α-葡萄糖苷酶的抑制活性最高,其他提取物的抑制活性依次为70 %乙醇提取物> 正丁醇部位>石油醚部位>二氯甲烷部位>乙酸乙酯部位。水提物的抑制作用显著高于乙酸乙酯部位(P<0.001)和二氯甲烷部位(P<0.05)。
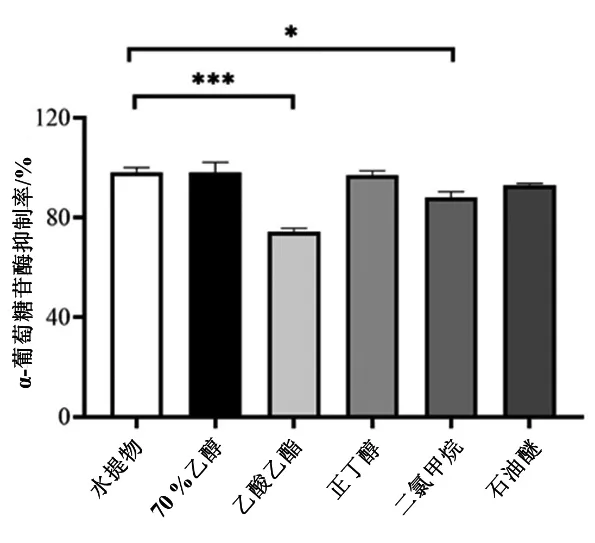
图1 麦冬提取物对α-葡萄糖苷酶的抑制作用
3.2 麦冬提取物对α-淀粉酶的抑制活性
结果见图2。由图2可见,麦冬各部位的抑制能力有显著差异,抑制活性大小依次为水提物>乙酸乙酯部位>正丁醇部位>二氯甲烷部位>70 %乙醇提取物> 石油醚部位。结果表明水提物对α-淀粉酶的抑制活性最高,显著高于70 %乙醇提取物(P<0.01)、二氯甲烷部位(P<0.05)和石油醚部位(P<0.001)。

图2 麦冬提取物对α-淀粉酶的抑制作用
3.3 麦冬提取物对糖尿病小鼠血糖的影响
结果见图3。由图3可见,麦冬水提物给药4周后,能显著降低糖尿病小鼠空腹血糖(P<0.05)。

图3 麦冬提取物对糖尿病小鼠血糖的影响
4 讨论
目前,治疗糖尿病的药物主要为双胍类、磺酰脲类和胰岛素,但长期服用都有较大的副作用[12],亟需研究更为安全可靠的糖尿病治疗药物和临床治疗方案。淀粉在人体内接触α-淀粉酶后被水解为寡糖,再经小肠的α-葡萄糖苷酶作用分解为单糖,最终经小肠吸收进入血液循环[13]。因此,α-葡萄糖苷酶和α-淀粉酶为糖代谢关键酶,是控制餐后血糖的重要靶标[14]。针对以上酶的抑制剂可有效控制糖尿病血糖。
已有研究发现麦冬总皂苷、水提物和总多糖能显著降低四氧嘧啶诱导糖尿病动物模型血糖水平[15],但对麦冬不同部位的降糖作用对比研究较少。本工作首先筛选了能抑制糖代谢关键酶的麦冬活性部位,再采用糖尿病动物模型验证了该活性部位的降血糖作用。研究发现麦冬水提物对α-葡萄糖苷酶和α-淀粉酶活性抑制作用均最强,乙酸乙酯部位α-葡萄糖苷酶抑制活性最弱,石油醚部位α-淀粉酶抑制作用最弱,可能的原因是麦冬水提物中含大量多糖类成分[16]。多糖是麦冬降血糖的主要活性成分,能抑制α-葡萄糖苷酶活性[17],降低链脲佐菌素诱发糖尿病大鼠血糖[18],进而保护胰岛β细胞功能。体内实验验证了麦冬水提物对糖尿病小鼠有显著的血糖控制作用,为麦冬的降血糖功能提供依据,同时为麦冬后续开发提供实验基础。

