固相萃取-超高效液相色谱串联质谱法测定香辛料中去甲乌药碱含量*
王 玮,尤晓惠,郑小敏,王美锋,向鹏宇
(重庆市涪陵食品药品检验所,重庆 408000)
去甲乌药碱属生物碱,存在于许多天然植物中,也是一种β受体激动剂,具有增强心肌收缩力[1]和兴奋心肌细胞的作用[2],被国际反兴奋剂机构明确禁用。查阅文献可知,花椒、胡椒、香叶等香辛料中去甲乌药碱含量较高[3],目前对食品、中药材中该成分含量测定的研究较少[4-6],其前处理技术主要为QuChERS法和直接提取法[7],分析方法主要为快速检测免疫法[8]、高效液相色谱法[9-14]、QuChERS法与液相色谱-质谱联用法[15-16]。由于香辛料所含成分复杂,其基质效应会不同程度地影响化合物的电离,且很难找到阴性基质,导致上述方法均不适用于香辛料中去甲乌药碱的筛查及准确定量。本研究中建立了固相萃取-超高效液相色谱串联质谱(UPLC-MS/MS)法,旨在最大限度地消除香辛料中杂质的干扰,降低基质效应,提高检测的准确度和精密度,为香辛料中去甲乌药碱的含量测定提供参考。现报道如下。
1 仪器与试药
1.1 仪器
Agilent 1290-AB 4500型高效液相色谱串联质谱仪(美国Agilent公司);XPE204型电子分析天平(瑞士Mettler-Toledo公司,精度为0.001 g);VORTEX3型涡旋仪(德国IKA公司);SR-2DS型强力振荡器(日本Taitec公司);Multifuge XIR型冷冻离心机(德国Thermo Fisher公司);Milli-Q超纯水系统(美国Millipore公司)。
1.2 试药
甘牛至、欧芹、芝麻、茴香、砂仁、孜然、甘草、薄荷、芫荽、山柰、姜(干)、豆蔻、肉豆蔻、迷迭香、香茅、辣椒、胡芦巴、姜黄、百里香、甜罗勒、小豆蔻、葛缕子、芹菜籽、莳萝、龙蒿、高良姜、香果、草果、香叶、丁香、牛至、花椒、荜拔、茴香、白胡椒、八角等36种香辛料,均购于重庆盘溪农副产品批发市场。去甲乌药碱对照品(上海诗丹德生物技术有限公司,批号为8114,含量98.0%);去甲乌药碱-D4对照品(天津阿尔塔科技有限公司,批号为S048107,质量浓度为100 μg/mL);甲酸、甲醇、乙腈均为色谱纯,其余试剂均为分析纯,水为超纯水。Bond Elut-PBA固相萃取柱(美国Agilent公司,批号为12102018,规格为3 mL:100 mg);阳离子交换柱-MCX固相萃取小柱(日本Shimadzu公司,批号为660314243,规格为60 mg/3 mL);亲水亲脂型-HLB固相萃取小柱(美国Waters公司,批号为158A38150A,规格为60 mg:
3 mL)。
2 方法与结果
2.1 试验条件
色谱条件:色谱柱为Waters CSH C18柱(100 mm×2.1 mm,1.7 μm);流动相为0.1%甲酸乙腈(A)-0.1%甲酸水溶液(B),梯度洗脱(0~3.5 min时5%A→25%A,3.5~4.5 min时25%A→95%A,4.5~5.5 min时95%A,5.5~5.6 min时95%A→5%A,5.6~7.0 min时5%A);流速为0.3 mL/min;柱温为40℃;进样量为2 μL。
质谱条件:电喷雾离子源ESI(+);多反应监测(MRM)模式;电喷雾电压5 500 V;雾化气压力55 psi;辅助气压力55 psi;气帘气压力35 psi;碰撞气体(CAD)为氮气;离子源温度550℃。去甲乌药碱定量离子对质荷比(m/z)272.0/107.0,去簇电压40 V,碰撞能量26 V;去甲乌药碱定性离子对m/z272.0/255.0,去簇电压40 V,碰撞能量20 V;去甲乌药碱-D4离子对m/z276.0/259.0,去簇电压40 V,碰撞能量21 V。
2.2 溶液制备
取去甲乌药碱对照品10 mg,精密称定,置10 mL容量瓶中,加甲醇定容,摇匀,得质量浓度为1 mg/mL的对照品贮备液;精密吸取0.1 mL,置100 mL容量瓶中,加甲醇定容,摇匀,得质量浓度为1 μg/mL的对照品溶液,于-18℃冷冻保存。精密吸取去甲乌药碱-D4对照品1 mL,置10 mL容量瓶中,加甲醇定容,摇匀,得质量浓度为10 μg/mL的内标贮备液;精密吸取1 mL,置10 mL容量瓶中,加甲醇定容,摇匀,得质量浓度为1 μg/mL的内标溶液,于-18℃冷冻保存。取样品适量,粉碎,过60目筛,取1.0 g,精密称定,置50 mL离心管中,加入内标溶液100 μL,再加入19 mL 0.5%甲酸乙醇-水(80∶20,V/V),振荡30 min,8 000 r/min离心5 min。取上清液,转移至20 mL比色管中,用5%氨水调pH至8.5±0.5,加水定容,摇匀。取5 mL,过PBA固相萃取小柱[依次用乙腈、0.5%甲酸水溶液、0.2 mol/L乙酸铵(pH 8.5)各3 mL活化]后,再用0.2 mol/L乙酸铵(pH 8.5)、水各3 mL依次淋洗,用0.5%甲酸甲醇2 mL洗脱,抽干小柱,收集洗脱液,40℃氮气吹至近干,加0.5%甲酸水1 mL复溶,经0.22 μm滤膜滤过,取续滤液,即得供试品溶液。同法制备不含样品的阴性对照品溶液。
2.3 试验条件优化
提取体系优化:分别考察了甲醇、乙醇、水、乙腈、甲醇-水、乙醇-水对去甲乌药碱的提取效果。以阴性样品(不含去甲乌药碱)芹菜籽及阳性样品(含去甲乌药碱)花椒为考察对象,向样品中分别加入对照品溶液及内标溶液适量,分别用上述体系直接提取,计算绝对回收率。结果见图1。可见,对于芹菜籽样品,采用甲醇、甲醇-水、乙醇、乙醇-水体系较合适,其中乙醇-水提取效率最优。

图1 不同提取体系的加样回收率Fig.1 Recovery rates of different extraction systems
提取液比例优化:另取花椒样品适量,加入内标溶液适量,以含量和基质效应为考察指标,考察20%,40%,60%,80%,100%的乙醇-水体系(含0.5%甲酸)对去甲乌药碱的提取效率。结果样品中去甲乌药碱的含量随着乙醇体积分数的升高而增加,当乙醇比例为100%时,样品含量呈下降趋势;乙醇比例为40%时,其内标的基质效应抑制最强,其他比例时基质效应相当。综合考虑,本研究中最终选择乙醇-水(80∶20,V/V,含0.5%甲酸)为提取体系(图2 A)。

图2 花椒样品总离子流图1.HigenamineA.Before optimizing extraction system B.After optimizing extraction system C.Purification by HLB D.Purification by PBAFig.2 Total ion chromatograms of Zanthoxyli Pericarpium
供试品净化:为减少复杂基质的干扰和对色谱柱及检测器的影响,预试验中采用阳性样品花椒为考察
对象,以通过HLB小柱净化后的供试品作为基质溶液,考察在不同梯度流动相条件下,基质溶液对去甲乌药碱目标峰的干扰情况。结果显示,优化前目标化合物附近会出现基质干扰峰且未完全分离(图2 B),优化后目标成分与基质干扰峰完全分离(图2 C)。故将条件确定为2.1项下的梯度洗脱程序。
固相萃取柱选择:去甲乌药碱为结构中含有苯环的仲胺化合物,苯环上带有2个相邻的羟基。预试验中选取芹菜籽和花椒为考察对象,向样品中分别加入对照品溶液及内标溶液适量,分别经HLB反相固相萃取柱、MCX阳离子交换固相萃取柱、PBA固相萃取柱净化,以回收率和净化效果作为考察指标。结果经MCX小柱净化后,芹菜籽和花椒样品中去甲乌药碱的回收率均小于5%;经HLB小柱净化后,芹菜籽样品去甲乌药碱的回收率为65%,花椒样品去甲乌药碱-D4的回收率为10%,且含量测定的重复性差,净化后仍存在许多干扰峰;经PBA小柱净化后,芹菜籽中去甲乌药碱和去甲乌药碱-D4的回收率分别为80%和94%,花椒中去甲乌药碱-D4的回收率为88%,净化后样品中干扰较少,净化效果较好(图2 D)。综合考虑,选择PBA固相萃取小柱作为本试验中的固相萃取柱。见图2。
样品筛孔径:样品粉碎过程中会出现不易粉碎、粉碎后颗粒大小不均匀的情况。选取3种不同规格样品筛(40,60,65目,孔径0.45,0.30,0.25 mm),考察花椒样品不过筛及分别过3种筛后对去甲乌药碱含量的影响,结果见表1。可见,随着筛子孔径的减小,样品含量逐渐增加,样品未过筛与过筛后试验结果存在较大差异,其中过65目筛时含量最高,RSD值最小。

表1 样品筛孔径对去甲乌药碱含量结果的影响(n=6)Tab.1 Effect of different sieve sizes of samples on the content of higenamine(n=6)
2.4 方法学考察
系统适用性试验:精密吸取2.2项下对照品溶液10 μL,置1 mL容量瓶中,加甲醇定容,摇匀,取适量,另取2.2项下供试品(以花椒样品为例)溶液适量,按2.1项下试验条件进样测定,记录色谱图。结果供试品溶液色谱(图2)与对照品溶液色谱(图3)在相同保留时间处有相应色谱峰,去甲乌药碱拖尾因子为1.02,半峰宽为0.03,理论板数为25 843.49。

图3 对照品溶液的总离子流图1.HigenamineFig.3 Total ion chromatogram of the reference solution
线性关系考察:取2.2项下对照品贮备液适量,加入内标溶液适量,加甲醇稀释成系列对照品溶液。取2 μL,按2.1项下试验条件进样测定,记录峰面积。以去甲乌药碱质量浓度(X,ng/mL)为横坐标、内标峰面积和去甲乌药碱峰面积比值为纵坐标(Y)进行线性回归,得回归方程Y=0.247 28X+0.053 27(r=0.999 63)。结果表明,去甲乌药碱质量浓度在0.25~100 ng/mL范围内与内标峰面积和去甲乌药碱峰面积比值线性关系良好。
检测限与定量限考察:取阴性样品芹菜籽、甘牛至、茴香、芝麻适量,加入去甲乌药碱对照品溶液,按2.2项下供试品溶液制备方法制备溶液,按2.1项下试验条件进样测定,分别以信噪比(S/N)为3和10时的待测成分质量浓度作为检测限和定量限。结果去甲乌药碱的检测限为1 μg/kg,定量限为3 μg/kg。
精密度试验:精密吸取2.2项下对照品溶液适量,按2.1项下试验条件连续进样测定6次,记录离子强度。结果的RSD为1.42%(n=6),表明仪器精密度良好。
稳定性试验:取同一花椒供试品溶液适量,分别于室温下放置0,2,4,8,12,24 h时按2.1项下试验条件进样测定,记录离子强度。结果的RSD小于2.0%(n=6),表明供试品溶液在室温放置24 h内基本稳定。
重复性试验:取阳性样品桂皮适量,共6份,按2.2项下方法制备供试品溶液,按2.1项下试验条件进样测定,记录离子强度,并计算含量。结果去甲乌药碱的平均含量为6.67 μg/kg,RSD为1.33%(n=6),表明方法重复性良好。
加样回收试验:取芹菜籽、甘草、甘牛至、茴香、桂皮、芝麻、丁香7个香辛料样品适量,并分别加入低、中、高(2.0,4.0,20.0 μg/kg)质量浓度的对照品溶液和内标溶液各适量,平行制备6份,按2.2项下方法制备供试品溶液,再按2.1项下试验条件进样测定,记录离子强度并计算加样回收率。结果见表2。
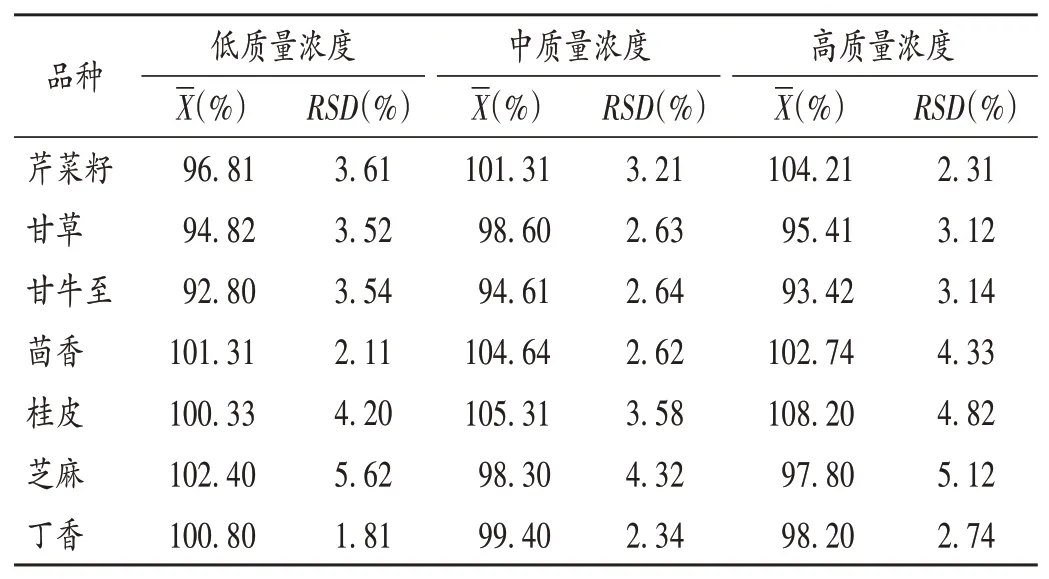
表2 加样回收试验结果(n=6)Tab.2 Results of the recovery test(n=6)
2.5 基质效应考察
取阴性样品芹菜籽、甘草、甘牛至、茴香、芝麻、丁香和阳性样品桂皮、花椒,分别加入2.2项下对照品溶液及内标溶液适量进行前处理,其中对阳性样品用内标溶液考察基质效应。分别以阴性对照品溶液配制标准溶液,以试剂溶液配置相同浓度标准溶液。基质效应因子(MEF)=基质标准溶液峰面积/溶剂标准溶液峰面积,当MEF为0.8~1.2时,基质效应不明显[17-21]。结果甘草、甘牛至、茴香、桂皮、芝麻、丁香、花椒、芹菜籽MEF范围在0.88~1.24。因此,该试验采用固相萃取净化,同位素内标法定量以最大程度降低基质效应,净化杂质。
2.6 样品含量测定
取36种香辛料样品各适量,按2.2项下方法制备供试品溶液,按2.1项下试验条件进样测定,记录离子强度并计算含量。结果除花椒、香叶、荜拨、白胡椒、桂皮5种香辛料中去甲乌药碱的含量测定结果分别为917.23,1 660.11,307.42,219.32,6.67 μg/kg,其余香辛料均未检出去甲乌药碱。
3 讨论
香辛料是日常生活中常见食材,品种多,成分复杂,基质干扰严重。现有的QuChERS法和直接提取法很难满足大部分香辛料中去甲乌药碱的含量测定。与QuChERS法和直接提取法相比,固相萃取技术具有较大优势,既改进了现有研究中提取方法存在的一些缺陷,提高了净化效果,降低基质效应,又解决了个别样品因无法找到空白基质溶液导致回收率差的问题,同时,采用UPLC-MS/MS法提高检测灵敏度,可解决现有研究中液相色谱无法准确定性的劣势。
综上所述,本研究中所建方法灵敏度高、结果准确性高、稳定性好、干扰小、重复性好。研究中充分考虑了不同样品基质对结果的影响,并选择同位素内标法定量来解决部分品种含有内源性物质以至于无法找到空白基质样本的问题。该方法不仅适用于香辛料中去甲乌药碱的含量分析,在食品、中药材的去甲乌药碱含量测定中也有一定的应用前景。运用所建立的试验方法对36种香辛料样品进行检测,样品含量结果可反映出不同品种的香辛料含量差异大,这对以后研究不同产地的同一品种香辛料有较大启发,可为今后制订相关质量标准提供理论依据。

