放牧藏绵羊瘤胃热休克蛋白70家族基因表达特征及其与微生物的互作研究
吕卫兵,牛 彬,沙玉柱,魏 红,史 浩,胡 江,王继卿,李少斌,罗玉柱,刘 秀
(甘肃农业大学 动物科学技术学院/甘肃省草食动物生物技术重点实验室,兰州 730070)
藏绵羊主要分布在青藏高原地区,是青藏高原最古老、特有的原始绵羊品种,为当地牧民提供了肉、毛、皮等生活物品,是当地不可或缺的经济动物[1]。瘤胃是反刍动物消化系统中最重要的消化器官,可以实现饲草的高效消化与吸收;也是反刍动物免疫系统的重要组成部分,其中瘤胃上皮屏障在抵御疾病的过程中发挥着重要作用[2]。瘤胃内含有大量的微生物,瘤胃微生物在饲草发酵和宿主能量供应过程中发挥着重要作用[3],可以通过分解纤维素和半纤维素等宿主不能直接利用的物质,从而为宿主提供能量和营养物质[4];除此之外,肠道微生物可以促进初始B细胞的分化、激活B细胞的多种TLR(Toll like receptor)配体,增加B细胞存活、抗原呈递和抗体产生,进而调控宿主的免疫系统[5];肠道微生物还可以直接通过其代谢物(短链脂肪酸、胆汁酸和色氨酸等)参与宿主免疫代谢过程[6-7]。由于青藏高原独特的自然环境和气候条件,牧场的天然牧草在5月初开始发芽,10月初开始枯萎,枯草期牧草的粗蛋白(CP)、粗脂肪(EE)等营养物质含量显著下降[8]。而藏绵羊在漫长的枯草期(10月至翌年4月)通过啃食枯草维持机体的基础代谢并维持种群繁衍[9-10],这与瘤胃微生物的协同进化作用有密不可分的联系。
热休克蛋白(Heat shock proteins,HSP)是一类对于维持细胞稳态至关重要的分子伴侣,在细胞应对各种环境胁迫的过程中起着重要的保护作用[11]。热休克蛋白70(HSP70)是目前研究最为广泛的HSPs家族,它作为一种细胞内源性保护蛋白,当机体或细胞遭受应激时,可以通过一系列的表达调控机制使表达量显著增加,并在一定的范围内通过维持机体或细胞的生理功能稳态来抵御或减缓应激对细胞的损伤[12],除此之外HSP70还在抗细胞凋亡和调节免疫反应等方面发挥着重要的调控作用[13]。其中,HSPA1A和HSPA8是HSP70家族最重要的组成部分[14],且共同参与细胞凋亡过程,促进HSP70抗凋亡性质的发挥[15];HSPA1A可通过抑制细胞凋亡因子(如FAS和BAX),促进抗细胞凋亡因子(如BCL2),发挥其抗细胞凋亡的特性[16-17];HSPA8作为促进蛋白质折叠的伴侣蛋白,不仅有助于细胞各种功能活动[18],还具有调控肿瘤细胞干性和免疫调节功能[19-20]。青藏高原除了高寒、缺氧、紫外线强等环境特点外,冬季昼夜温差大、短暂强降温以及长期寒冷环境刺激是造成藏绵羊生理机能失衡、导致免疫力和生产性能等下降的重要因素[21]。有研究报道,放牧藏绵羊瘤胃古菌种群(优势菌群)多样性随着牧草中结构性碳水化合物含量的升高而增大[22]。也有研究发现,藏绵羊瘤胃微生物与其代谢产物存在相关性,并通过影响瘤胃上皮相关基因活性调控其适应性[23]。因此,本研究对不同时期放牧藏绵羊瘤胃组织热休克蛋白70家族基因(HSPA1A、HSPA8)的表达特征及其瘤胃微生物菌群结构进行分析,探究不同时期宿主基因与微生物菌群在青藏高原特殊环境条件下的互作机制,为藏绵羊放牧管理、品种选育以及疾病预防提供理论基础。
1 材料与方法
1.1 试验设计与样品采集
试验样本选取于甘肃省甘南藏族自治州合作市佐盖曼玛乡(海拔3 300 m)牧户藏绵羊群体中,羊群采用传统自然放牧模式,且不进行任何补饲。分别在4月、6月、10月和12月进行样品采集,每个时期选择年龄相近(12±1月龄),体质量相近(35.12 kg±1.43 kg)以及健康状况良好的藏绵羊母羊6只,在羊只归牧后的次日早晨利用羊用胃管式瘤胃采样器采集瘤胃液(n=24),取适量分装于冻存管中,编号后储存于液氮中,以供后续16S rRNA分析。在采集每只羊的瘤胃液之前均需用蒸馏水将采集装置的管道和容器冲洗干净,防止样品之间的交叉污染。随后,从每个时期的6只藏绵羊母羊中随机选取3只进行颈部动脉放血屠宰(n=12),立即解剖并选取瘤胃腹囊部位剪取适量组织,用4 ℃预冷的生理盐水和PBS缓冲液冲洗干净,用吸水纸吸干多余的水分,分装于1.5 mL离心管中,编号后迅速储存于液氮罐中,带回实验室后在-80 ℃保存,用于后续的RNA提取。
1.2 瘤胃组织总RNA提取及cDNA合成
每份瘤胃组织样品分别取100 mg,用Trizol提取瘤胃组织总RNA,然后将提取的RNA用琼脂糖凝胶电泳检测其完整性,再通过蛋白核酸测定仪检测RNA的纯度和浓度,全部样品的吸收比(A260/A280)为1.8~2.1。最后通过gDNAwiper酶的反转录试剂盒进行cDNA的合成。
1.3 引物设计及合成
以β-actin为内参基因,用Premier 5.0对HSPA1A和HSPA8基因进行引物设计,引物信息见表1。

表1 引物信息Table 1 Primer information
1.4 荧光定量分析
以β-actin为内参基因,利用荧光定量PCR仪器(ABI Q6)进行荧光定量。反应条件:95 ℃预变性30 s;循环反应:95 ℃ 10 s,60 ℃ 30 s,40个循环;每次循环的最后一步收集SYBR green荧光信号,溶解曲线(95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s)。反应体系:20 μL体系,含有2XChamQ Universal SYBR qPCR Master Mix,cDNA模板和上下游引物。以β-actin作为内参基因进行 校正。
1.5 瘤胃微生物DNA提取及高通量测序
利用细菌DNA提取试剂盒MN NucleoSpin 96 Soi(Omega,中国上海)对24个瘤胃液样本(每个时期6个样本量,共4个时期)进行瘤胃液微生物组DNA的提取。编码细菌核糖体RNA的核酸序列保守区主要是16S区,使用通用引物(正向引物338F:5′-ACTCCTACGGGAGGCAGCA-3′和反向引物806R:5′-GGACTACHVGGGTWTCTAAT-3′)对16S rRNA基因高变区的V3~V4区进行PCR扩增,采用两步建库法对瘤胃微生物进行建库测序,将扩增产物在Illumina MiSeq 2500(Illumina,San Diego,CA,USA)平台进行建库测序分析。对 Reads 拼接过滤、质控评估后,基于Silva(细菌)分类学数据库对OTU进行分类学注释,获得各样品在属水平上的微生物群落信息。
1.6 数据分析
HSPA1A和HSPA8的相对表达量采用2-ΔΔCT的计算方法进行计算,最终试验数据用“平均值±标准差”表示;使用SPSS 22.0软件对数据进行分析,采用单因素方差分析,显著性水平为0.05。将瘤胃微生物的属水平丰度排名前20的物种与基因表达量进行相关性分析,采用Spearman 的方法进行计算,Spearman 相关系数阈值为0.1,显著性P值为0.05。
2 结果与分析
2.1 不同时期藏绵羊瘤胃热休克基因表达特征分析
如图1所示,不同时期藏绵羊瘤胃HSPA1A和HSPA8基因相对表达量存在显著性差异。其中HSPA1A在6月的表达量显著高于4月(P<0.05),极显著高于10、12月(P<0.01),且6月的表达量分别是10月、12月的4.21倍和11.86倍;HSPA8在6月的表达量极显著高于12月(P<0.01),且6月的表达量分别是10月、12月的2.93倍和9.19倍。
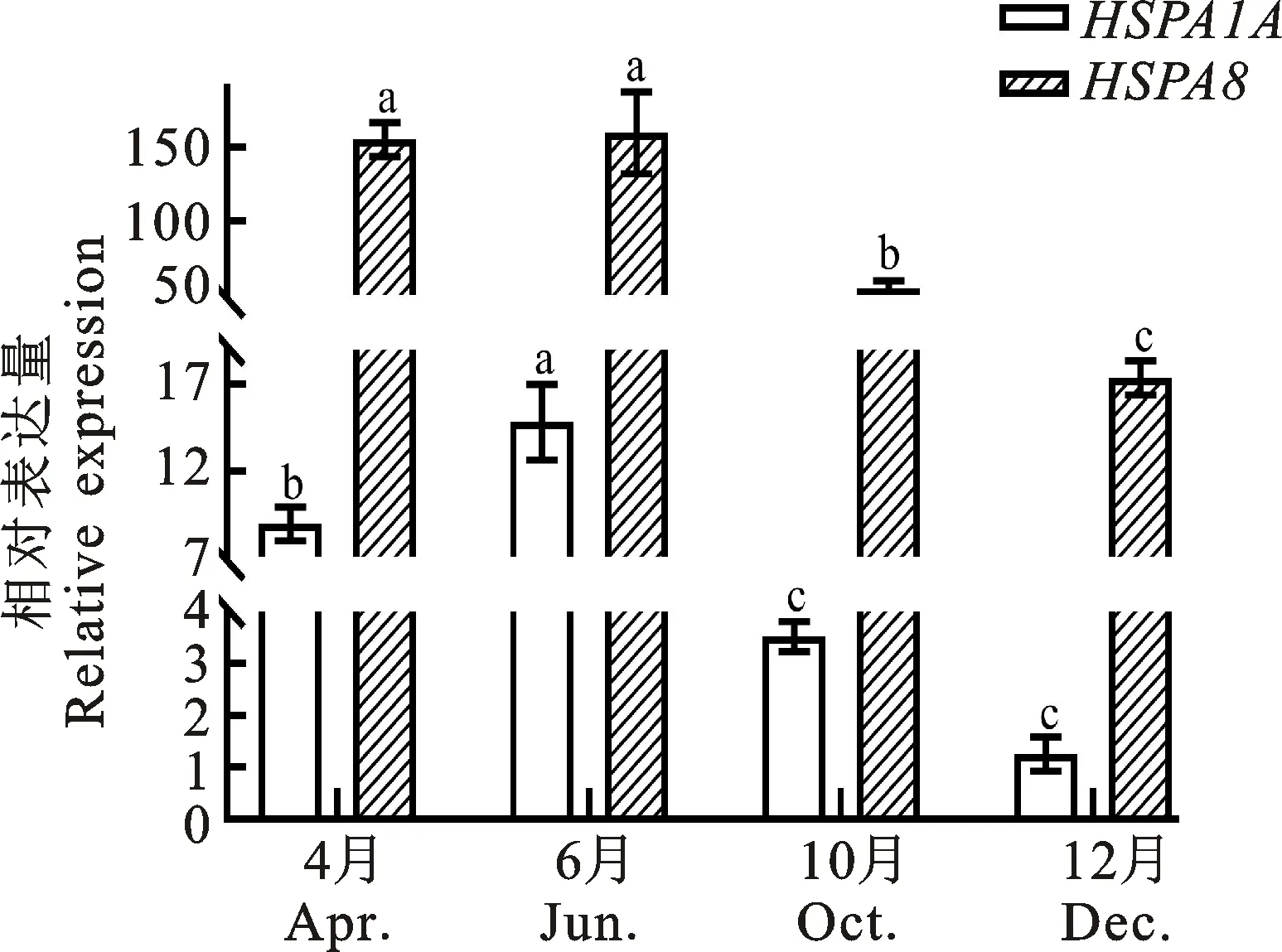
图中不同小写字母表示同一基因在不同时期的表达量存在显著性差异(P<0.05)。下同
2.2 不同时期瘤胃微生物菌群特征分析
2.2.1 瘤胃微生物组成及多样性分析 本研究对不同时期的24个样品进行16S rRNA测序,共获得1 919 292对 Reads,双端Reads质控、拼接后共产生1 835 963 条Clean Reads,每个样品至少产生73 683条Clean Reads,平均产生76 498条Clean Reads。稀释性曲线(图 2-A)可知,在 20 000 reads处曲线趋于平缓,即样本中的物种并不会随测序数量的增加而显著增多,测序覆盖比较全面,测序数据可靠性高,可进行后续的分析。根据Venn图(图 2-B)可见,不同时期藏绵羊瘤胃微生物共有978个OTUs,4月、6月、10月和12月特有OTU分别为14、4、3和1个。通过PCoA分析发现(图 2-C),不同分组的样品聚类明显,不同分组微生物之间存在明显差异。
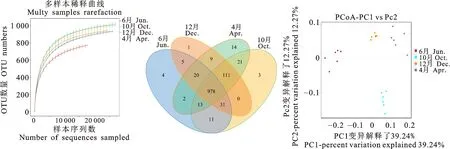
图2 稀释性曲线 (A)、OTU分布 (B)和PCoA分析(C)Fig.2 Dilution curve(A),OTU distribution(B) and PCoA analysis(C)
由表2可知,瘤胃微生物测序共获得1 223个OTU,并且测序覆盖率达到99.6%以上,其中,4月有952个,6月有819个,10月有1030个,12月有948个。由Shannon指数可知,4月和10月显著高于其他时期(P<0.05),即4月和10月的物种多样性显著高于其他时期;ACE和Chao1指数均在10月显著高于其他时期(P< 0.05),即10月的物种丰富度显著高于其他时期。
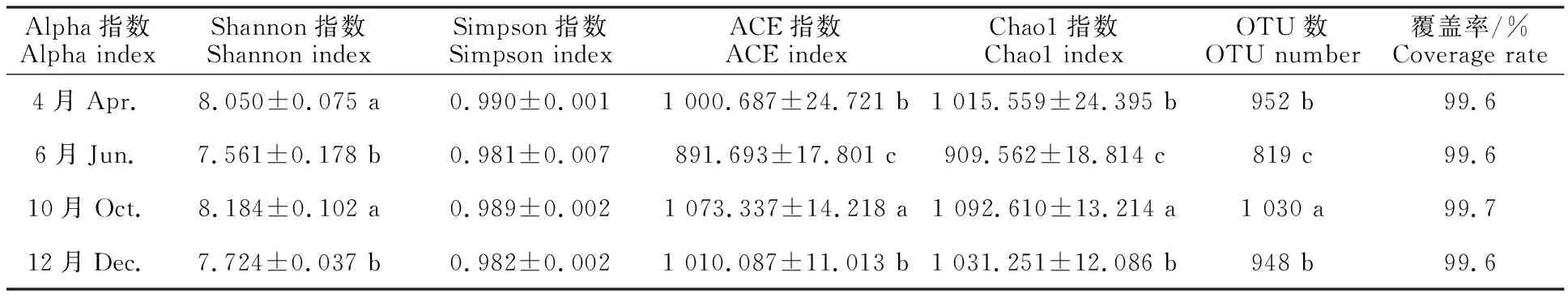
表2 2 Alpha多样性分析Table 2 Alpha diversity analysis
2.2.2 不同时期瘤胃微生物组成变化及差异性分析 在不同分类学水平,门水平共检测出17个物种,属水平共检测出149个物种。在门水平(图3-A),Bacteroidetes和Firmicutes在每个时期所占相对丰度的比例均最高,两者之和占总丰度的83.3%以上,其中,Bacteroidetes占53.4%以上,Firmicutes占27.4%以上,为优势菌门。Patescibacteria的丰度比例在不同时期均高于1%,且在不同时期间存在显著差异(P<0.05)。根据ANOVA(图3-C)进一步分析可知,门水平共有14个组间差异物种;丰度最高的Bacteroidetes在12月显著高于6月和10月(P<0.05);Firmicutes丰度在6月显著高于4月和12月(P< 0.05)。属水平物种组成如图3-B所示,其中,Prevotella_1、Rikenellaceae_RC9_gut_group、Christensenellaceae _R-7_group、Ruminococcaceae_NK4A214_group、Prevotellaceae_UCG-001、Ruminococcaceae_UCG-014、Ruminococcus_1和uncultured_bacterium_f_F082在每个时期相对丰度均大于1%;其中Prevotella_1(18.2%以上)、Rikenellaceae_RC9_gut_group(9.2%以上)在每个时期丰度比例均最高,为优势菌属。149个属中共鉴定出108个差异物种(P<0.05),根据ANOVA(图3-D)进一步分析可知,Rikenellaceae_RC9_gut_group在12月显著高于其他时期(P<0.05),Succiniclasticum和Butyrivibrio_2在6月显著高于其他时期(P<0.05)。
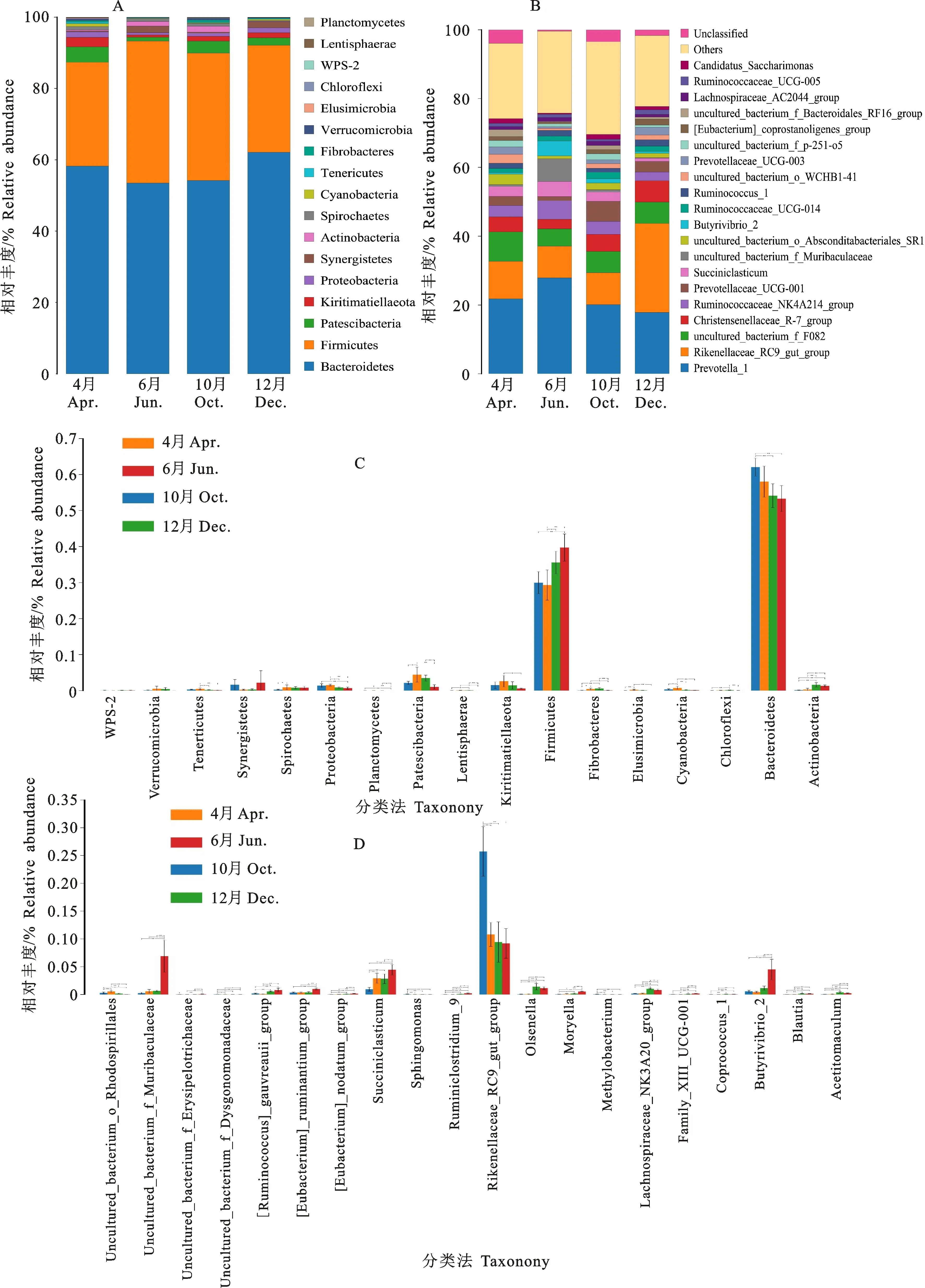
* P<0.05,** P<0.01,*** P<0.001。下同
2.3 瘤胃微生物与宿主基因相关性分析
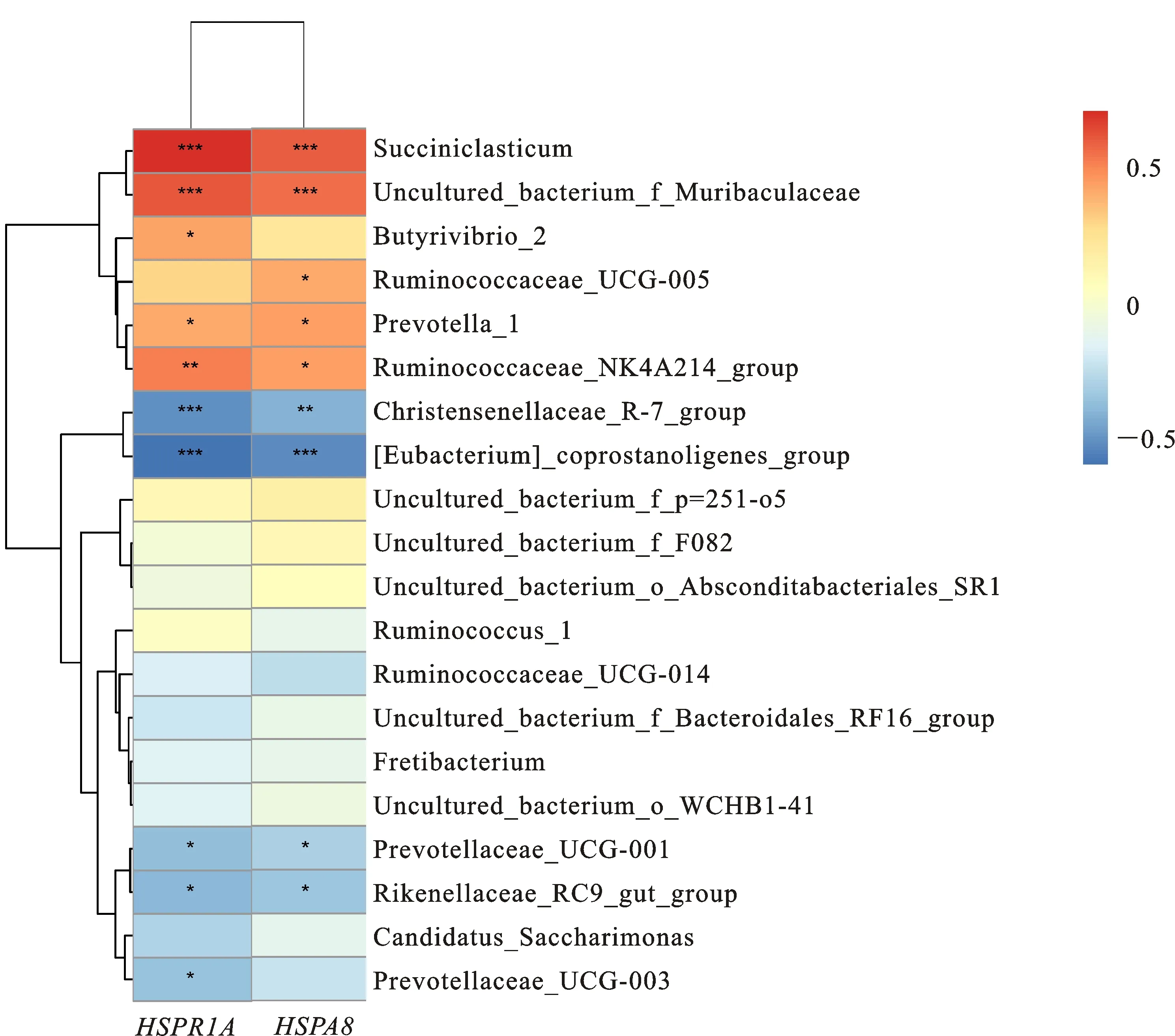
将不同时期HSPA1A和HSPA8的表达量与对应时期的瘤胃微生物(属水平丰度排名前20的物种)进行相关性分析,由相关性热图(图4)可知,HSPA1A、HSPA8与瘤胃微生物存在一定的相关性(P<0.05)。其中HSPA1A与Ruminococcaceae_NK4A214_group、Butyrivibrio_2、uncultured_bacterium_f_Muribaculaceae、Prevotella_1、Succiniclasticum存在显著正相关,与Prevotellaceae_UCG-003、Rikenellaceae_RC9_gut_group、Christensenellaceae_R-7_group、[Eubacterium]_coprostanoligenes_group、Prevotellaceae_UCG-001存在显著负相关;HSPA8与uncultured_bacterium_f_Muribaculaceae、Succiniclasticum、Ruminococcaceae_UCG-005、Prevotella_1、Ruminococcaceae_NK4A214_group存在显著正相关,与Rikenellaceae_RC9_gut_group、Christensenellaceae_R-7_group、[Eubacterium]_coprostanoligenes_group、Prevotellaceae_UCG-001存在显著负相关。
*P<0.05,**P<0.01,***P<0.001
3 讨 论
当动物遭受应激时,细胞会显著提高热休克蛋白的水平来抵抗应激对细胞的损伤[23]。一般来说,冷应激对动物免疫系统功能的影响主要是抑制性的。有研究发现HSP70表达量的增加,表明机体已遭受应激性损伤,从而提高机体的自我保护机能,以便增强对外界不良刺激的抵抗力[24]。HSPA1A是应激诱导性HSP70家族中最具有代表性的伴侣蛋白,此类蛋白在正常生理状态下不表达或低表达[25]。本研究中HSPA1A和HSPA8在不同时期瘤胃中的表达量存在显著差异,其中6月表达量显著高于10月和12月。青藏高原牧场中青草期(6月至8月)牧草营养含量(粗蛋白)高于返青期和枯草期,且生物量在8月达到巅峰[26];永结[27]研究发现,藏绵羊免疫力在青草期达到峰值,可以有效抵御外来抗原的入侵,但在枯草期和返青期免疫力低下,发病率增加。这与本研究结果一致,即藏绵羊瘤胃的免疫力在6月增强,而牧草的营养含量的升高在一定范围会提高藏绵羊瘤胃免疫力。
高原反刍动物的营养摄入模式随季节变化而变化,牧草的营养成分以及环境变化对宿主肠道微生物组成有显著影响[28],在影响瘤胃菌群结构的众多因素中,饮食是最重要的[29]。本研究中不同时期瘤胃微生物菌群丰度与多样性存在显著差异,这与不同时期牧草营养成分的变化有关。Bacteroidetes的成员可以将饲料中蛋白质和碳水化合物有效分解为SCFAs,为宿主提供能量[30],还可以促进瘤胃的生长和瘤胃体积的增加[31];Rikenellaceae_RC9_gut_group参与降解植物来源的多糖[32],其相对丰度随着饲草纤维含量的增加而增加[33],本研究中,Bacteroidetes、Rikenellaceae_RC9_gut_group在12月显著高于6月和10月,其主要功能是降解枯草期牧草中的多糖,更彻底地分解牧草,为机体提供更多的能量。Firmicutes可以促进VFAs可以转化为葡萄糖,并促进瘤胃上皮细胞对葡萄糖的吸收,防止瘤胃酸中毒[31],Succiniclasticum可将琥珀酸盐转化为丙酸;Butyrivibrio_2属于纤维分解菌,在瘤胃中对降解纤维素物质产生VFAs起着关键作用[34-35];本研究中,Firmicutes、Succiniclasticum和Butyrivibrio_2在6月显著高于4月和12月,其主要功能是在青草期防止瘤胃酸中毒而转运更多的VFAs,也进一步为宿主提供更多的能量。Kim等[36]研究发现低海拔家畜瘤胃微生物中Bacteroidetes(31%)显著低于Firmicutes(56%);而本研究所有时期的Bacteroidetes(53.5%)丰度显著高于Firmicutes(27.4%),即青藏高原藏绵羊瘤胃中Bacteroidetes在牧草分解和能量供应过程中发挥着更加重要的作用。Prevotella_1的丰度与饮食营养的变化有关(如蛋白质和淀粉的减少可导致Prevotella_1丰度的降低)[37],也与丙酸的产生有关[38];Christensenellaceae_R-7_group主要分解纤维物质[39]。相关性分析发现,不同时期藏绵羊瘤胃微生物与HSPA1A和HSPA8存在一定的相关性,其中HSPA1A和HSPA8与Prevotella_1、Succiniclasticum存在显著正相关,与Rikenellaceae_RC9_gut_group、Christensenellaceae_R-7_group存在显著负相关;即瘤胃微生物在一定程度上可以对宿主的免疫功能产生影响,且HSPA1A和HSPA8的表达与牧草营养成分含量呈正比,与纤维素含量呈反比。
4 结 论
不同时期放牧藏绵羊瘤胃上皮HSPA1A和HSPA8表达量以及瘤胃微生物菌群丰度和多样性均存在一定差异,青草期(6月份)热休克蛋白表达量显著升高,从而导致其免疫力6月份显著升高;而微生物菌群结构随着不同时期环境的变化,其微生物多样和丰度发生显著变化,主要体现在一些与纤维物质降解、能量相关的差异微生物的变化,其目的是彻底分解牧草以达到对牧草的充分利用,为宿主提高更多的能量。进一步相关性分析发现,不同时期差异微生物与宿主上皮基因之间存在一定的相关性,表明瘤胃微生物在一定程度上可以对宿主的免疫功能产生影响。

