丛枝菌根真菌对白刺花苗期抗旱酶系及生理特性的影响
田 方,陈 锡,,钟 理,李 岩,王普昶,
(1.贵州大学 生命科学学院/农业生物工程研究院,山地植物资源保护与保护种质创新教育部重点实验室,贵州省农业生物工程重点实验室,贵阳 550025;2.贵州省农业科学院,贵州省草业研究所,贵阳 550006)
白刺花(Sophoradavidii)是豆科槐属多年生灌木或小乔木。它具有抗逆性强、适应性广、适口性好、营养价值高、水土保持能力强等优良特性,是干旱、贫瘠地区的节水抗旱先锋植物,被广泛应用于畜牧业[1-3];该植物还是一种民间草药,已被证明是类黄酮、生物碱、类固醇、木脂素和酚酸的丰富来源,其根、叶、花和果实用于治疗腹泻、膀胱炎、胃痛、水肿和疥癣等疾病[4-6]。贵州槐属植物种质资源较为丰富,具有极高的观赏价值、药用价值和生态防护等用途。然而贵州是典型的喀斯特山区,地表裸露着大面积的碳酸盐、石漠化和水土流失严重、旱灾频发,但喀斯特山区水热条件好,适合灌木、草本植物生长,充分合理利用地理条件优势,开展对槐属植物白刺花抗旱栽培技术研究,建立草地农业生态循环系统,对喀斯特山区生态恢复具有重要的实际应用价值[7-8]。
丛枝菌根是球囊菌门真菌与植物根系形成的互惠共生体。相关研究表明约80%的陆地植物与AMF存在共生现象[9]。寄主植物通过光合作用合成碳源,并将其传送给AMF,提供菌丝生长和孢子发育所需营养和能量,同时AMF帮助寄主植物吸收矿质养分,促进植物生长发育,气孔开闭、渗透调节和抗氧化保护系统等一系列生理生化反应,诱导植物提高对逆境胁迫的抗性[10]。AMF与植物共生互作一直是菌根领域的研究重点内容之一,在增强植物抗旱性、提高对高低温的耐受性、增强耐盐及耐酸能力、缓解重金属对植物的毒害,以及提高植物抗病性和抗虫性等方面有着重要作用[11-12],而其中有关AMF提高植物抗旱性的报道较多,如干旱条件下柑橘(Poncirustrifoliata)接种AMF后发现菌根吸水能力提高2~7倍,显著提高了植株的抗旱能力[13];烤烟(NicotianaL.)幼苗侵染AMF后,烟苗氮、磷、钾含量增加及抗旱性大幅提升[14];构树幼苗接种AMF后可以缓解干旱胁迫对幼苗生长和光合参数的影响,提高其抗旱性[15]。施用AMF可以提高植物抗旱性,发挥作用的大小因菌剂种类、施用方式及实施对象具有一定差异[16-18]。岳海等[19]对澳洲坚果幼苗接种土著AMF后发现植株根系的定植能力更强,抗旱性增强;许庆龙等[20]对南高丛蓝莓接种4种AMF后发现植株根、茎、叶的磷和钾含量以及根围土壤酸性磷酸酶、脲酶和过氧化氢酶活性增加,尤以侵染摩西球囊霉菌时抗旱效果最佳。另外在小麦(TriticumaestivumL.)、任豆 (Zeniainsignis)和西红柿(Lycopersiconesculentum)等作物中普遍发现接种AMF能提高宿主植物的抗旱性[16-18]。
目前,对干旱胁迫下AMF与白刺花抗旱性的相关研究鲜有报道。本研究对干旱处理后白刺花幼苗施用3种种属和4个浓度梯度的AMF,测定白刺花叶片过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide disimutase,SOD)、过氧化物酶(peroxidase,POD)、谷胱甘肽S-移换酶(glutathione S-transferase,GST)等酶活性和丙二醛(malondialdehyde,MDA)含量,还测定淀粉、可溶性糖和纤维素等生理生化指标,探究AMF对白刺花苗期抗旱酶系及生理特性的影响,并进行综合评价,筛选出最优AMF菌株及最适浓度,为喀斯特山区白刺花节水抗旱调节措施提供科学理论依据。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 试验材料为贵州省草业研究所审定品种‘盘江白刺花’(Sophoradavidii(Franch.) Skeels),种植于贵州省草业研究所温室大棚内[光照强度为 700 μmol·m-2·s-1,温度为(20±5) ℃,光照14 h,黑暗10 h,湿度为60%] 。
1.1.2 供试菌种 供试菌种为根内球囊霉1株(Glomusintraradices,BEG Number 193,简称 BEG-193),幼套球囊霉1株(Glomusetunicatum,BEG Number 168,简称BEG-168),摩西球囊霉1株(Glomusmosseae,BEG Number 167,简称BEG-167)。3株菌种由贵州大学山地植物资源保护与保护种质创新教育部重点实验室惠赠。试验前经高粱(SorghumbicolorL.) Moench)扩繁后得到由孢子、菌丝、菌根节段和培养基质组成的菌剂。
1.2 材料处理
选取籽粒饱满、大小均一的白刺花种子,自来水冲洗2 h,浸泡24 h。用75%的酒精浸泡 1 min,蒸馏水冲洗3~4次,然后用84消毒液浸泡2 min,蒸馏水冲洗3~4次,置于30 ℃恒温箱中催芽。待种子自然萌发后采用育苗穴盘(上口径60 mm;底部28 mm;深度53 mm)进行育苗,选取长势一致且无病虫害的幼苗。试验共设空白对照CK(未接种处理接等量灭菌真菌接种物)+3种AMF接种物(培养基质、孢子、菌根根段和菌丝作为接种物),每种真菌分别设置3个浓度梯度10%、20%、40%(对应每处理分别施用20、40、 80 g菌剂)。将灭菌的基质装入塑料花盆中,每盆装入供试基质(营养土+蛭石)和相应浓度的真菌接种物,共0.2 kg。每个处理生物学重复10次。前期正常浇水,进行缓苗处理,缓苗生长15 d后,根据叶片特征变化,自然状态下连续干旱处理10 d后测定其叶片生理生化指标。
1.3 生理生化指标测定
选取白刺花植株中上部、受光较一致的第 3~7片功能叶,擦净表面污渍后用液氮速冻,置于-80 ℃保存,备用。按SOD抑制氮蓝四唑(NBT)光化还原法[21]测定叶片超氧化歧化酶(SOD)活性;采用紫外吸收法[22]测定过氧化氢酶(CAT)活性;采用硫代巴比妥酸法[23]测定丙二醛(MDA)含量;采用愈创木酚法[24]测定过氧化物酶(POD)活性;采用蒽酮法[21]测定可溶性糖、纤维素和淀粉含量。每处理3次生物学重复,每个重复3个技术重复。
1.4 数据处理
采用 Excel 2010 软件进行数据统计和作图,用 SPSS 24.0软件进行相关性分析和单因素方差分析(ANOVA)并通过Duncan氏法在α= 0.05时进行多重比较。对所测样本的数据进行相关性分析、主成分分析,采用隶属函数分析法综合评价3种AMF对白刺花抗旱性的影响[25]。
2 结果与分析
2.1 AMF对白刺花表型特征的影响
干旱胁迫下接种不同种类、不同浓度AMF,白刺花表型表现出明显差异(图1)。在适宜浓度的AMF处理下白刺花叶片长势良好,干旱症状明显减弱,对照(CK)则表现出叶片明显萎蔫卷曲,叶尖和叶基出现焦枯甚至出现植株死亡等症状,表明AMF可能具有提高白刺花抗旱能力的作用。

A.摩西球囊霉菌;B.幼套球囊霉菌;C.根内球囊霉菌
2.2 AMF对白刺花抗旱酶系的影响
由表1可知,在干旱胁迫下,接种不同种类的AMF后白刺花叶片的抗氧化酶和解毒酶活性显著上升(P<0.05)。接种40%根内球囊霉菌,CAT和POD酶活最高,与未接种相比差异显著;接种40% 幼套球囊霉菌时,SOD和GST酶活最高,上升幅度最大,差异达到显著性水平。由试验结果可知,接种适宜浓度的AMF可以极大的提高白刺花叶片的CAT、POD、SOD和GST酶的活性,有效的缓解干旱胁迫对白刺花叶片造成的氧化损伤。

表1 干旱胁迫下AMF对白刺花抗旱酶系的影响Table 1 Effect of AMF on drought-resistant enzymes of Sophora davidii under drought stress
2.3 AMF对白刺花生理指标的影响
由图2可知,干旱胁迫处理下,施用3种不同浓度的AMF后白刺花叶片的淀粉、可溶性糖、纤维素和MDA含量发生显著性变化(P<0.05),接种40%幼套球囊霉菌时,淀粉含量最高,增长58.2%,与对照相比有显著性;当接种40%摩西球囊霉菌时,可溶性糖含量最高,提高25.3%,差异显著;接种20%根内球囊霉菌时,纤维素含量最多,增加45.5%,与未接种相比有显著性差异;当接种20%幼套球囊霉菌时,MDA含量最低,差异达到显著水平。以上结果表明,施用适宜浓度的AMF可以显著提高白刺花叶片淀粉、可溶性糖和纤维素含量,降低MDA含量,以此来降低干旱胁迫带来的伤害。不同菌株和不同浓度的AMF在不同抗旱指标上各有优势和劣势,很难判断各浓度AMF的总体抗旱水平,因此要对各AMF的抗旱指标进一步分析,进行综合评价。
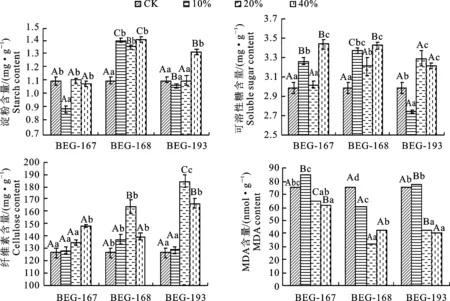
不同大写字母表示同一浓度处理下不同AMF间差异显著,不同小写字母表示同一AMF不同处理间差异显著(P<0.05)
2.4 干旱胁迫下白刺花叶片各抗旱指标的相关性分析
对干旱胁迫下白刺花的生理生化指标进行相关性分析,结果由表2可知,在淀粉、CAT、GST、POD和SOD中,任意2个指标之间均呈现极显著正相关(P<0.01),其中淀粉与GST的相关系数最大为0.808,而淀粉与CAT的相关系数最小为0.596;而MDA与淀粉、CAT、GST、POD、SOD、可溶性糖、纤维素之间呈现极显著负相关(P<0.01),其中最大系数为0.760,最小为0.525。8个抗旱指标之间都存在一定的相关性,说明干旱胁迫下对白刺花施加AM真菌使其提高抗旱能力是由多方面因素综合决定的。
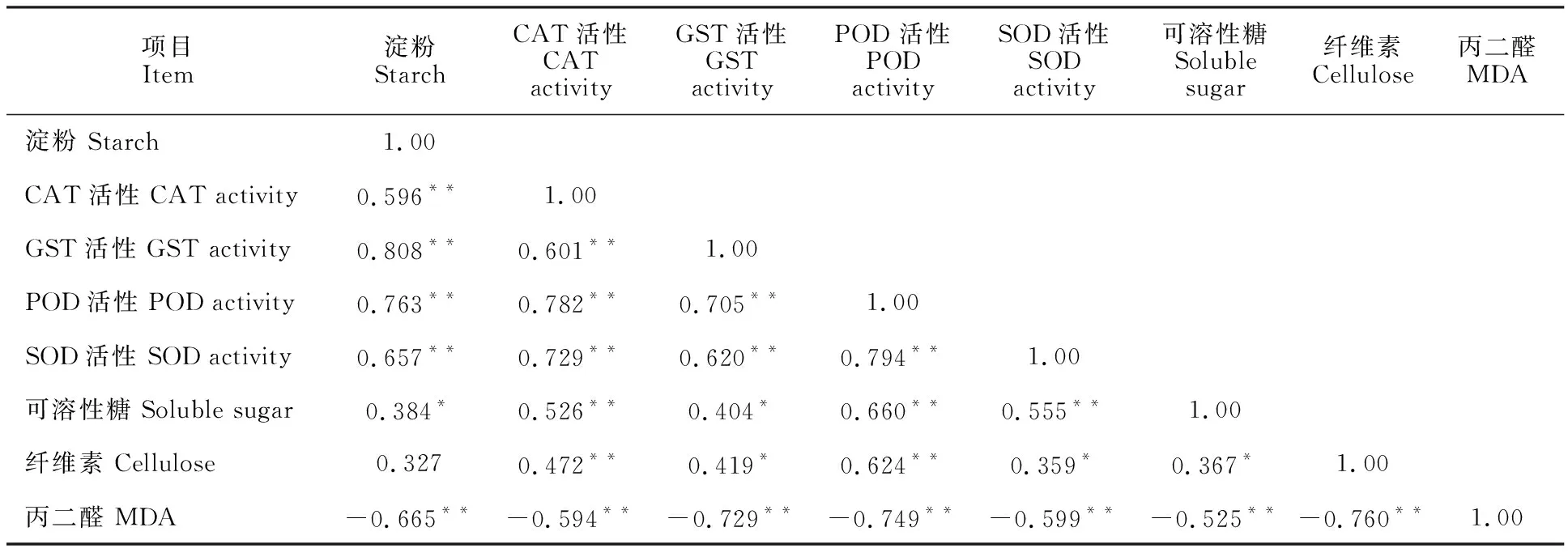
表2 白刺花叶片各抗旱指标相关性分析Table 2 Correlation analysis of drought resistance indexes of Sophora davidii leaves
2.5 干旱胁迫下白刺花叶片各抗旱指标主成分分析
将白刺花幼苗的8个综合抗旱指标数据进行主成分分析,由KMO和Bartlett检验结果得KMO 为0.790,大于0.5的标准;显著性为 0.000,小于显著水平0.05,适用于主成分分析方法。根据各主成分的特征值和贡献率进行主成分提取,由表3可知特征值大于1的主成分有2个,第一主成分的特征值为5.053,方差贡献 63.16%,第二主成分的特征值为1.067,方差贡献13.33%。两个主成分累积贡献率达到 76.50%,可将前2个主成分的指标作为AM真菌耐旱处理的综合评价指标。
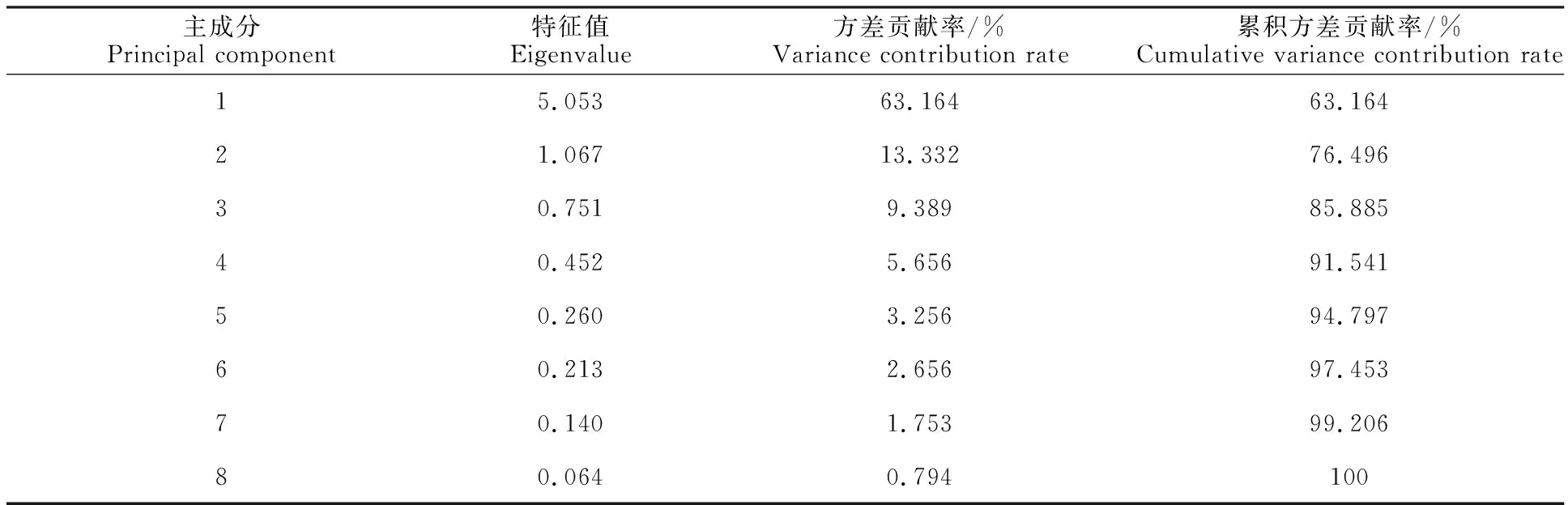
表3 白刺花叶片各抗旱指标特征值和累积方差贡献率Table 3 Eigenvalues and cumulative variance contribution rate of each drought resistance index of Sophora davidii leaves
由表4可知,除了MDA对第一主成分产生负向影响外,其余的指标均产生正向影响,载荷数都比较高,POD最高,为0.944;对第二主成分产生负向影响的指标有可溶性糖和纤维素,载荷数为-0.071和-0.713,正载荷指标中淀粉最高,为载荷值0.355。
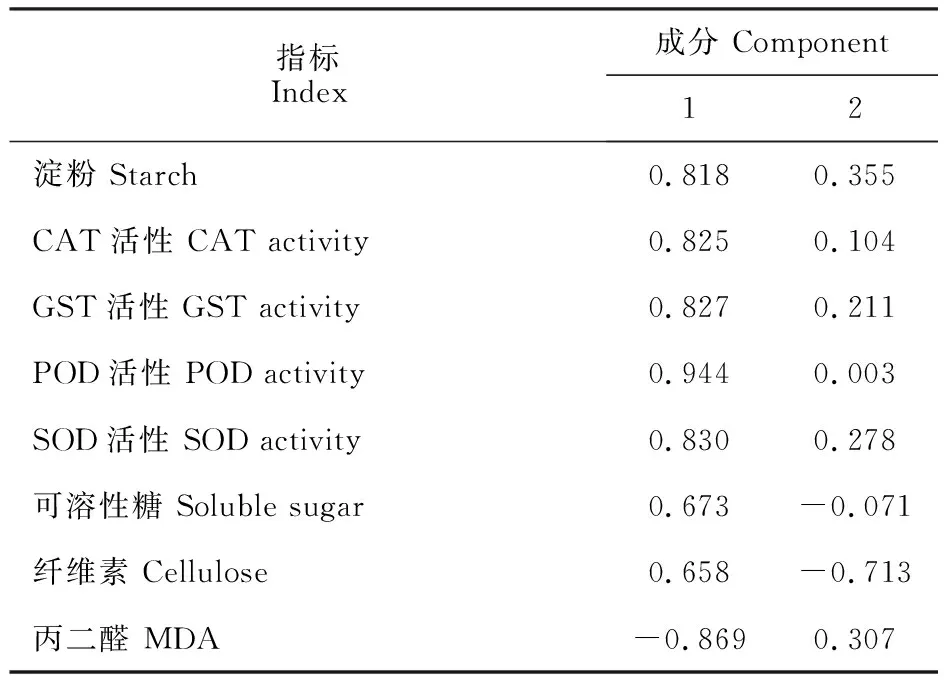
表4 白刺花叶片各抗旱指标主成分荷截得分矩阵Table 4 Principal component charge cut-off score matrix of drought resistance index of Sophora davidii leaves
2.6 不同浓度的AMF对白刺花幼苗生长抗旱酶系和生理指标的综合评价
对白刺花幼苗施加不同种属和不同浓度的AMF,使其增强应对干旱胁迫的能力,为了科学地评价AMF对白刺花抗旱性的影响,筛选最佳的菌种和浓度,采用隶属函数综合评价法,分别计算出各浓度菌种接种后,白刺花的抗旱指标的隶属函数值,把各项指标的隶属函数值累加,取其平均值。隶属函数均值越大,AMF提高白刺花的作用效果越明显。由表5可知,3个菌种的平均隶属函数值为0.168~0.847,菌种间差异较大,其中幼套球囊霉菌的抗旱性最佳。施用不同浓度的3种真菌,白刺花抗旱效果排序依次为:40% BEG- 168>40% BEG-193>20% BEG-168>20% BEG-193>10% BEG-168>40% BEG-167>20% BEG-167>10% BEG-167>10% BEG-193>CK,结果显示:接种40%幼套球囊霉菌时抗旱效果最佳。
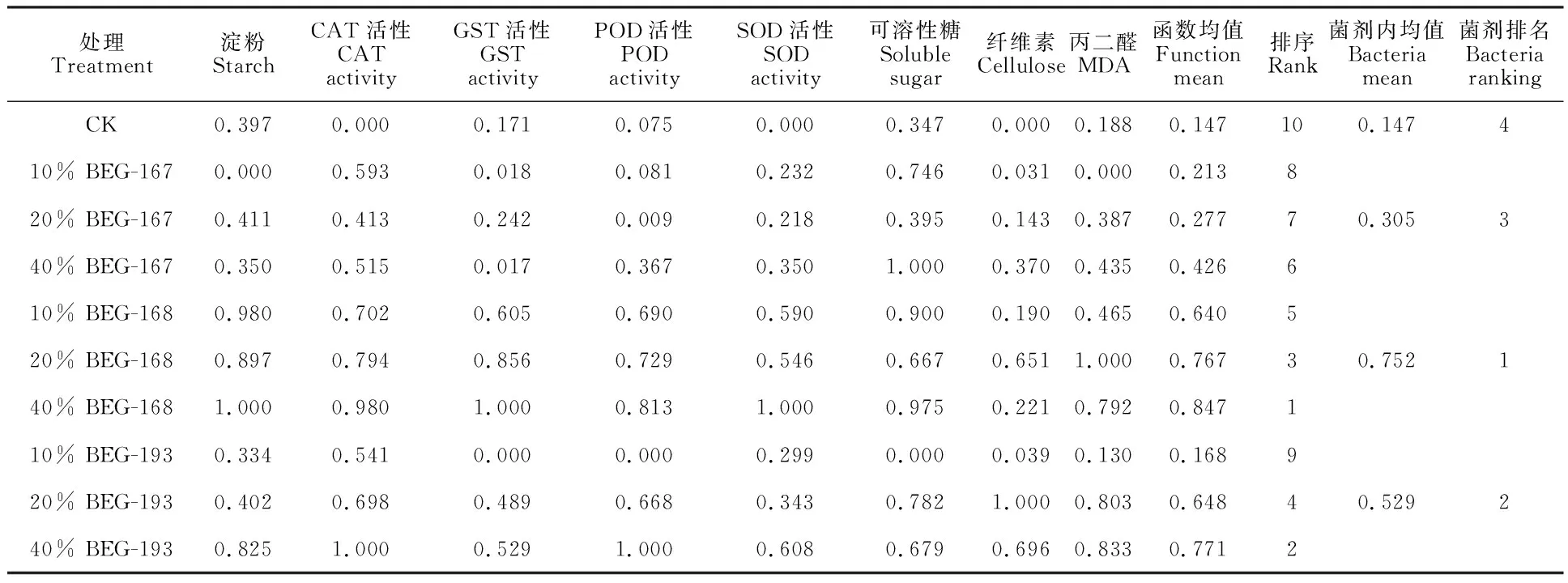
表5 白刺花幼苗抗旱指标的隶属函数综合评价Table 5 Comprehensive evaluation of subordination function of drought resistance indexes of Sophora davidii seedlings
3 讨 论
干旱是限制喀斯特山区植被生长的主要原因之一,白刺花作为喀斯特山区广泛分布的灌丛群落优势种,已成为干旱、贫瘠地区水土保持和饲料行业的理想材料[26-27],而AMF与植物的共生关系又可有效提高对干旱逆境的耐受性[10],因此研究AMF与白刺花幼苗共生对干旱胁迫的适应策略,对喀斯特地区饲料资源开发和生态植被恢复都具有重要的理论与实践指导意义。
在长期的进化过程中,植物通过一系列特征变化、生理生化响应等机制,以缓解干旱胁迫带来的损害[28]。如植物体内的抗旱酶(SOD、POD、CAT和GST)主要是通过促进H2O2分解为分子氧和水,清除体内过量的过氧化产物和脂质氢过氧化物,以防止ROS(reactive oxygen species,不完全还原的氧,自由基和非自由基)过度积累而导致细胞损伤和死亡。CAT、POD、SOD和GST是植物体内主要的抗环境胁迫的酶系,通过它们的变化程度可以反映植物的抗逆性。本研究中白刺花幼苗接种3种AMF后均表现出较高酶活性,说明AMF侵染能有效清除胁迫下产生的有害活性氧自由基,降低胁迫带来的伤害。许庆龙等[20]对南高丛蓝莓接种四种AMF后,发现叶片SOD活性均显著高于未接种株,其中以摩西球囊霉菌的抗旱效果最佳;刘兆娜等[29]研究发现,百合混合接种摩西球囊霉和地表球囊霉菌种后生长加快,植株体内CAT、POD和SOD活性提高。接种不同菌株的AMF抗氧化酶的变化程度不同,说明白刺花在不同环境中对过氧化物积累和过氧化物清除能力有差异,这与鲍根生对小花棘豆(OxytropisglabraDC)接种丛枝菌根真菌后的研究结果类似[30]。MDA作为植物细胞膜脂过氧化的产物,植物受到氧化伤害的程度越小体内积累MDA量越少[31-32]。邓杰等[33]研究发现,AMF的存在可以缓解逆境胁迫对植物造成的伤害,接种AMF后在一定程度上不仅能促进植物生长、磷吸收以及光合作用的进行,提高抗氧化酶活性,还能降低丙二醛(MDA)浓度。本研究发现AMF侵染白刺花后,丙二醛(MDA)浓度显著低于对照,植株受到的氧化伤害降低,这与邓杰等[33]研究结果类似。
在生理生化适应性方面,AMF共生是植物应对干旱胁迫环境的重要途径[34],表现为:增加土壤水分摄取,增强植物吸收水分的能力;提高抗氧化酶活性,降低氧化损伤;调节内源激素和渗透压平衡、促进植物吸收养分;增加叶绿色含量,促进光合效率,提高宿主植物抗逆性[35-38]。本研究中接种摩西球囊霉菌能显著提高白刺花叶片渗透调节物质可溶性糖含量,改变植物糖代谢水平,以维持细胞的渗透势,增强细胞的保水能力,从而增强白刺花对干旱胁迫的耐受性。Wu等[39]在干旱条件下接种AMF也显著提高枳(PoncirustrifoliaL.)叶片中渗透调节物质含量,进而增强其抗旱性;刘兆娜等[29]在干旱条件在对百合接种AMF后发现,可溶性蛋白、可溶性糖含量分别比对照提高了25%和46%,减轻膜脂氧化的伤害,增强非酶促防御系统能力,增强植物细胞的抗旱能力。而淀粉和纤维素作为植物体内重要碳水化合物和能量储存体,当遭遇干旱胁迫时,植物体内的淀粉和纤维素可能会分解成糖类来抵御逆境,以维持渗透压平衡,增强植株耐旱性,以保持正常的生命活动[40-41]。本试验中干旱条件下接种AMF后,白刺花幼苗的淀粉和纤维素的含量显著高于对照(P<0.05),从而增强植株对干旱胁迫的耐受性。这与孙悦燕等[42]对干旱条件下华北落叶松幼苗接AMF后研究结果相似。
本研究采用隶属函数综合评价法,评价了不同菌株和浓度的AMF对白刺花幼苗生理生化抗旱指标的影响,在一定程度上宏观清晰地得出各浓度菌株综合评价值。但在实际应用中,由于受到不同品种、生长环境和干旱程度不一致等情况的影响,结果可能存在着一定的局限性,因此需要对植株的生境进行全面考虑,针对性地选择适宜浓度的AMF。
4 结 论
干旱条件下对白刺花施加适宜浓度的AMF能提高白刺花叶片的渗透调节物质含量、抗旱酶活性,降低叶片的MDA含量,提高淀粉和纤维素含量以改变糖代谢水平,提升白刺花的抗旱性。综合分析比较不同AMF处理对干旱条件下白刺花幼苗抗氧化酶和生理特性的影响发现,3种AMF对白刺花幼苗的抗旱提升效果排序依次为幼套球囊霉菌>根内球囊霉菌>摩西球囊霉菌,且在施用浓度40%的幼套球囊霉菌时抗旱效果最佳,为白刺花节水抗旱栽培技术研发及AMF的推广应用提供科学理论依据。

