枸杞内生嗜线虫镰刀菌对灵武长枣采后致腐真菌的抑制作用
张强强,任苗苗,顾沛雯
(宁夏大学 农学院,宁夏 银川 750021)
灵武长枣是宁夏最具特色的地方品种,皮薄、多汁,但鲜销期短,采后如储运不当,腐败现象严重[1]。研究发现,交链格孢(Alternariaalternata)、灰葡萄孢(Botrytiscinerea)、米根霉(Rhizopusoryzae)、出芽短梗霉(Aureobasidiumpullulans)和球派伦霉(Peyronellaeaglomerata)等病菌侵染是导致灵武长枣采后腐烂的主要病原菌,其中交链格孢和灰葡萄孢是灵武长枣采后腐烂的优势病原真菌[2-3]。目前,灵武长枣采后的保鲜措施以物理保鲜和化学保鲜为主,物理保鲜以低温冷藏最为常见,此法成本和能耗高,温度调控不当易引发果实冷害[4];化学保鲜是利用化学制剂抑菌保质,此法存在果品污染、农药残留超标和抗药性等问题,也备受消费者抵制[5]。因此,寻求安全、有效的灵武长枣采后防腐保鲜新技术迫在眉睫。
植物内生真菌是指其生活史的某一阶段或全部处于宿主植物组织中,但不会对宿主植物产生明显病害症状的一类真菌[6]。植物内生真菌长期与宿主植物协同进化,可促进植物生长,提高植物抗逆性。作为潜在生防因子,植物内生真菌还可通过与病原菌争夺营养物质和空间而达到防治病害的目的[7]。近年来,利用内生真菌作为生物保鲜剂来防治果蔬采后病害的研究已取得了重大进展,如核桃内生真菌裂褶菌(Schizophyllumcommune)SYS-5-2发酵产物对苹果腐烂病原菌黑腐皮壳菌(Valsaceratosperma)和水稻纹枯病原菌菌核菌(Thanatephoruscucumeris)的抑制率达90.00%以上[8];疏花水柏枝内生真菌草酸青霉(Penicilliumoxalicum)发酵液粗提物能较好地抑制橘青霉(Penicilliumcitrinum)的生长,有效阻止柑橘果实腐烂[9]。但有关利用植物内生真菌来防治灵武长枣采后病原真菌危害和延长鲜果货架期的相关研究尚未见报道。
枸杞内生嗜线虫镰刀菌(Fusariumnematophilum)NQ8GⅡ4分离自健康枸杞根部,前期研究发现,其能抑制枸杞胶孢炭疽菌(Colletotrichumgloeosporioides)和灰葡萄孢菌丝的生长,并能产生挥发性抑菌物质,具有良好的生防潜力[10]。为此,本研究以枸杞内生嗜线虫镰刀菌NQ8GⅡ4菌株为材料,通过皿内对峙培养和离体保鲜试验,探究其对灵武长枣采后优势致腐病原真菌交链格孢和灰葡萄孢的抑菌作用及对采后灵武长枣的保鲜效果,以期为灵武长枣采后生物保鲜提供参考。
1 材料与方法
1.1 供试材料
供试菌株及药剂:枸杞内生真菌NQ8GⅡ4(CGMCC No.19271、专利号:CN202010357046.4),从健康枸杞根部分离纯化,经形态学和分子生物学鉴定,该菌为嗜线虫镰刀菌[10];交链格孢、灰葡萄孢、米根霉、出芽短梗霉和球派伦霉,从采后腐烂的灵武长枣上分离纯化[3],均保存在宁夏大学病理实验室;50%多菌灵,购自江苏三山农药有限公司(推荐用量为2 g/L)。
供试果品:2019年9月至11月,在宁夏灵武市大泉林场采摘无病虫害及机械损伤的棚栽八成熟灵武长枣(红色面积占枣果总面积的1/2~2/3),用于保鲜试验。
1.2 菌株NQ8GⅡ4的抑菌活性测定
以交链格孢和灰葡萄孢为靶标菌,采用皿内两点对峙法测定NQ8GⅡ4对靶标菌的抑制作用[10]。具体方法:在距PDA平板中心2.5 cm的一端接种1个直径6 mm的NQ8GⅡ4菌饼,另一端接种1个直径6 mm的靶标菌菌饼,置于 25 ℃霉菌培养箱中培养。试验设同时接种菌株NQ8GⅡ4和靶标菌、接种菌株NQ8GⅡ4 4 d后再接种靶标菌和接种靶标菌4 d后再接种菌株NQ8GⅡ4 3个处理,以只接种靶标菌菌饼的平板为对照,每处理重复4次。待对照组靶标菌菌丝长满培养皿后,测量其半径(Rc),并测定处理组靶标菌朝菌株NQ8GⅡ4方向扩展的半径(Rp),计算抑菌率。
抑菌率=(Rc-Rp)/(Rc-3)×100%。
1.3 菌株NQ8GⅡ4对靶标菌拮抗作用的显微观察
采用盖玻片对峙培养法[10],在距PDA平板中心1.5 cm端分别接种直径6 mm的NQ8GⅡ4菌饼和靶标菌菌饼,2种菌饼间放置浸有PDA培养基的灭菌盖玻片,待菌株NQ8GⅡ4菌丝和靶标菌丝接触1~3 d后取出盖玻片,于光学显微镜(400倍)下观察并拍照。
1.4 菌株NQ8GⅡ4培养液的抑菌活性
1.4.1 菌株NQ8GⅡ4培养液的制备 在预先培养5 d的NQ8GⅡ4菌落上取6个直径6 mm的菌饼,放入装有150 mL灭菌PDB培养基的三角瓶中,25 ℃、175 r/min振荡培养7 d,将培养好的发酵液(2.3×107CFU/mL)用抽滤泵过滤菌丝和孢子,再经孔径0.22 μm微孔滤膜过滤除去菌丝,获得培养液,4 ℃保存备用。
1.4.2 培养液对病原真菌菌丝生长的抑制作用 采用菌丝生长速率法[11]测定菌株NQ8GⅡ4培养液的抑菌活性。将菌株NQ8GⅡ4培养液与冷却至50 ℃左右的灭菌PDA培养基混匀,分别制成培养液体积分数为10%,15%,20%,25%,30%和40%的PDA平板,凝固后,在平板中央分别放置1个直径6 mm的靶标菌菌饼,以PDA培养基为对照,每处理重复3次,置于25 ℃霉菌培养箱中培养,待对照组靶标菌菌丝长满培养皿后,测量各处理靶标菌的半径,计算菌丝抑制率。
1.4.3 培养液对病原真菌孢子萌发的抑制作用 (1)靶标菌孢子悬浮液的制备:将交链格孢和灰葡萄孢接种至PDA培养基上,25 ℃黑暗培养5 d后,加入5 mL无菌水冲洗PDA培养平板,收集菌丝和孢子混合液,用双层无菌纱布过滤除去菌丝,得到靶标菌孢子悬浮液,用血球板计数法将靶标菌孢子悬浮液稀释为孢子含量为1×105CFU/mL的菌液,备用。
(2)培养液对靶标菌孢子萌发抑制率测定:配制菌株NQ8GⅡ4培养液含量分别为体积分数20%,40%,60%,80%和100%的培养液,将其与靶标菌孢子悬浮液按体积比1∶1混合(菌株NQ8GⅡ4培养液的最终体积分数分别为10%,20%,30%,40%和50%),设无菌水与靶标菌孢子悬浮液体积比1∶1混合处理为对照,25 ℃黑暗培养8 h,每处理重复3次。在光学显微镜(400倍)下每重复随机观察5个视野,每个视野随机观察20个孢子,统计萌发孢子数,计算孢子萌发抑制率。
孢子萌发率=萌发的孢子数/(20×5)×100%;
孢子萌发抑制率=(对照孢子萌发率-处理孢子萌发率)/对照孢子萌发率×100%。
1.5 菌株NQ8GⅡ4挥发物质对靶标菌菌丝生长的抑制作用
采用平板对扣法[12]测定菌株NQ8GⅡ4挥发物质对交链格孢和灰葡萄孢菌丝生长的抑制作用。在培养5 d的NQ8GⅡ4菌落上取1个直径6 mm的菌饼,接种在PDA培养基上,25 ℃黑暗培养。分别在培养0,2,4,6,8和10 d后,与刚接种6 mm靶标菌菌饼的PDA平板对扣密封,对扣时接种菌株NQ8GⅡ4的培养皿在下,接种靶标菌的培养皿在上,以接种琼脂块代替NQ8GⅡ4菌饼的处理为对照,每处理重复3次,25 ℃霉菌培养箱中黑暗培养,待对照组靶标菌长满培养皿后,计算菌丝抑制率。
1.6 菌株NQ8GⅡ4的广谱抑菌活性测定
分别以病原真菌米根霉、出芽短梗霉和球派伦霉为靶标菌,采用皿内对峙法测定菌株NQ8GⅡ4的抑菌谱。具体方法同1.2节。
1.7 菌株NQ8GⅡ4培养液对灵武长枣的保鲜作用
将挑选好的灵武长枣用无菌水轻微冲洗2次,沥水晾干,分别用无菌水、50%多菌灵500倍液(质量浓度为2 g/L)及NQ8GⅡ4培养液体积分数分别为10%,20%,30%,40%和50%的液体浸果1 min,自然晾干,装入20 μm厚的保鲜袋中,每袋12颗果,每处理重复4次,共计28袋,15 ℃冷藏柜中贮藏,每隔5 d观察腐烂情况并统计腐烂率。将果面出现直径大于0.3 cm病斑的果实视为烂果,此类果占统计果实的比例即为腐烂率,以20%腐烂率为临界点,判定灵武长枣是否失去商品价值[13]。
1.8 数据处理
采用Spass 19.0统计软件对抑制率、腐烂率进行差异显著性分析;利用OriginPro 8对孢子萌发率和萌发抑制率进行绘图。
2 结果与分析
2.1 菌株NQ8GⅡ4的抑菌活性测定
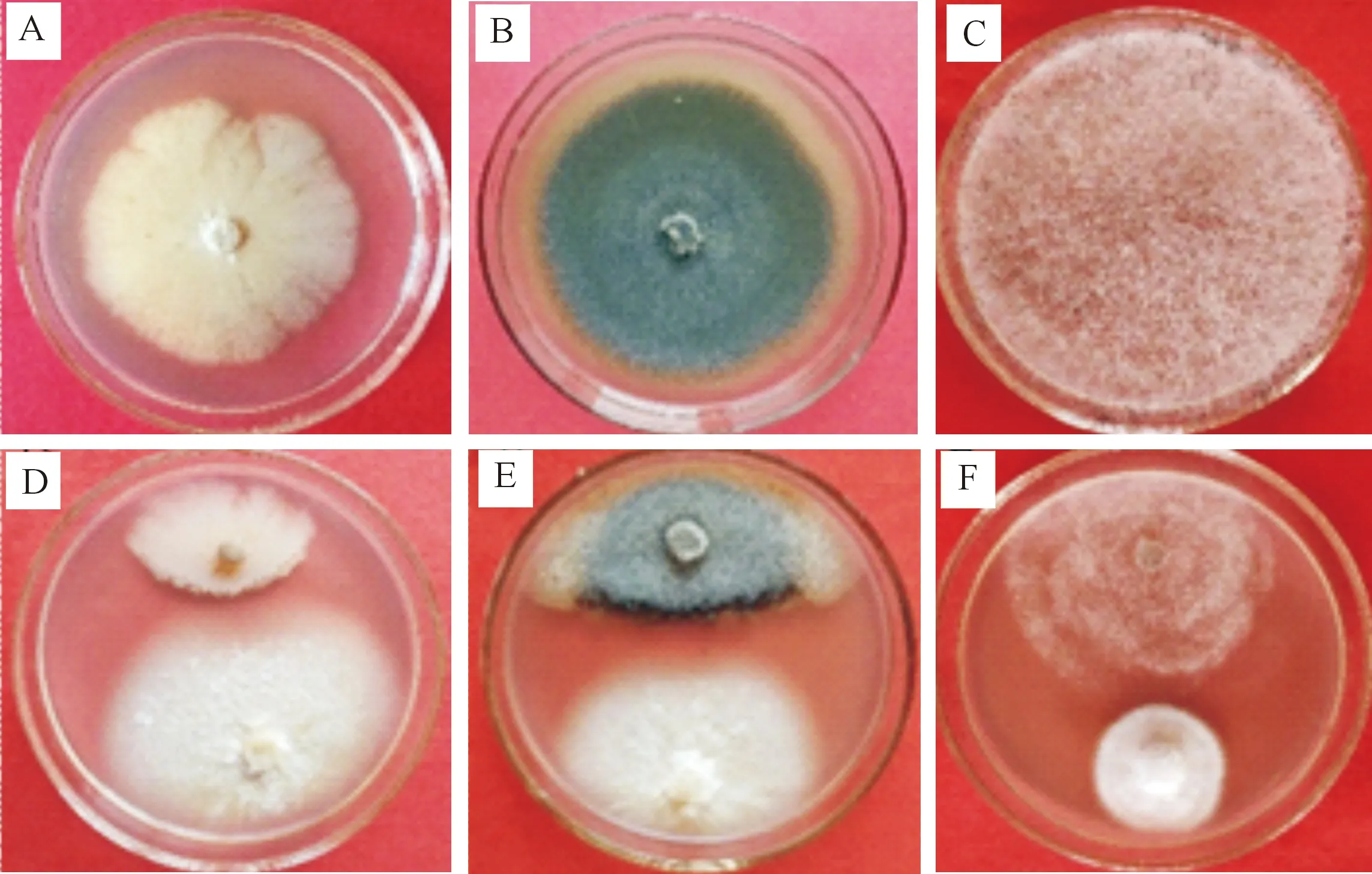
由图1可知,菌株NQ8GⅡ4对交链格孢和灰葡萄孢均有抑制作用,病原菌菌丝边缘变薄,生长受到抑制,不能向外正常扩展。

A.同时接种菌株NQ8GⅡ4和交链格孢;B.接种菌株NQ8GⅡ4 4 d后接种交链格孢;C.接种交链格孢4 d后接种菌株NQ8GⅡ4;D.仅接种交链格孢对照;E.同时接种菌株NQ8GⅡ4和灰葡萄孢;F.接种菌株NQ8GⅡ4 4 d后接种灰葡萄孢;G.接种灰葡萄孢4 d后接种菌株NQ8GⅡ4;.H仅接种灰葡萄孢对照
由表1可知,预先4 d接种菌株NQ8GⅡ4处理对交链格孢和灰葡萄孢的抑制率最高,分别为71.25%和68.75%;同时接种菌株NQ8GⅡ4和病原真菌处理对交链格孢和灰葡萄孢的抑菌效果次之,抑制率均在50.00%以上;接种病原真菌4 d后再接种菌株NQ8GⅡ4的抑菌效果较差,抑制率均在30.00%以下;3种接种方法对2种病原菌的抑制作用存在显著差异(P<0.05)。

表1 枸杞内生嗜线虫镰刀菌NQ8GⅡ4对靶标病原真菌菌丝生长的抑制作用
2.2 菌株NQ8GⅡ4对病原真菌的拮抗作用
菌株NQ8GⅡ4菌丝与病原真菌交链格孢和灰葡萄孢菌丝相互作用的显微观察结果如图2所示。由图2可知,正常生长在PDA培养基上的交链格孢和灰葡萄孢菌丝粗细均匀,长势旺盛,产孢量较多,孢子大小均匀(图2-A,E)。在对峙试验中,菌株NQ8GⅡ4对病原真菌产生了明显的拮抗作用。主要表现为NQ8GⅡ4的菌丝体与病原真菌菌丝相互缠绕(图2-F),产生分支吸附、侵入和穿插在病原真菌菌丝体上(图2-C,G),造成病原真菌菌丝体出现膨大肿胀、畸形、崩解和干瘪(图2- B,H,D)等现象。

A.交链格孢;B-D.菌株NQ8GⅡ4与交链格孢互作;E.灰葡萄孢;F-H.菌株NQ8GⅡ4与灰葡萄孢互作
2.3 菌株NQ8GⅡ4培养液对病原真菌的抑制作用
2.3.1 对菌丝生长的抑制作用 观察发现,随着菌株NQ8GⅡ4培养液含量的增加,靶标菌的菌丝体生长势变缓,菌丝呈溶解状,稀疏变薄。由表2可知,菌株NQ8GⅡ4培养液对病原真菌菌丝生长具有明显的抑制作用,不同含量的NQ8GⅡ4培养液对靶标菌的抑制率差异显著(P<0.05),随着NQ8GⅡ4培养液含量的增加,其对病原真菌的抑制率呈上升趋势,在NQ8GⅡ4培养液体积分数为40%时,其对交链格孢和灰葡萄孢的抑制率分别为71.25%和62.00%。

表2 枸杞内生嗜线虫镰刀菌NQ8GⅡ4培养液对靶标病原真菌菌丝生长的抑制作用
2.3.2 对病原真菌孢子萌发的抑制作用 由图3可知,菌株NQ8GⅡ4培养液对交链格孢和灰葡萄孢分生孢子萌发均有抑制作用,且不同含量NQ8GⅡ4培养液对病原菌分生孢子萌发的抑制率差异显著(P<0.05),随着NQ8GⅡ4培养液含量的增加,其对病原真菌分生孢子萌发的抑制率呈上升趋势。当菌株NQ8GⅡ4培养液含量为50%时,其对交链格孢和灰葡萄孢的分生孢子萌发抑制率分别达92.81%和88.72%;当NQ8GⅡ4培养液含量为40%,其对交链格孢和灰葡萄孢的分生孢子萌发抑制率均在80.00%以上。结果表明,菌株NQ8GⅡ4培养液中含有某种抑菌活性物质,能显著抑制靶标菌的生长。
2.4 菌株NQ8GⅡ4挥发性物质对病原真菌菌丝生长的抑制作用
菌株NQ8GⅡ4挥发物质能抑制病原真菌菌丝的生长,与对照相比,接种NQ8GⅡ4菌饼处理病原真菌的菌丝生长势明显减弱,菌丝稀疏变薄,且随着接种NQ8GⅡ4菌饼后培养时间的延长,这种趋势更加明显。由表3可知,接种NQ8GⅡ4菌饼培养6 d的处理对交链格孢的抑菌效果最好,抑制率高达94.34%;接种NQ8GⅡ4菌饼培养10 d的处理对灰葡萄孢的抑菌效果最好,抑制率高达95.95%。
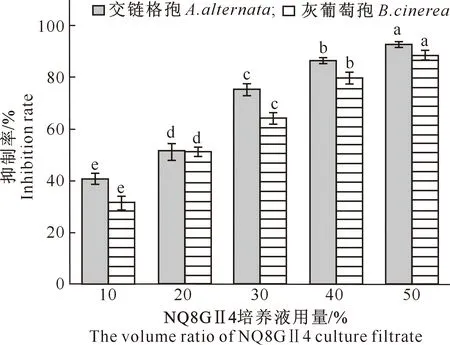
图柱上标不同小写字母表示同种病原菌不同处理间差异显著(P<0.05)

表3 枸杞内生嗜线虫镰刀菌NQ8GⅡ4挥发性物质对病原真菌的抑制作用
2.5 菌株NQ8GⅡ4抑菌谱测定
枸杞内生真菌菌株NQ8GⅡ4对出芽短梗霉、球派伦霉和半根霉等病原菌的抑制作用如图4所示。由图4可知,菌株NQ8GⅡ4对出芽短梗霉、球派伦霉和米根霉均具有抑制作用,其中对出芽短梗霉的抑菌效果最好,对球派伦霉的抑菌效果次之,对米根霉抑菌效果较差。菌株NQ8GⅡ4对芽短梗霉、球派伦霉和米根霉的抑制率分别达87.91%,75.42%和30.95%,结合2.1节可知,枸杞内生真菌NQ8GⅡ4的抑菌谱较广,对供试的5种病原真菌均有不程度的抑制作用。
A-C.依次为出芽短梗霉、球派伦霉和米根霉组的对照组;D-F.依次为菌株NQ8GⅡ4对出芽短梗霉、球派伦霉和米根霉的抑制作用组
2.6 菌株NQ8GⅡ4对灵武长枣的离体保鲜效果
参考文献[13]可知,腐烂率为20%时灵武长枣就失去商品价值。由表4可知,在15 ℃条件下贮藏5 d时,无菌水对照处理灵武长枣果面上出现病斑,腐烂率为6.25%,2 g/L多菌灵和体积分数10%,20%,30%的 NQ8GⅡ4培养液处理的腐烂率均为0。贮藏15 d时,无菌水对照处理灵武长枣的腐烂率为45.83%,失去商品价值;2 g/L多菌灵处理的灵武长枣果面上开始出现病斑,腐烂率为2.08%;体积分数为20%的NQ8GⅡ4培养液处理的灵武长枣腐烂率依然为0。贮藏30 d时,无菌水对照处理的灵武长枣腐烂率高达97.92%,腐烂现象非常严重;经20% NQ8GⅡ4培养液处理的腐烂率为20.83%,与无菌水对照相比腐烂率降低了77.09%,保鲜效果与2 g/L多菌灵相当。结果表明,在15 ℃贮藏条件下,体积分数20% NQ8GⅡ4培养液对灵武长枣具有显著的保鲜效果,可使货架期延长15~30 d,表明NQ8GⅡ4菌株具有一定的生防开发潜力。
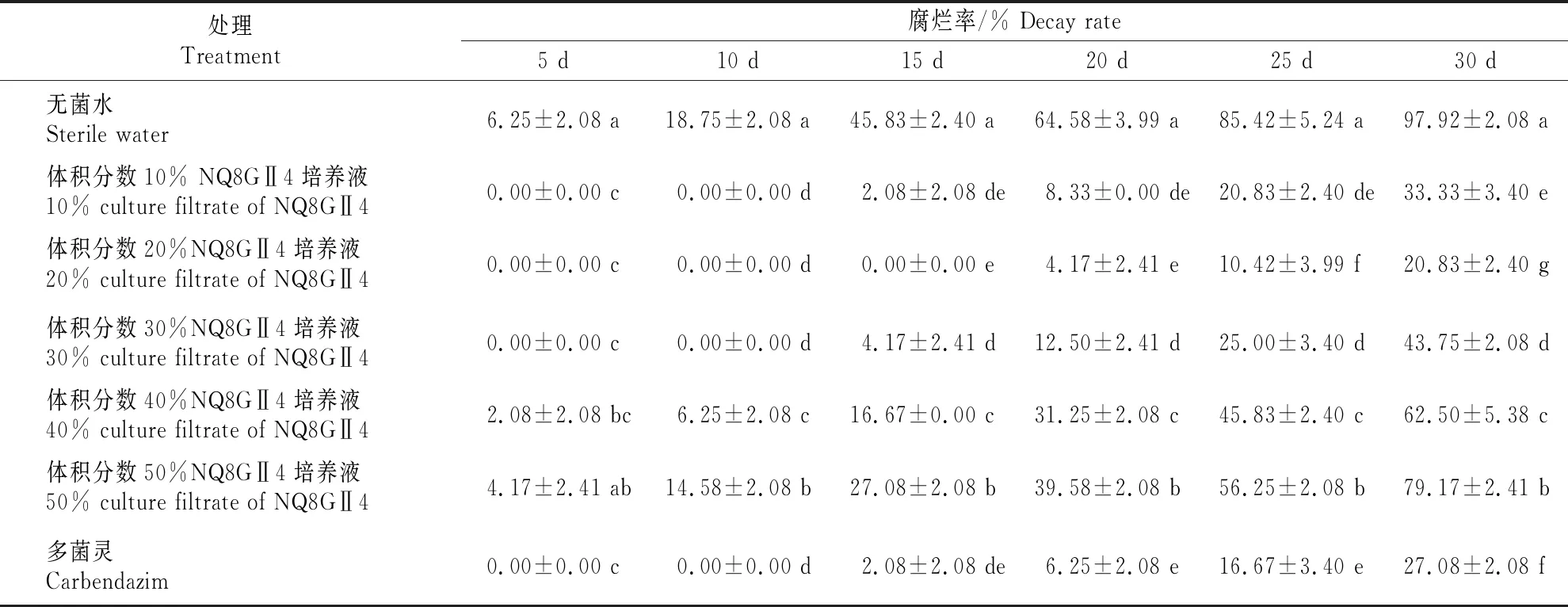
表4 枸杞内生嗜线虫镰刀菌NQ8GⅡ4培养液对灵武长枣的保鲜效果
3 讨 论
作为重要的生防微生物,内生真菌可以与病原菌竞争生态位或产生拮抗物质等发挥防病功效,提高植物抗病性,具有防治果蔬采后病害的作用[13]。孙文斌等[14]研究表明,嗜线虫镰刀菌对甘蓝黑斑病菌(Alternariaoleracea)、甘蔗凤梨病菌(Ceratocystisparadoxa)、贡柑链格孢菌(Alternariacitri)和辣椒炭疽病菌(Colletotrichumcapsici)等均有一定的抑制作用,抑菌谱广。本研究表明,菌株NQ8GⅡ4对灵武长枣采后致腐病原真菌具有较强的抑制作用,保鲜效果明显,说明NQ8GⅡ4是一株极具开发潜力的生防菌株,在果蔬采后保鲜方面具有广阔的应用前景。
拮抗作用的强弱与拮抗菌和病原菌的接种时间相关[15-16]。周可等[17]研究发现,接种解淀粉芽胞杆菌(Bacillusamyloliquefaciens) HN后再接种黄瓜灰霉病菌(B.cinerea)处理的抑菌效果比同时接种处理高26.00%。徐涛等[18]研究证实,接种内生链格孢(Alternariasp. )Al54菌株3 d后再接种苹果树腐烂病菌(Valsaceratosperma)处理的抑菌效果比同时接种处理好,抑菌率高达87.34%。本研究通过皿内对峙培养发现,预先接种NQ8GⅡ4菌株4 d后再接病原真菌的处理可明显抑制病原真菌的生长,这可能是菌株NQ8GⅡ4占据了有利的生态位,从而发挥了生防作用。显微观察发现,靠近菌株NQ8GⅡ4的病原真菌菌落边缘菌丝出现畸形、崩解和原生质外渗等现象,笔者推测可能是由于菌株NQ8GⅡ4产生了某种抑菌或溶菌物质所致[19]。此外,本研究还发现,菌株NQ8GⅡ4培养液可以有效抑制交链格孢和灰葡萄孢菌丝生长及分生孢子萌发。结果表明,菌株 NQ8GⅡ4培养液中含有某种抑菌活性物质,但是其具体成分尚不明确,还需进一步研究。
真菌挥发性物质不仅可以抑制果蔬病原真菌侵染,还可以诱导果蔬产生抗病性[20-21],在果蔬采收病害防治方面受到广大学者的关注。如产香真菌(Apiosporamontagnei)ZY-2产生的挥发物质苯乙醇能够有效抑制灰霉病菌(B.cinerea)引起的草莓腐烂[22];枯草芽胞杆菌(Bacillussubtilis)Y13发酵产生的挥发性物质对油茶炭疽病菌有较好的抑制作用[23]。本研究发现,菌株NQ8GⅡ4挥发物质对灵武长枣致腐病原真菌具有较好的抑制作用,致使病原菌生长势减弱,菌丝稀疏,但其挥发物质的成分还需通过气相色谱-质谱联用(GC-MS)方法分析确定。
保鲜剂的浓度与果蔬保鲜效果密切相关,选用合适的保鲜剂浓度能达到良好又经济的保鲜效果[24]。许原等[25]分别用质量浓度为5,10,15,20 g/L的壳聚糖对凤尾菇进行处理,发现15 g/L的壳聚糖的保鲜效果最好;胡丽杰等[10]研究发现,体积分数10%的 NQ8GⅡ4培养液对枸杞胶孢炭疽菌抑菌率最高,对枸杞果保鲜作用也最好。本研究发现,体积分数20%的 NQ8GⅡ4培养液对采后灵武长枣的保鲜效果最好,与化学药剂多菌灵相当。从本研究结果看,菌株NQ8GⅡ4培养液的用量并非越大越好,分析认为,用量过低,不能激发寄主的诱导抗性,抑菌效果差,起不到保鲜作用;用量过高会使拮抗菌与宿主植物处于敌对状态,导致果蔬上出现腐败斑点。
关于内生拮抗真菌对果蔬的保鲜效果研究目前尚处于初步阶段,商品化的保鲜剂在国内尚未见报道。枸杞内生嗜线虫镰刀菌NQ8GⅡ4作为极具前景的微生物源保鲜剂生产菌,还需对其抑菌机理、发酵条件和制剂工艺等进行深入研究,使其真正成为一种新型的果蔬保鲜剂应用于生产实际。
4 结 论
预先接种枸杞内生嗜线虫镰刀菌NQ8GⅡ4对灵武长枣采后致腐病原真菌有较好的拮抗作用,NQ8GⅡ4培养液和挥发性物质对灵武长枣采后优势致腐病原真菌交链格孢和灰葡萄孢菌丝生长和孢子萌发均有较强的抑制作用。在15 ℃贮藏条件下,用体积分数20%的 NQ8GⅡ4培养液处理的灵武长枣,在30 d后,与对照相比腐烂率下降了77.09%,货架期延长了15~30 d。

