绣球菌双向液体发酵条件优化及其菌丝体多糖抗氧化活性分析
任亚倩,庄孟颖,刘兴健,吴小平,张君丽,郑明锋,傅俊生
(1 福建农林大学 a 食品科学学院,b 生命科学学院,福建 福州 350002;2 西藏自治区农牧科学院 蔬菜研究所, 西藏 拉萨 850000)
绣球菌(Sparasiscrispa)隶属担子菌门、伞菌纲、多孔菌目、绣球菌科、绣球菌属[1],其子实体玲珑似花瓣,晶莹剔透,呈白色或奶黄色,是一种珍贵的食药用菌。多糖是绣球菌的主要活性成分之一,具有抗炎[2]、抗肿瘤[3]、调节免疫[4]等功能。由于绣球菌子实体野生资源有限,目前虽已实现人工栽培,但其栽培周期长、生产成本高,这在很大程度上限制了绣球菌相关产品的开发及应用[5]。然而,菌丝体具有生产周期短、提取加工方便等特点,被认为是一种潜在可替代子实体扩大食用菌开发利用的有效途径,因此如何促进绣球菌菌株快速生长,高效生产菌丝体就显得至关重要[6]。
双向发酵是一种通过添加药性基质促进目的菌株快速生长的方法,具有生产周期短、产量高、不受环境限制、成本低等优点,在真菌的发酵生产中应用广泛[7]。解文利等[8]探究了银杏叶对紫红曲霉双向发酵的影响,发现其可以促进紫红曲霉的生长。胡永乐等[9]研究了厚朴对蛹虫草双向液体发酵的影响,发现其能在短时间内有效地提高蛹虫草菌丝体生物量并释放各类代谢产物。
马尾松松针是松科植物马尾松(PinusmassonianaLamb)的叶[10],是一种重要的中药材,其主要活性成分为挥发油类、木脂素类、黄酮类等,具有祛风活血、明目安神等功效[11-12]。本课题前期研究发现,马尾松松针能够有效地促进绣球菌菌丝体的生长,但目前还未见关于马尾松松针-绣球菌双向液体发酵对菌丝体生产影响的研究。为进一步提高绣球菌菌丝体生物量,本研究采用单因素试验和正交试验对马尾松松针-绣球菌双向液体发酵的条件进行了优化,并对菌丝体多糖的抗氧化活性进行了分析,以期为绣球菌菌丝体的高效生产提供科学依据。
1 材料与方法
1.1 材 料
1.1.1 菌 种 绣球菌菌种,由福建农林大学生命科学学院田间1-11试验室保藏,菌株编号RY01。
1.1.2 试剂和仪器 葡萄糖、蛋白胨、琼脂等试剂,均为国产分析纯试剂;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),购于Sigma公司。主要仪器有电热鼓风干燥箱 (DHG-9070A,常州普天仪器制造有限公司)、高速万能粉碎机(GN20,杭州旭众机械设备有限公司)、恒温摇床 (KH-300,常州市凯航仪器有限公司)、电子天平(FA104,上海力辰仪器科技有限公司)、pH计(PHS-3C,上海仪天科学仪器有限公司)和红外光谱仪(德国Bruker有限公司)。
1.1.3 培养基 (1) 基础培养基的制备。将土豆200 g于1.2 L沸水煮沸30 min,用3层纱布过滤,收集土豆浸提液,依次加入葡萄糖20 g,蛋白胨5 g,琼脂2 g,搅拌溶解,加水定容至1 L,121 ℃高压灭菌30 min。
(2) 绣球菌液体菌种制备。将绣球菌菌株接种于装有100 mL基础培养基的锥形瓶中,于25 ℃、160 r/min条件下培养20 d,用无菌水稀释,调整菌液质量浓度为50 g/L,备用。
1.1.4 马尾松松针粉 马尾松松针采自福建农林大学中华名特优植物园。将采摘的马尾松松针于50 ℃烘干,粉碎后过孔径0.175 mm的标准筛,备用。
1.2 双向液体发酵单因素试验
采用单因素试验分别探究马尾松松针粉添加量、发酵时间、绣球菌接种量及发酵液pH对绣球菌菌丝体生物量的影响。
1.2.1 马尾松松针粉添加量 于90 mL基础培养基中分别加入50,75,100,125,150 mg马尾松松针粉,121 ℃灭菌30 min后,冷却至室温,然后每个摇瓶中接入10 mL质量浓度为50 g/L的绣球菌液体菌种(最终接种量为100 mL/L),最终培养基中马尾松松针粉添加量分别0.50,0.75,1.00,1.25,1.50 g/L,于25 ℃、160 r/min条件下培养16 d后,测定菌丝体生物量。每组试验重复3次,结果取平均值。菌丝体生物量的测定:对液体发酵产物于25 ℃条件下抽滤3 h,分离发酵液和菌丝体,用蒸馏水反复冲洗菌丝体至表面无马尾松松针粉末残留,用滤纸吸干表面残留水分,于50 ℃烘干后称质量。
1.2.2 发酵时间 于90 mL基础培养基中加入125 mg马尾松松针粉(最终添加量为1.25 g/L),121 ℃高压灭菌30 min后,冷却至室温,然后每个摇瓶接入10 mL质量浓度为50 g/L的绣球菌液体菌种(最终接种量为100 mL/L),于25 ℃、160 r/min条件下分别培养12,16,20,24,28,32 d,测定菌丝体生物量。每组试验重复3次,结果取平均值。
1.2.3 绣球菌接种量 于90 mL基础培养基中加入125 mg马尾松松针粉(最终添加量为1.25 g/L),121 ℃高压灭菌30 min,冷却至室温,分别接入不同体积50 g/L的绣球菌液体菌种,控制培养基总体积为100 mL,绣球菌的最终接种量分别为25,50,75,100,125,150 mL/L,于25 ℃、160 r/min条件下培养24 d,测定菌丝体生物量。每组试验重复3次,结果取平均值。
1.2.4 发酵液pH 于90 mL基础培养基中加入125 mg马尾松松针粉(最终添加量为1.25 g/L),用氢氧化钠和盐酸分别调节pH至4,5,6,7和8,121 ℃灭菌30 min,冷却至室温,然后每个摇瓶接入10 mL质量浓度为50 g/L的绣球菌液体菌种(最终接种量为100 mL/L),于25 ℃、160 r/min条件下培养24 d,测定菌丝体生物量。每组试验重复3次,结果取平均值。
1.3 双向液体发酵条件的优化
基于双向液体发酵单因素试验结果,以菌丝体生物量为考察指标,对马尾松松针粉添加量、发酵时间、接种量和发酵液pH进行4因素3水平的正交试验,筛选最佳发酵条件。试验设计见表1。

表1 绣球菌液态发酵条件正交试验因素及水平
在正交试验优化得到最佳条件的基础上,控制其他条件一致,试验设置了马尾松松针-绣球菌双向液体发酵组(以下简称双向发酵组)和未添加马尾松松针粉的对照组2个处理,每组3个重复,对最佳条件进行验证。
1.4 菌丝体多糖制备
以未添加马尾松松针粉的处理为对照组,参照李瑞雪等[13]的方法,将烘干后的对照组和双向发酵组绣球菌菌丝体粉碎,过孔径0.175 mm的标准筛,取一定量菌丝体粉末,按料液比1 (g)∶30 (mL)比例加入蒸馏水,90 ℃提取3 h,离心收集上清液后旋蒸浓缩,4 ℃醇沉过夜,收集沉淀,加水复溶后,采用Sevage法除去蛋白杂质,冷冻干燥得到绣球菌菌丝体多糖(Sparassiscrispapolysaccharides,SCP)。
1.5 菌丝体多糖的结构分析
参照李晋等[14]的方法,分别称取对照组和双向发酵组SCP粉末2 mg,加入200 mg烘干至恒质量的KBr粉末,混匀后充分研磨,利用压模机压成片后,采用红外光谱对其进行结构表征。
1.6 菌丝体多糖的抗氧化活性分析
1.6.1 对ABTS自由基清除率 参考雷燕妮等[15]的方法并略作调整进行试验。配置双向发酵组不同质量浓度(0.25,0.5,1,2,4 mg/mL)的SCP溶液,以相同质量浓度的维生素C为对照,测定SCP对ABTS自由基清除率。具体方法为:在试管中分别加入0.8 mL的ABTS工作液和0.2 mL不同质量浓度的样品溶液,振荡混匀10 s,于25 ℃条件下避光反应6 min,在波长734 nm处测定吸光值(Ai),以蒸馏水分别替代样品溶液和ABTS工作液,在波长734 nm处测定吸光值(分别记为Aj和Aij)。每组试验重复3次,结果取平均值。计算ABTS自由基的清除率:
ABTS自由基清除率=[1-(Ai-Aij)/Aj]×100%。
1.6.2 对羟基自由基的清除率 参考Lai等[16]的方法并略作调整进行试验。以相同质量浓度的维生素C为对照,采用水杨酸-硫酸亚铁法测定SCP对羟基自由基的清除率。具体方法为:在试管中依次加入9 mmol/L的水杨酸-乙醇溶液、9 mmol/L的FeSO4溶液、不同质量浓度的样品溶液和8.8 mmol/L的H2O2溶液各0.1 mL,加蒸馏水补足至1 mL,涡旋混匀5 s,于37 ℃条件下反应30 min,在波长510 nm处测定吸光度(Aa),以0.1 mL蒸馏水分别替代样品溶液和H2O2溶液,于波长510 nm处测定吸光度(分别记为Ab和Aab)。每组试验重复3次,结果取平均值。计算SCP对羟基自由基的清除率:
羟基自由基清除率=[1-(Aa-Aab)/Ab]×100%。
1.7 数据统计与分析
试验数据用“平均值±标准差”表示。采用SPSS 24.0软件分析处理,组间比较采用Duncan’s检验。
2 结果与分析
2.1 不同单因素对绣球菌液体发酵的影响
2.1.1 马尾松松针粉添加量 图1显示,当马尾松松针粉添加量为0.50~1.25 g/L时,绣球菌菌丝体的生物量随着松针粉添加量的增加而显著提高;当松针粉添加量大于1.25 g/L时,绣球菌菌丝体生物量趋于稳定,从节约资源的角度考虑,马尾松松针粉添加量选取1.25 g/L较为合适。
2.1.2 发酵时间 图2显示,当发酵时间为12~24 d时,绣球菌菌丝体生物量随着发酵时间的延长而不断增加;当发酵时间超过24 d,随着发酵时间的延长菌丝体生物量不再发生显著变化。从缩短发酵周期的角度考虑,发酵时间选取24 d较为合适。
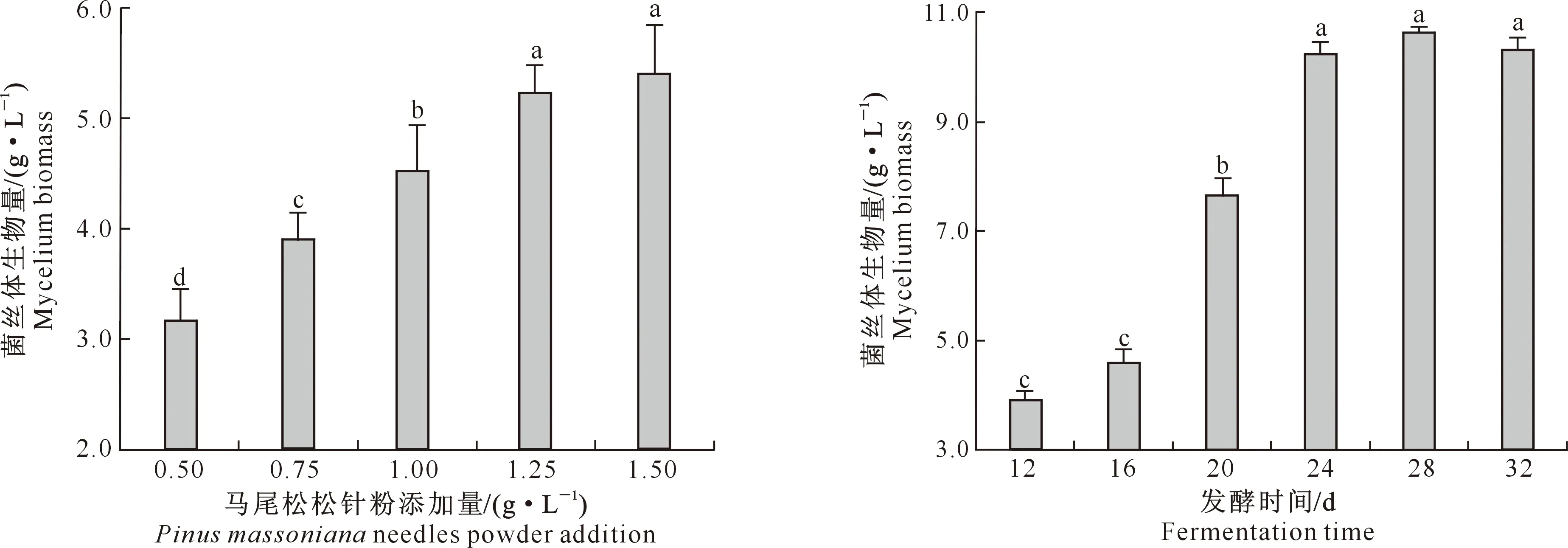
图柱上标不同小写字母表示不同处理间差异显著(P<0.05)。下图同
2.1.3 绣球菌接种量 图3显示,当绣球菌接种量为25~100 mL/L时,绣球菌菌丝体生物量随着接种量的增大而显著增加;接种量大于100 mL/L时,菌丝体生物量呈下降趋势,这可能与菌株在单位体积内对营养成分的过度竞争致使培养基中溶氧不足,菌丝体的生长受到抑制有关。因此,选取100 mL/L为绣球菌适宜接种量。
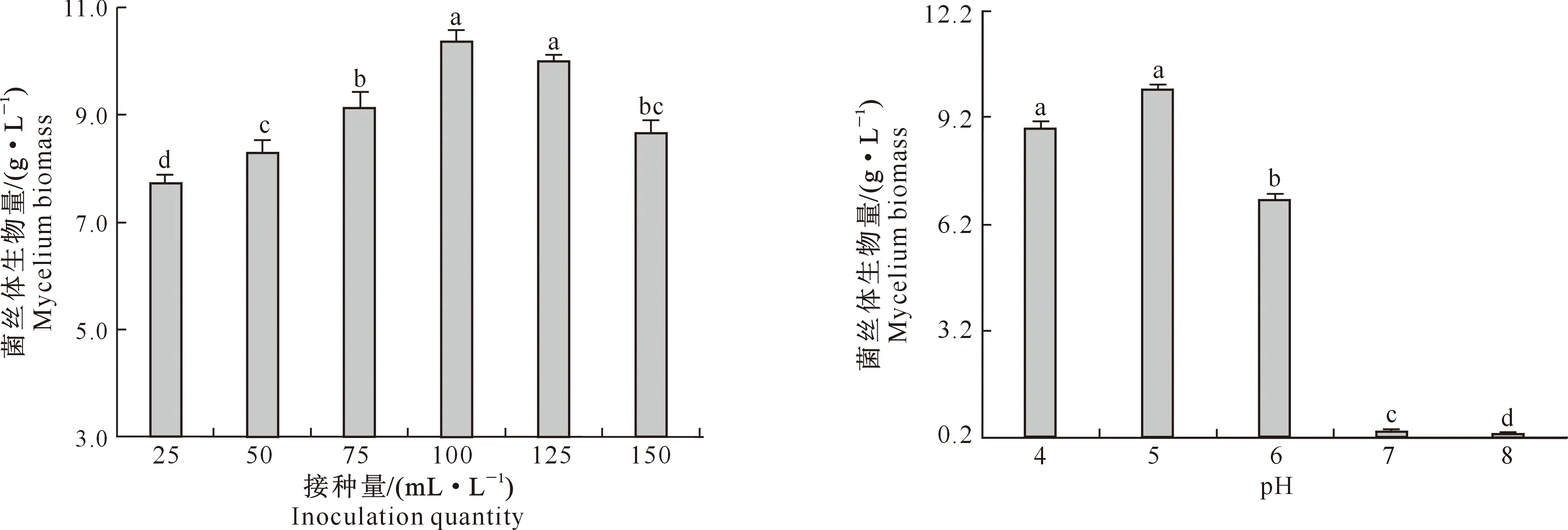
图3 绣球菌接种量对菌丝体生物量的影响
2.1.4 发酵液pH 图4显示,在供试pH范围内,绣球菌菌丝体生物量随着pH的提高呈现先增加后降低的趋势,在pH为5时,菌丝体生物量达到最高。因此,发酵液pH设定为5较为合适。
2.2 绣球菌双向液体发酵条件的正交优化
表2显示,马尾松松针粉添加量中k3最大,发酵时间中k2最大,pH中k1最大,接种量中k3最大,此条件(第8试验组)下菌丝体生物量最高。试验过程中观察菌丝颜色及大小情况发现,第3试验组和第7试验组菌丝体颜色偏黄,且菌球颗粒大小不一;第8试验组菌丝体颜色偏白,且颗粒均匀。综上可以得出,绣球菌双向液体发酵的最佳条件为:马尾松松针粉添加量1.25 g/L、发酵时间24 d、pH 4、接种量125 mL/L,在此条件下绣球菌菌丝体生物量可达到(11.25±0.18) g/L。

表2 绣球菌双向液体发酵正交试验结果
表2显示,4个单因素中,pH的极差(R)最大,马尾松松针粉添加量次之,接种量和发酵时间均较小,表明影响双向液体发酵产绣球菌菌丝体的主要因素是pH和马尾松松针粉添加量。结合方差分析结果(表3)可知,pH的F值最大,为404.209;马尾松松针粉添加量的F值次之,为15.589;接种量和发酵时间的F值均较小,分别为8.051和0.401。由R值和F值可知,4个因素对锈球菌菌丝体生物量影响大小的顺序为:发酵液pH>马尾松松针粉添加量>绣球菌接种量>发酵时间。
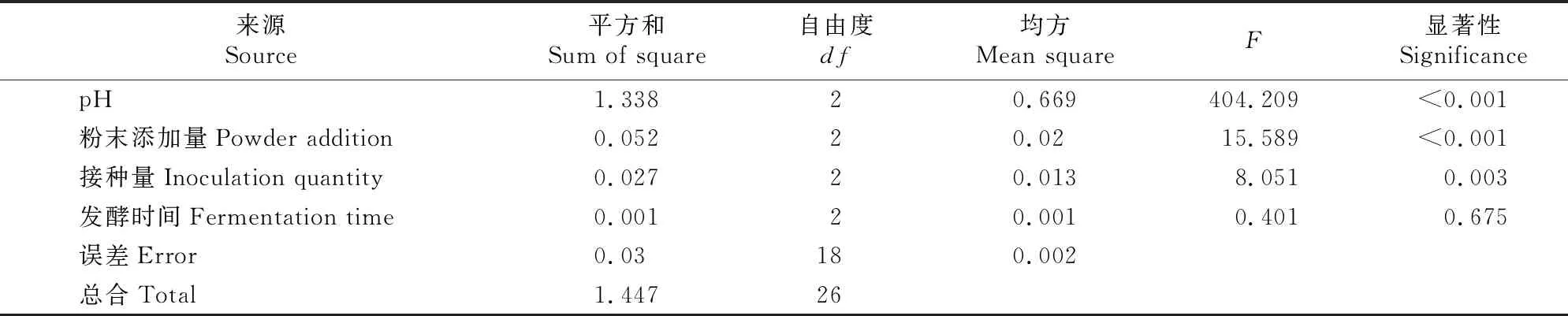
表3 绣球菌双向液体发酵正交试验结果的方差分析
2.3 绣球菌双向液体发酵最佳条件的验证
在2.2节正交试验得到的最佳条件下,马尾松松针-绣球菌双向液体发酵组菌丝体生物量可达(11.16±0.22) g/L,与未添加马尾松松针粉的对照组((4.26±0.19) g/L)相比,菌丝体生物量显著提高了约162.10%,可知马尾松松针能够显著地提高绣球菌菌丝体的生物量。
2.4 绣球菌菌丝体多糖的结构分析
图5结果显示,双向液体发酵获得的绣球菌菌丝体多糖红外光谱主要特征吸收峰与对照组一致,说明马尾松松针-绣球菌双向液体发酵对菌丝体多糖的结构影响较小。

图5 双向液体发酵绣球菌菌丝体多糖的红外光谱分析
2.5 绣球菌菌丝体多糖的抗氧化活性分析
图6-A结果显示,在设定质量浓度范围内,SCP对ABTS自由基的清除能力随其质量浓度的增大而不断增强,当SCP质量浓度为4 mg/mL时,其对ABTS自由基清除率可达到99.72%。由图6-B可知,在设定质量浓度范围内,SCP对羟基自由基的清除率随其质量随浓度的增大而不断提高,当SCP质量浓度为4 mg/mL时,其对羟基自由基的清除率可达到68.22%。

图柱上标不同小写字母表示同一种物质不同质量浓度间差异显著(P<0.05)
3 讨论与结论
液体发酵技术是菌株扩繁的重要方法,但传统液体发酵手段难以实现菌株的高效快速生长,双向液体发酵是利用中药材所富含的活性成分刺激菌丝体的生长,可在短时间内实现菌株的快速繁殖[17]。基于双向发酵的原理,本试验尝试通过马尾松松针-绣球菌双向液体发酵来提高菌丝体的生物量。单因素试验发现,当马尾松松针粉添加量大于1.25 g/L,菌丝生物量不再明显提高,这可能是由于马尾松松针中的活性成分在达到一定量后对绣球菌菌丝体生长的促进作用达到了平台期。当发酵时间超过24 d后,绣球菌菌丝体生物量随着发酵时间的延长而下降,这可能是由于发酵后期培养基中溶氧量降低从而引起菌丝体老化自溶所致。当接种量为125~150 mL/L时菌丝体生物量明显下降,这可能是由于接种量过大,菌株对物质能量的消耗过快,导致单位体积培养体系内营养成分和溶氧不足,使得菌丝体的生长受到抑制[18]。当pH≥6时,绣球菌菌丝体生物量显著下降,可知偏中性或碱性环境对其生长产生了不同程度的抑制作用,且发酵中后期菌球颜色逐渐加深,呈现不同程度的灰色,菌丝几乎无法生长,这可能是由于pH的升高抑制了与菌株生长相关的酶的活性[19],此时马尾松松针粉不能发挥对绣球菌菌丝生长的促进作用。
采用正交试验进一步优化马尾松松针-绣球菌双向液体发酵条件,得到最佳发酵条件为:马尾松松针粉添加量1.25 g/L、发酵时间24 d、接种量125 mL/L、pH为4,在此条件下绣球菌菌丝体生物量可达11.16 g/L。已有关于绣球菌液体培养的研究多集中于发酵条件的优化,2006年Kurosumi等[20]研究得出绣球菌的液体培养条件为:葡萄糖添加量为30 g/L、pH值为5,该条件下菌丝体的产量可达7.95 g/L。胡爽[21]对绣球菌突变菌株液体培养基配方进行优化,使菌丝体的生物量较优化前提高了约60%。本研究利用双向发酵原理探究马尾松松针对绣球菌菌丝体生长的影响,试验结果表明,马尾松松针可以显著促进绣球菌菌丝体的生长,与对照组相比,双向发酵组菌丝体生物量提高了约162.10%。
为探究马尾松松针是否会对绣球菌菌丝体多糖的结构产生影响,本试验进一步对添加马尾松松针与未添加马尾松松针发酵的绣球菌菌丝体多糖的结构进行了红外光谱分析。结果表明,两组菌丝体多糖的红外光谱主要吸收峰一致,表明马尾松松针-绣球菌双向液体发酵对绣球菌菌丝体多糖的结构影响较小。多糖作为绣球菌的重要活性成分,一直是科研工作者探究的热点之一。于韦韦[22]研究发现,绣球菌多糖可通过诱导乳腺癌细胞凋亡抑制肿瘤生长;高渊等[23]研究发现,绣球菌多糖可能通过调控机体氨基酸代谢和脂质代谢缓解高脂血症大鼠的血脂异常。在绣球菌多糖的活性功能探究中,关于菌丝体多糖抗氧化活性的研究相对较少,因此本试验对其抗氧化活性进行了研究,结果显示,绣球菌菌丝体多糖对ABTS自由基、羟基自由基的清除能力呈现剂量依赖性,具有较好的抗氧化能力。机体氧化代谢过程中产生的活性氧自由基过量时会诱发脂质过氧化,导致细胞膜和核酸的氧化损伤,进而造成免疫力下降,引发多种疾病[24-25]。目前越来越多的研究表明,多糖具有良好的自由基清除能力和抑制脂质过氧化作用,初步认为多糖的抗氧化能力与其结构、官能团、分子量、单糖组成等有关[26],本试验对绣球菌多糖的结构及单糖组分未进行深入研究,后续试验可通过多糖分离纯化、结构解析结合细胞试验进一步探究其抗氧化机理。
综上,马尾松松针-绣球菌双向液体发酵可有效提高绣球菌菌丝体生物量,在最适条件下其菌丝体生物量可达11.16 g/L,而且所得菌丝体多糖具有良好的抗氧化活性。马尾松松针-绣球菌双向液体发酵方法为绣球菌菌丝体的高效生产提供技术支持。

