不同频率心房电刺激对犬急性房颤模型的心房电重构影响及安全性分析
麦麦提阿卜杜拉·麦麦提敏,张 玲,曹桂秋,杨 徐,孙华鑫,汤宝鹏
(新疆医科大学1第一附属医院心脏起搏电生理科,2第五附属医院心血管内科,3第一附属医院临床医学研究院科研基地科,心电生理与心脏重塑重点实验室,乌鲁木齐 830054)
心房颤动(Atrial fibrillation,AF)是临床工作中最为常见的心律失常之一[1-2]。房颤的基本特征是规律的有效的心房电活动消失,随之被快速无序的AF波所替代。不规律的心脏收缩会导致心房血液停滞,心耳不规则的空间结构进一步促使血栓的形成,以及后续栓子脱落进入循环系统,导致AF患者出现脑中风及外周脉管系统出现血栓栓塞的风险明显增加[3-5]。更为严重的是,长期快速、无规则的心房电活动,促使心房发生结构重构,呈现出心房扩大、纤维化增加,进而导致心房收缩功能和舒张功能出现障碍,最终加快患者心力衰竭的发生[6-8]。因此,房颤不仅会引起患者心悸等不适症状,更可使充血性心力衰竭和脑卒中的发生风险分别提高3倍和5倍,有很高的致残和致死率[9-10]。
根据近年来诸多研究报道制作心房颤动的动物模型的方法学,造模方式为400~1 200次/分快速起搏动物心房,起搏时间从4周到12周不等[11-13]。不同频率起搏的安全性及对房颤电重构的影响有何区别,并未引起太多关注。本研究拟通过高频刺激犬右心房,观察不同频率刺激制造房颤急性模型的安全性及对心房电重构的影响,为房颤犬模型制作和房颤的机制研究提供理论基础。
1 材料与方法
1.1实验动物18只健康比格犬,雄性,由新疆医科大学动物实验中心提供。所有比格犬体重为(13±2)千克,年龄1~2岁。所有比格犬造模前均进行健康体检,进行精神状况、躯体健康状况评估。课题实验设计、实验方案及具体实施步骤已经新疆医科大学第一附属医院动物伦理委员会批准、审核,审批号(K202111-07)。实验实施推进过程严格按照美国国立研究机构设立的实验动物使用和护理指南进行。根据刺激频率的不同将实验动物进一步随机分为A组(n=6):右心房高频刺激,400 次/分;B组(n=6):右心房高频刺激,600次/分;C组(n=6):右心房高频刺激,1 000次/分。
1.2实验仪器Lead-7 000 多导电生理记录仪(四川锦江电子科技有限公司,中国),BeneviewT5多功能心电监护仪(深圳迈瑞医疗电子股份有限公司,中国),除颤仪(Metronic,美国),Aaeon7 200A 麻醉呼吸机(北京谊安医疗股份有限公司,中国),大动物手术台(深圳迈瑞医疗电子股份有限公司,中国),电生理10级电极。
1.3建立模型(1)动物准备及麻醉:实验犬分别记录其年龄、体重及机体特征。术前12 h禁食水,麻醉前观察动物状态、称重。手术当日肌注舒泰+速眠新注射液(0.05 mL/kg,1∶1)混合物进行基础麻醉,通过观察睫毛反射消失和舌头牵拉阻力消失来评估麻醉是否生效。麻醉成功后,操作区域剃毛。选择前肢头静脉植入静脉留置针开通静脉通道,然后以3%戊巴比妥钠溶液(20 mg/kg)静脉维持麻醉,间断输入0.9%氯化钠注射液、5%葡萄糖注射液补液、补充能量,根据犬的睫毛反射动态追加3%戊巴比妥那注射液(10 mg/kg)维持麻醉。使犬仰卧位于大动物手术台上,将电热毯通电,使整个实验过程中,犬体温稳定在37.5~38℃之间,进行气管插管,将指夹式血氧探头夹在犬舌头上用于监测血氧饱和度,根据脉氧饱和度必要时呼吸机辅助呼吸。将股动脉和股静脉进行穿刺并留置股动静脉鞘。在整个实验过程中,使用电生理仪Lead 7 000(锦江公司,中国成都)连续监测心电图标准肢体导联,腔内心电图和动脉血压(BP)。留置导尿管,连接尿袋,检测尿量。(2)房颤模型的确立:经股静脉途径将10级电极送至右心房,尾端连接于Lead-7 000多导电生理仪,当腔内电生理图呈现出大A小V波形,表示电极置入右心房成功, 随后需进行电极位置测试,当给予心房电极以1~2 V电压进行起搏时,均可见信号下传,表示放置电极位置良好。使用Lead-7 000多导电生理仪进行S1S1程序刺激右心房(HRA),刺激电压2 V,刺激脉宽设置为0.5 ms,A组S1S1 150 ms (400 次/分)刺激,B组S1S1 100 ms( 600 次/分)刺激,C组S1S1 60 ms( 1 000 次/分)刺激。
1.4腔内电生理检测停止刺激后心电记录中出现心房波无序活动的“f”波,而且“f”波可持续5 s 以上,则认为房颤诱发成功。如AF自行出现提示自发房颤,则记录AF持续时间,如果AF发作后持续出现,不能自行终止,持续时间超过5 min,则按照5 min进行计算,待其自行恢复窦性心律后再进行下一次的刺激诱发。如无自发性房颤,用Burst刺激进行诱发:给予60 ms 的S1S1 程序刺激,设定刺激电压为8 V,连续刺激10 s。分别在基线状态和持续刺激后6、12、18、24、30、36、42、48 h动态测心房有效不应期(ERP)、AF诱发率、AF持续时间和AF易损窗(WOV)。
1.5血压检测在整个实验过程中,使用电生理仪Lead 7 000(锦江公司,中国成都)连续监测动脉血压(BP)。分别在基线状态和持续刺激后6、12、18、24、30、36、42、48 h进行记录及分析。
1.6NTpro-BNP和降钙素原测定分别在基线状态和持续刺激后6、12、18、24、30、36、42、48 h从股静脉抽取血样本,用ELISA 法检测脑钠肽(NTpro-BNP)和降钙素原。NTproBNP<400 ng/L,考虑没有心衰,因此检测值小于400 ng/L的统一取400 ng/L。降钙素原<0.05 ng/mL,考虑没有感染,因此检测值小于0.05 ng/mL的统一取0.05 ng/mL。实验方案流程图见图1。
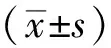
2 结果
在本实验的18只犬中,C组2只分别在快速起搏37 h和40 h出现室颤,抢救无效死亡;另外16只完成整个实验。3组均能诱发房颤(图1)。
2.1血压变化快速起搏心房18 h后,C组收缩压和舒张压均进行性下降,24 h后下降更明显,30 h、36 h、42 h、48 h时C组收缩压和舒张压与A、B组比较差异均有统计学意义(P<0.05),42 h后C组中2只出现休克血压。整个实验过程中A组与B组之间差异无统计学意义(P>0.05),均无出现休克血压,见表1、2。
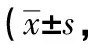
表1 3组犬收缩压的变化情况单位:mmHg)
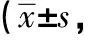
表2 3组犬舒张压的变化情况单位:mmHg)
2.2降钙素原的变化快速起搏心房后,整个实验过程中,A、B、C3组均无明显的感染,体温正常,3组降钙素原水平差异无统计学意义(P>0.05),见表3。
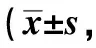
表3 3组犬降钙素原的变化情况单位:ng/mL)
2.3NTpro-BNP的变化快速起搏心房18 h后,C组NTpro-BNP进行性升高,30 h后NTpro-BNP明显高于正常值,其中3只提示有心力衰竭,与A、B组比较差异均有统计学意义(P<0.05),A、B组之间NTpro-BNP水平差异无统计学意义(P>0.05),见表4。

表4 3组犬NTpro-BNP的变化情况[M(P25,P75),ng/L]
2.4心房有效不应期的变化快速起搏心房24 h之内,3组ERP进行性下降,18 h内下降趋势更明显,但3组差异无统计学意义(P>0.05),24 h后ERP趋于相对平稳,无进行性下降趋势,见表5。
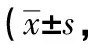
表5 3组犬心房有效不应期的变化情况单位:ms)
2.5房颤易损窗(WOV)的变化快速起搏心房后3组WOV均出现增加趋势,12 h后C组WOV增加趋势更加明显,C组与A、B组比较差异有统计学意义(P<0.05),而A组与B组之间差异无统计学意义(P>0.05),见表6。
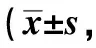
表6 3组犬房颤易损窗(WOV)的变化情况单位:ms)
2.6房颤诱发率的变化快速起搏心房后3组房颤诱发率均出现增加趋势,6 h后C组房颤诱发率增加趋势更加明显,C组与A、B组比较差异有统计学意义(P<0.05),A组与B组之间差异无统计学意义(P>0.05),36 h、42 h、48 h时A、B、C 3组房颤诱发率都很高,差异无统计学意义(P>0.05),见表7。

表7 3组犬房颤诱发率的变化情况
2.7房颤持续时间的变化快速起搏心房6 h后3组房颤持续时间均出现增加趋势,12 h后C组房颤诱发率持续时间趋势更加明显,C组与A、B组比较差异有统计学意义(P<0.05)。18 h时3组之间相互均有差异(P<0.05),24 h时A组与B、C组比较差异有统计学意义(P<0.05),B组与C组之间无差异(P>0.05)。30 h、36 h、42 h、48 h时A、B、C 3组房颤诱发持续时间都很长,差异无统计学意义(P>0.05),见表8。

表8 3组房颤持续时间的变化情况
2.83组模型生存情况分析实验过程中,A组、B组均未出现心衰、感染、休克、死亡,C组中2只犬分别在快速起搏37 h和40 h出现室颤,抢救无效死亡。C组4只犬完成实验,其中3只在30 h后NTpro-BNP明显高于正常,这3只犬NTproBNP最高时分别为2 300 ng/L、3 000 ng/L、3 100 ng/L,考虑有心衰,其中2只犬在42 h后出现休克血压,这两只犬血压最低时分别为80/40 mmHg、75/50 mmHg,整个实验中补液合理、体温正常、无感染,考虑心律失常导致的心衰合并心源性休克。C组犬的生存率低于A、B组,差异有统计学意义(P<0.05),A组与B组犬生存率差异无统计学意义(P>0.05),见图2。
3 讨论
心房重构对房颤至关重要,包括心房电重构、结构重构和神经重构,既往研究证实心房重构可能是导致房颤发生、复发和维持的重要机制。早期的心房重构主要为心房电重构,是指电生理及离子通道为特征发生的变化,晚期主要为心房的结构重构,是指组织结构的淀粉沉积、细胞凋亡、纤维化等改变。依据观察目的不同,建立不同类型的动物模型,有助于进一步探讨房颤发生、发展及其内在机制。由于犬的神经、血液循环系统发达,其病理基础与人类有极大的相似性,故可作为心房颤动的动物模型[14]。各种模型都是由临床观察而设计的模型方案,具有一定的应用范围但也存在自身的局限性。
本实验中根据刺激频率的不同设计A、B、C三个组,评估频率对心房电重构的影响及安全性。结果提示,三组降钙素原无统计学差异,在整个实验过程中无感染。心衰相关性指标NTpro-BNp在C组中随着刺激时间的延长出现升高趋势,3只30 h时明显高于正常值,提示有心力衰竭,但无明显心衰症状,双肺无明显湿性啰音,刺激频率为400 次/分和600 次/分的A组和B组,无心衰出现,因此考虑刺激频率越高,越容易引起心衰,若再持续给予刺激可能导致猝死等风险。快速心房起搏后A组和B组收缩压和舒张压相对稳定,无明显变化,而C组快速起搏心房18 h后收缩压和舒张压均进行性下降,24 h后下降更明显,42 h后2只出现休克血压,与A、B组比较血压变化有统计学差异(P<0.05),整个实验过程中补液合理,降钙素原未见明显升高,不考虑感染性休克和容量不足引起的休克,此2只犬NTpro-BNP高,考虑房颤导致心衰合并心源性休克所致,考虑刺激频率越高,越容易引起休克,若再持续给予刺激可能导致猝死等风险。既往研究报道,在急性AF模型中,ERP显著降低而WOV升高,AF诱发率和AF持续时间明显增加[15-16]。本研究中,400 次/分、600 次/分、1 000 次/分不同的频率均可诱发房颤,快速起搏心房24 h之内,三组ERP进行下降,18 h内下降趋势更明显,24 h后ERP趋于相对平稳,无进行下降趋势,WOV均出现增加趋势,三组房颤诱发率均出现增加趋势,房颤持续时间均出现增加趋势,但是ERP、WOV、房颤诱发率及房颤持续时间的改变时间段并不完全一致,提示房颤进展过程可能还存在其他因素起重要的作用,与Marios等[17]的研究结果一致。
快速起搏导致的心房电重塑包括心房的离子流和离子流通道的基因表达及通道特性的改变,钙超载是重要的始动因素。高频起搏致快速心房率,快速心房率容易引起细胞频繁去极化,可致细胞内钙超载,细胞内钙离子增加,最终使动作电位第三期平台相消失,缩短动作电位时程,从而使房颤易于触发和维持[18]。但是过快的心房起搏频率,可能会增加心衰、休克及猝死的风险,三组比较,C组造模时间较短,但是休克、心衰、死亡等风险高于A、B组,在急性模型中,400 次/分和600 次/分可能更适合选择。急性模型中,犬是全麻状态。而慢性模型中,犬是清醒的,有跑、跳等活动,有电极脱落等风险,而且实验周期较长,不可控制的因素较多。因此慢性模型中选择400 次/分刺激,保证成功造模的同时,可提高犬的舒适度,减少不必要的并发症。
实验中常规按体重给予麻药,有一只犬突然苏醒,追加麻药后等到心率血压恢复到稳定状态后再起搏,进行记录。整个实验过程中一直保持良好的麻醉状态十分重要,麻醉过深或过浅均影响实验结果,每只犬对麻药的敏感性不一样,因此给予麻药时不仅考虑体重,还应考虑个体差异,整个实验过程中严密观察生命体征、睫毛反射,及时调整麻药剂量,避免突然苏醒等情况。
由于房颤发生机制尚不明确,对动物实验模型的研究有助于对患者房颤发生机制的进一步研究。本实验通过不同频率刺激犬右心房,在电生理及安全性方面探讨建立犬模型最佳起搏频率,为房颤的机制研究提供理论依据。

