成纤维细胞增殖通路相关9个基因可以预测糖尿病足的发生
马睿瑶 ,储金林,李念东,李琳琳
(1新疆医科大学药学院,2医学工程学院,乌鲁木齐 830017)
2型糖尿病患病人数逐年递增,根据第10版国际糖尿病联合会发布,2045年全球糖尿病患者将达到7.83亿[1]。随着血糖升高会引起多种并发症,如糖尿病肾病、糖尿病视网膜病变、糖尿病神经病变等,其中约有6.0%的患者会发展为糖尿病足[2],研究表明糖尿病足是下肢非创伤性截肢的主要原因之一,其死亡率高于某些肿瘤,给患者带来心理和经济压力[3-4]。成纤维细胞增殖在糖尿病足愈合中起重要作用,尤其是对后期影响,针对这条通路的药物也正在被研发[5-6]。5-羟甲基胞嘧啶(5 hmC)是5-甲基胞嘧啶(5 mC)在10-11位易位(TET)酶氧化形成,属于DNA的表观遗传修饰物,最近被作为血液标志物而被广泛研究[7]。最近研究表明,表观遗传修饰可能作为糖尿病表型和相关并发症发生的驱动因素,糖尿病患者外周血的5hmC水平高于健康人[8],同时发现糖尿病创面愈合与表观遗传相关[9],但尚未有糖尿病足患者与糖尿病患者血浆游离DNA(cfDNA)变化的报道。5hmC-Seal技术作为一种新型的测序技术,被用于糖尿病微血管并发症和糖尿病视网膜病血液生物标志物的寻找[10-11]。基于此,本文使用5hmC-Seal技术研究糖尿病足和糖尿病患者cfDNA的5hmC变化,发现成纤维细胞增殖相关通路能有效区分糖尿病足和糖尿病患者,并使用RNA-seq作为补充验证,为DFU诊断研究奠定基础,现报道如下。
1 材料与方法
1.1一般资料以2021年1-12月北京大学第三附属医院收治的6例糖尿病足患者为DFU组,平均年龄为(63.00±14.57)岁,选择同期年龄匹配的14例糖尿病患者血浆为对照组(DM组),平均年龄为(61.57±14.11)岁。本研究通过北京大学第三附属医院伦理委员会审批(批准号:M2020539),受试者均知情同意且签署知情同意书,两组临床信息均衡可比,见表1。
表1 临床信息表
1.2纳入和排除标准DFU组纳入标准:2型糖尿病;足部溃疡大于0.4 cm2;年满21周岁;创面持续时间>4周。DFU组排除标准:有感染临床症状的溃疡;活动性蜂窝织炎;骨髓炎;坏疽;近6周内同侧下肢血运重建;在研究开始前已服用或局部应用于伤口的任何实验性药物。糖尿病对照组标准:选取与DFU组性别比例、年龄相当,相同地区的糖尿病患者血浆作为对照组。
1.3方法
1.3.1 血浆分离 DNA提取 取全血(8 mL)于8.5 mL罗氏公司cfDTM游离核酸采血管:第一次离心,1 350 g,4℃低温离心12 min,取淡黄色上清转移至15 mL DNase free无菌离心管中;第二次离心,1 350 g,4℃低温离心 12 min;取上清转移至2~3管2 mL DNase free无菌离心管中;第三次离心,13 500 g,4℃低温离心 5 min,取上清转移至2 mL DNase free无菌离心管中。
1.3.2 cfDNA提取 取1 mL血浆于EP管中,采用Qiagen Circulating Nucleic Acid Kit试剂盒对血浆中cfDNA进行提取,-20℃冰箱稳定保存。血浆cfDNA浓度使用Invitrogen Qubit DSDNA HS ASSAY Kit试剂盒进行测量。
1.3.3 文库构建及测序 使用cfDNA建立5hmC文库[12],通过在Illumina NextSeq500平台上进行高通量测序。
1.3.4 差异羟甲基化修饰基因(DhMGs)的筛选 使用R语言中的DEseq2软件包进行差异分析,DhMGs的筛选条件为P<0.05和|log2FoldChange|≥0.5。
1.3.5 GSVA富集分析 使用R语言中的GSVA软件包进行富集分析,使用的比对文件为“c5.all.v7.5.1.symbols.gmt”,使用P<0.05和|log2FoldChange|≥0.2的条件筛序出差异的通路用于后续分析[13]。使用|log2FoldChange|最大的成纤维细胞增殖通路用于后续分析。
1.3.6 DhMGs调控网络的构建与分析 蛋白互作网络(PPI)的建立是使用数据分析软件STRING(https://string-db.org/)对上述筛选出成纤维细胞增殖通路所富含的18个DhMGs进行相互作用分析(置信度≥0.4,互作最大值=0)。随后通过Cytoscape3.9.0(https://cytoscape.org/)软件构建基因调控网络,再使用CytoHubba插件,选用MCC方法,从构建的PPI网络中选取前9个关键枢纽基因(Hub基因)。
1.3.7 RNA-seq数据分析 使用GEO数据库下载数据(https://www.ncbi.nlm.nih.gov/geo/),选择的数据集为“GSE134431”,共有21例样本,使用R语言中的limma软件包对RNA数据进行差异分析。
1.3.8 DhMGs建模区分两组 使用R语言中的glmnet(岭回归)软件包进行建模分析,ROC曲线的绘制及AUC值、灵敏度、特异性和95%CI值的计算均使用pROC软件包,使用LOOCV方法对建模是否出现过拟合现象进行评估。
2 结果
2.15hmC在糖尿病足与糖尿病患者中的分布特征根据测序数据显示,糖尿病足患者血浆cfDNA中5hmC水平低于糖尿病患者,在启动子和内含子区域分布水平较高,见图1A,主成分分析图(PCA)结果显示,组间5hmC的变化水平可以有效将两组区分开,见图1B。富集到差异羟基化修饰位点(DhMRs)主要富集在启动子和内含子区域,见图1C,与图1A一致。
2.2筛选差异羟甲基化修饰基因(DhMGs)接下来,以P<0.05和|log2FoldChange|≥0.5为条件共筛选出6 294个DhMGs;其中,上调的DhMGs有2 906个,下调的DhMGs有3 388个,选择top50的DhMGs做无监督聚类热图,可以有效将两组进行区分,见图2。
2.3DhMGs的GSVA功能富集分析对富集到5 748个DhMGs进行GSVA功能富集中的GO进行分析,根据P<0.05和|log2FoldChange|≥0.2的条件筛选差异通路,并使用top5通路进行无监督聚类热图分析,其中只有二醇代谢过程通路在糖尿病足患者中上调,而成纤维细胞增殖通路、多发性血管瘤通路、视网膜脱离通路和硬腭粘膜下裂通路在糖尿病足患者中下调,见图3,通路信息见表2,两组差异最大的是成纤维细胞增殖通路,其在糖尿病足患者中为下调。
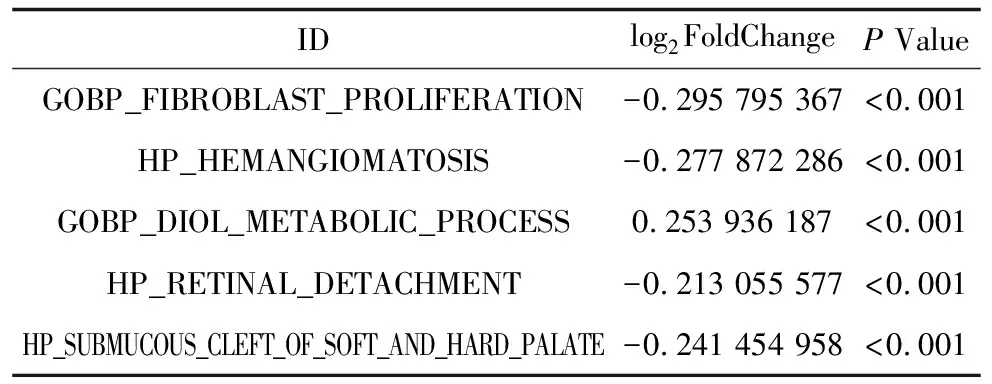
表2 GSVA功能富集分析通路信息图
2.4成纤维细胞增殖通路分析对成纤维细胞增生通路富集到的18个DhMGs进行分析,使用STRING 数据库建立DhMGs的PPI网络,见图4A,再用Cytoscape软件构建网络图,并使用CytoHubba功能寻找top9的Hub DhMGs,分别为EGFR、PDGFA、PDGFC、PDGFB、PDGFD、NGFR、CTNNB1、NF1和DHX9,见图4B,top9的Hub DhMGs的信息见表3。两组间这9个DhMGs的5hmC表达见图4C,其中糖尿病足患者EGFR、PDGFA、PDGFC、PDGFB、PDGFD、NGFR、CTNNB1、NF1的5hmC表达水平显著低于糖尿病患者,而只有DHX9的5hmC表达水平高于糖尿病患者。
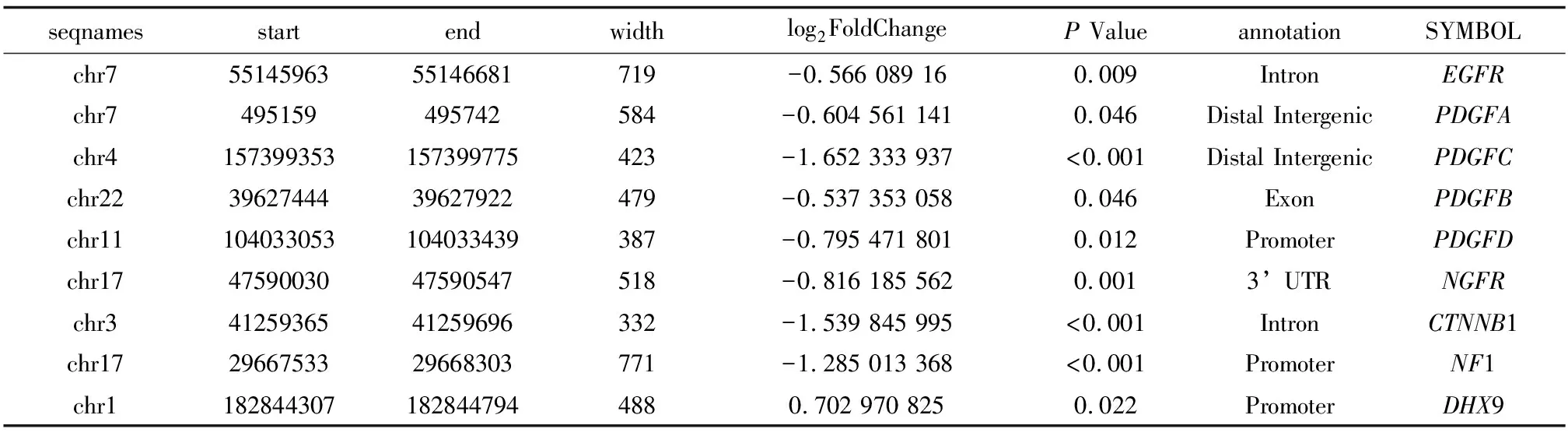
表3 Hub DhMGs信息表
2.55hmC作为糖尿病足与糖尿病患者区分的标志物使用岭回归的方法对上步筛选得到的9个DhMGs进行建模用于区分糖尿病足和糖尿病患者。9个DhMGs的5hmC表达量能够将两组完全区分开,其AUC值、灵敏度和特异性都为1.000,如图5A。接下来,为了验证这9个差异基因组成队列在糖尿病足中的重要性,且文献报道5hmC表达与基因表达呈现正相关趋势[14],我们使用9个差异基因RNA表达值对两组进行区分,结果显示使用RNA表达值也能很好将糖尿病足与糖尿病患者区分开,其AUC值为0.962、灵敏度为0.846、特异性为1.000,如图5B。为了验证9个差异DhMGs的重要性,使用单基因对两组区分,结果显示5hmC表达量对两组具有很好的区分,有7个DhMGs的AUC都为1.000,见图5C。再使用这9个基因的RNA表达值对两组区分,见图5D,其中PDGFD的AUC最高,为0.913,最低为DHX9为0.529,ROC其他详细指标见表4。根据相关性表达发现,无论在5hmC表达水平或者RNA表达水平,9个差异的基因之间有相关性(图6),但并不影响模型建立效果,模型未出现过拟合现象,如图7。

表4 差异基因ROC曲线信息表
3 讨论
通过本研究首先发现糖尿病足与糖尿病患者血浆cfDNA中的5hmC富集有差异,另外,通过PCA图显示5hmC标志物可以将两组区分开。表观遗传已经证明与2型糖尿病的发病相关[15],同时糖尿病伤口的表观遗传机制也被报道[9],为我们的研究提供理论基础。
其次,我们使用P<0.05和|log2FoldChange|≥0.5的条件筛选出2 651个上调和3 097个下调DhMGs,随后对这5 748个DhMGs使用GSVA功能集中的GO富集分析发现,|log2FoldChange|最大的为成纤维细胞增殖通路,因此后续也对此通路进行研究。成纤维细胞在伤口愈合的后期极为重要,高血糖能够直接诱导成纤维细胞的变化[5],进而导致糖尿病伤口的上皮功能障碍和愈合的延迟,这些主要与成纤维细胞增殖减少、细胞凋亡增加和向伤口部位的迁移受损有关[16-17]。在本次研究中发现,成纤维细胞增殖通路相关基因的表达在糖尿病足组中呈现下调趋势,表明糖尿病足患者此功能减弱,这与文献报道的一致[18],通过使用高压氧使成纤维细胞增殖,成为促进糖尿病伤口愈合的潜在治疗方法[19]。
最后,我们使用成纤维细胞增殖通路中的18个DhMGs进行分析,通过建立PPI网络与Cytoscape3.9.0软件中的CytoHubba功能筛选出9个Hub基因,后续对此分析。对EGFR、PDGFA、PDGFC、PDGFB、PDGFD、NGFR、CTNNB1、NF1、DHX9基因5hmC表达水平进行建模分析,发现AUC为1.000,灵敏度和特异性均为1.000,这表明成纤维细胞增殖通路上基因5hmC的变化与疾病具有较大的相关性。文献研究表示,5hmC的表达与基因表达呈现正相关趋势[20-21],因此我们后续利用GEO数据库对这9个基因的RNA表达进行分析,与5hmC相同,由这9个基因组成的模型用于区分糖尿病足和糖尿病患者的AUC为0.962,灵敏度与特异性分别为0.846和1.000,再次验证成纤维细胞增殖通路在糖尿病足的重要性,同时也验证这9个基因在糖尿病足中具有重要作用。
通过研究发现,与糖尿病患者相比,糖尿病足患者EGFR、PDGFA、PDGFC、PDGFB、PDGFD、NGFR、CTNNB1、NF1的5hmC表达水平显著下降,DHX9 的5hmC表达水平显著升高。EGFR在糖尿病伤口愈合被广泛报道,EGFR主要在上皮细胞中表达,具有促进细胞增殖、迁移和促进血管生成的功能[22-24],此外研究发现通过增加EGFR的表达可以使糖尿病伤口愈合加快[25]。富集到的PDGFA、PDGFC、PDGFB和PDGFD属于血小板衍生生长因子(PDGF)家族,PDGF在伤口愈合中起重要作用,功能主要包括炎症细胞募集、成纤维细胞增殖和迁移、上皮内胶原沉积和肉芽组织的形成[26-27],PDGFBB的激动剂已被批准用于治疗与糖尿病相关的伤口[28],但其他因子的激动剂还在被研究中。CTNNB1与糖尿病足相关,Wnt/β-catenin通路对慢性伤口具有影响[29],文献报道其参与糖尿病溃疡、伤口增殖、伤口重塑和干细胞炎症反应等[30]。NGFR与糖尿病视网膜病变相关[31],NF1与糖尿病相关[32],但报道较少,其与糖尿病足的相关报道较少。DHX9与肿瘤相关[33],但与糖尿病与糖尿病足的相关报道较少。
本研究发现成纤维细胞增殖通路中的9个5hmC修饰基因能够很好区分糖尿病足和糖尿病患者,验证了成纤维细胞增生通路在糖尿病足中的重要地位,表明使用5hmC-Seal技术对糖尿病足和糖尿病患者研究具有一定的价值。但本文仍存在一些不足,首先样本量较少,不能代表所有糖尿病足和糖尿病患者的情况,最后对寻找的靶点需要进一步验证。
——日晕

