帕博利珠单抗致免疫性心肌炎的文献分析
王 男,彭其林,谢丹妮,任天舒
0 引言
程序性细胞死亡受体-1(Programmed death-1,PD-1)免疫治疗是近年来肿瘤治疗研究领域的一大突破,在免疫治疗中免疫检查点抑制剂(Immune checkpoint inhibitors,ICIs)对肿瘤治疗有显著效果[1]。ICIs是针对宿主免疫负调节受体的单克隆抗体,如细胞毒性T淋巴细胞相关蛋白4(Cytotoxic T lymphocyte associated antigen-4,CTLA-4)、PD-1和程序性细胞死亡配体1 (Programmed cell death ligand 1,PD-L1)[2]。帕博利珠单抗是一种抗PD-1单克隆抗体,获美国食品药品监督管理局批准用于多种恶性肿瘤的治疗,于2018年7月26日在我国上市。该药在我国上市时间较短,我国医务人员对其引起的免疫性心肌炎了解较少。虽然免疫相关性心肌炎的发生率较低,但后果较为严重,甚至可能导致患者死亡[3]。为了解帕博利珠单抗引起免疫相关性心肌炎的规律和特点,本研究收集国内外相关的病例,提取数据并统计分析,为该药临床应用提供合理参考。
1 资料与方法
1.1 资料 中文以“帕博利珠单抗”、“心肌炎”,为关键词,英文以“pembrolizumab”,“myocarditis”为关键词,检索知网、维普、万方、PubMed和Web of Science等数据库,收集含帕博利珠单抗致免疫相关性心肌炎的病例文献。文献纳入标准:①免疫相关性心肌炎诊断明确且被作者判定为与帕博利珠单抗有关;②原发疾病、不良反应发生的时间、帕博利珠单抗的用药情况及转归等临床资料相对完整。排除标准:①重复发表的文献;②同时联合使用CTLA-4抑制剂的文献。
1.2 方法 采用自行设计的Excel表格,分别提取病例文献中患者的相关数据,包括患者性别、年龄、原发肿瘤、PD-1抑制剂用药情况(给药剂量和频次)、不良反应发生的大致时间、临床症状、病理结果、临床处理、合并用药及转归等,对上述资料信息提取形成一个文献信息提取表,对收集到的数据进行描述性统计分析。
2 结果
2.1 患者性别及年龄分布 共纳入19篇文献,英文文献17篇,中文文献2篇。涉及20例患者,其中男16例,女4例,最大年龄89岁,最小年龄45岁,其中60岁以上患者17例,平均年龄69.2岁。
2.2 用药原因和联合用药方案 见表1。
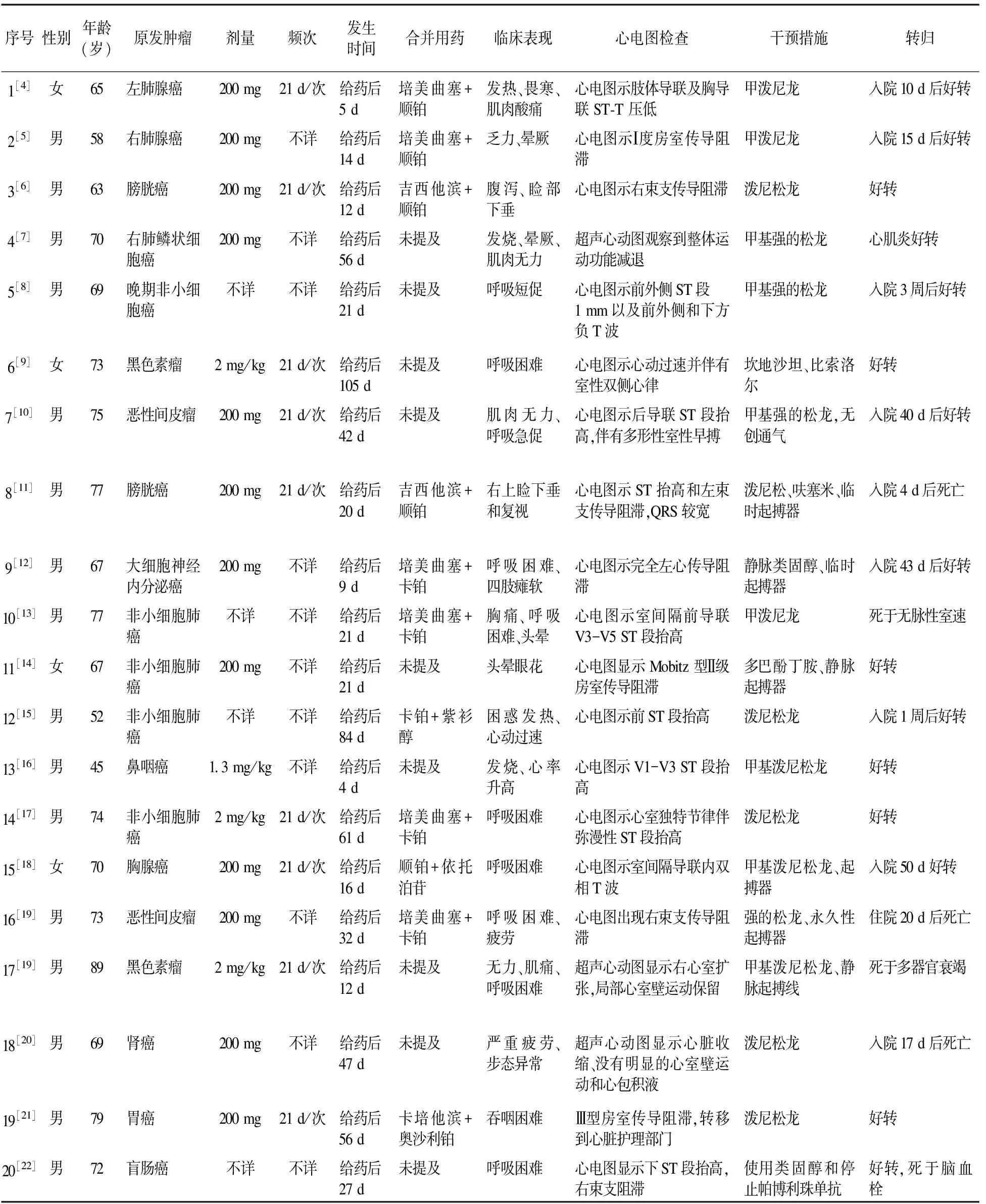
表1 20例帕博利珠致免疫相关性心肌炎患者发生情况
19篇致心肌炎文献中,原发疾病为黑色素瘤2例,非小细胞肺癌5例,恶性间皮瘤2例,膀胱癌2例,肺腺癌2例,右肺鳞状细胞癌、大细胞神经内分泌癌、鼻咽癌、胸腺癌、肾癌、胃癌、盲肠癌各1例。在20例心肌炎患者中,11例记录了帕博利珠单抗联合用药情况,其中2例联用培美曲塞、顺铂,4例联用培美曲塞、卡铂,2例联用吉西他滨、顺铂,1例联用卡铂、紫衫醇,1例联用顺铂、依托泊苷,1例联用卡培他滨、奥沙利铂。
2.3 帕博利珠用量及ADR发生时间 20例心肌炎病例中10例患者用药情况已准确记录,包括给药剂量和给药频次,其中6例给药剂量为200 mg/次,3例给药剂量为2 mg/kg,1例给药剂量为每次1.3 mg/kg,给药周期均为每21天给药一次。其余10例患者,7例用药剂量为200 mg,但周期不详。在20例心肌炎患者中,用帕博利珠单抗致心肌炎发生时间最早为给药后4 d,最晚为给药后105 d,14例(70.0%)发生在给药第1~2个周期内。
2.4 临床症状和相关检查 20例心肌炎患者中,最常见的临床症状有呼吸困难(8例,40%)、肌肉无力(5例,25%)、头晕(4例,20%),还有患者伴随发热、肌肉酸痛、呼吸短促、复视、睑下垂、吞咽困难等症状。17例报道了心电图的检查情况,发现8例有心脏传导阻滞,6例ST段抬高,3例患者出现QRS波较宽,见表2。3例进行了超声心动图检查,出现了心脏收缩、心室壁运动保留等情况。

表2 17例帕博利珠单抗致心肌炎患者的心电图检查情况
2.5 不良反应治疗与转归 20例心肌炎患者均接受糖皮质激素治疗(甲泼尼龙或泼尼松龙),有9例除应用糖皮质激素外,还联用坎地沙坦、呋塞米、多巴酚丁胺或植入起搏器。1例停用帕博利珠单抗,1例进行无创通气。在植入起搏器的6例患者中,2例死亡且与药物引起的心肌炎有关,1例死于多器官衰竭。20例患者有5例入院治疗后仍然死亡,有1例心肌炎症状好转,但最终死于脑血栓,其余14例经过治疗后,情况好转,心肌炎得到控制。见表3。

表3 帕博利珠单抗致心肌炎的治疗与转归
3 讨论
3.1 可能机制 ICIs抑制剂在增强细胞免疫抗肿瘤效应的同时,也可能增强机体正常的免疫反应,导致免疫耐受失衡,发生免疫相关不良反应(Immune-related adverse events,ir-AEs),甚至危及生命[23]。然而,帕博利珠单抗等ICIs引起免疫相关性心肌炎不良反应的具体机制仍不明确。
T细胞充分活化发挥免疫时需要双信号:第一信号是指抗原特异性信号,即抗原提呈细胞将抗原肽-组织相容性复合物提呈给T细胞,其表面抗体特异性识别抗原,启动抗原识别程序。第二信号是指协同刺激信号,包括免疫球蛋白超家族的B7/CD28、B7/CTLA-4等共刺激分子[24]。以上共刺激分子兴奋或抑制下游信号,进而兴奋或抑制T细胞,维持免疫系统在正常生理状况下的稳定性。然而,ICIs抑制剂在抗肿瘤治疗中对T细胞具有负性作用,其抑制肿瘤细胞生长的同时攻击体内的正常细胞,导致自身免疫性疾病的发生。研究表明,PD-1基因缺陷小鼠可因自身产生免疫球蛋白G抗体及高滴度肌球蛋白抗体,分别引起扩张型心肌病和致死性淋巴细胞浸润性心肌炎[25];CTLA-4基因敲除的小鼠会迅速发展为淋巴细胞浸润性心肌炎[26]。这些说明PD-1及CTLA-4等ICIs抑制剂引起心脏毒性的机制可能是降低了心脏中T细胞特异性自身抗原活性的阈值,进而说明PD-1及CTLA-4等免疫检查点可能是导致免疫相关性心肌炎不良反应的重要因子。
3.2 影响因素 年龄是心脏毒性的独立危险因素,帕博利珠单抗引起的心肌炎易发生于老年患者,发生率为0.06%~2.40%,60岁以上患者更易发生心脏毒性相关不良反应[2,27]。本研究中20例心肌炎患者的男女比例为4∶1,男性远多于女性,其中60岁以上患者占85.0%,可能与老年患者的心血管功能较弱有关。
3.3 ADR临床表现 在20例心肌炎患者中,14例(70.0%)病例ADR发生在给药后第1~2个周期内,可能与帕博利珠单抗的半衰期长(t1/2为21~25 d)有关。提示临床医师在应用帕博利珠单抗的前几个周期,需密切关注患者是否出现呼吸困难、乏力、头晕或晕厥等临床症状,同时应及时完善心电图、心肌损伤标志物的实验室检查及影像学检查等,充分排除引起心脏病变的其他原因。本研究中,40.0%的病例出现呼吸困难,20.0%的病例出现头晕或晕厥,85.0%的病例进行了心电图检查,其中有47.06%的病例和60.0%(3/5)的死亡病例出现传导阻滞。因此,应早期完善心脏相关检查,避免药物导致免疫相关性心肌炎引起更严重的后果。
3.4 治疗与转归 目前对于免疫相关性心肌炎并没有明确的治疗方案。激素是免疫相关性ADR最重要的治疗手段之一[28],但并不适用于所有心肌炎患者。在本研究中,20例心肌炎患者应用糖皮质激素进行治疗,但依然有20%的患者死于此药引起的免疫相关性心肌炎,20例患者中有6例植入了起搏器,有2例死于心肌炎。为规范免疫相关性心肌炎的治疗,降低病死率,美国临床肿瘤学会、中国临床肿瘤学会及欧洲肿瘤内科学会等多个免疫相关毒性管理指南一致指出,一旦怀疑患者免疫相关性心肌炎,首先应立即停止ICIs治疗,并根据ADR的严重程度进行分级治疗。由于缺乏免疫相关不良事件管理的高质量证据,因此所有推荐均基于专家共识。根据免疫相关性心肌炎的严重程度将其分为G1~G4 4个等级。发生G1级心脏不良反应时需暂停ICIs,并持续监测心电图及心肌损伤标志物,若2周内恢复至基线水平,则继续给药,若没有恢复至基线水平,继续暂停给药,并请心脏科会诊。出现 G2 级心脏不良反应后应永久停止使用ICIs,并迅速给予高剂量皮质类固醇(根据症状口服或静脉注射 1~2 mg/kg泼尼松);患者需住院并请心脏病学医生会诊;根据ACC/AHA指南和心脏病学医生的指导管理治疗;肌钙蛋白升高或传导异常的患者应立即转移到冠心病监护室;对没有立即响应高剂量糖皮质激素的患者,早期给予心脏移植排斥剂量的类固醇(甲基强的松龙1 g/d)并加入霉酚酸酯、英夫利西单抗或抗胸腺细胞球蛋白[29]。在心脏毒性的诊断、治疗以及随访各阶段应多学科共同协作,从而及时发现心脏毒性,并使患者的心脏毒性得到最及时的治疗,改善患者预后[30]。
综上,帕博利珠单抗与大量免疫相关不良事件相关,其中,尽管免疫相关性心肌炎的发生率不高,但其后果严重。因此,早期识别和适当的临床管理该药物所引起的不良反应至关重要,在临床应用此药物时应引起足够重视,从准备启动ICIs治疗时即密切关注患者是否出现呼吸困难、乏力、头晕或晕厥等相关的临床症状,及时完善心脏相关检查,充分排除引起心脏病变的其他原因。医务人员应采取多学科密切合作,建立多学科共同治疗模式,临床药师需主动监测该药所引起的心脏相关的不良反应,同时患者须了解该药物的副作用,药品生产企业应及时更新药物相关信息。

