生长素2,4-D对猕猴桃果实抗灰霉病的诱导作用
杨 帅,张剑涛,唐建民,李哲馨
(1.重庆三峡学院 生物与食品工程学院,重庆 万州 404100;2.重庆文理学院 a.园林与生命科学学院;b.特色植物研究院,重庆 永川 402160)
猕猴桃Actinidia chinensis原产于我国,是我国山区脱贫攻坚的特色优势树种,具有较高的经济效益、生态效益和社会效益。猕猴桃果实采后易受多种真菌感染,真菌感染果实后会造成巨大的经济损失并引发潜在的食品安全问题。灰霉菌Botrytis cinerea是引起猕猴桃采后病害的主要病原菌之一,其孢子在伤口处感染果实,导致果实迅速腐烂变质[1-4]。目前,猕猴桃灰霉病的防治仍以化学措施为主。化学杀菌剂能够有效防治猕猴桃灰霉病,却存在较多问题,例如导致病原体产生耐药性、食用后危害人体健康等[5]。
以物理、化学和生物激发子诱导水果对致病微生物产生自然抗性受到了越来越多的关注[6-7]。植物生长素是植物体内重要的生长调节因子,近年来被证实在植物病害防御中也发挥了重要的调控作用。生长素可分为植物内源生长素和人工合成生长素。研究结果表明,外源生长素处理可以通过调节内源生长素的水平来调控植物体细胞分裂。不同激素配合使用可能更有利于植株生长[8]。生长素、细胞分裂素和脱落酸的平衡作用可调控植株的生长势,且浓度较高的生长素和细胞分裂素或浓度较低的ABA 有利于植株的生长[9]。吲哚-3-乙酸(indole-3-acetic acid,IAA)和吲哚-3-丁酸(indole-3-butyric acid,IBA)均属于植物内源生长素。其中IAA 是活性内源生长素的主要表现形式,IBA 是IAA 的前体物质。人工合成生长素种类繁多,包括1-萘乙酸(1-naphthaleneacetic acid,NAA)和2,4-二氯苯氧乙酸(2,4-Dichlorophenoxyacetic acid,2,4-D)等,其化学性质较IAA 更稳定[10-11]。研究结果表明,各类生长素均可参与植物对病原微生物的防御。拟南芥中,生长素信号突变体axr1、axr2 和axr6在生长素诱导的Skp1-Cullin-F-box(SCF)泛素化途径中存在缺陷,会导致生长素的运输受到抑制,并增强拟南芥对黄瓜知球壳菌Plectosphaerella cucumerina和灰霉菌的易感性[12]。在烟草中木薯MeAux/IAAs基因的过表达,提高了其对细菌性萎蔫病菌Xanthomonas axonopodis的抗性,MeAux/IAAs沉默的烟草植株则表现出对该病菌的高度敏感性,MeAux/IAAs基因表达的改变也导致植物防御反应中致病相关基因、活性氧积累和胼胝质发育相关基因的转录水平发生变化[13]。在水稻中IAA 代谢相关基因OsGH3.1和OsCYP71Z2的过表达均能显著提高水稻植株对细菌稻黄单胞菌Xanthomonas oryzae和稻瘟病菌Magnaporthe grisea的广谱抗性[14-15]。病原菌通过向被侵染的细胞分泌生长素IAA 或增强寄主植物IAA 的合成,使寄主细胞内IAA 水平迅速增加,高浓度的IAA可降低植物细胞壁的pH,导致胞壁结构蛋白酸化,细胞壁发生重排,继而引起细胞壁松弛,细胞扩张,从而有利于病原微生物的入侵和扩散[14]。
生长素在果实采后贮运保鲜中也起到了积极的作用。采用生长素IAA 处理可以延缓采后草莓果实的成熟,且对草莓果实理化性质相关基因的表达具有重要的调节作用,包括上调表达AUX/IAA、ARF、TOPLESS和编码E3 泛素蛋白连接酶及膜联蛋白的基因,下调与果胶解聚、细胞壁降解、蔗糖和花青素生物合成相关基因的表达[16]。IAA信号转导途径通过调节乙烯的生物合成,参与调控木瓜、苹果等果实的采后成熟过程[17-18]。采用2,4-D 处理橙子,可导致果实中水杨酸、脱落酸含量的增加和乙烯含量的降低,木质素和水分含量的增加,防御酶基因的上调表达,从而提高橙子的防御胁迫能力,缓解果实衰老[19]。使用NAA 处理草莓果实时,可通过降低重要细胞壁降解基因的转录水平,防止冷藏期间细胞壁的正常降解,说明NAA 可通过影响草莓果实细胞壁组成和细胞壁修饰基因表达来调控果实成熟等[20]。因此,在采收阶段,提前进行生长素干预,可能对釆后猕猴桃果实抗灰霉病有一定的作用。
目前,关于生长素在植物病害防御中的作用有着较为广泛的研究报道,却鲜见生长素对采后果蔬病害或抗性影响的相关研究报道。为了明确植物生长素对采后果实抗性诱导的作用,本研究中以采后常温储藏且遗传背景明确的红阳猕猴桃果实为材料,研究各类植物生长素对猕猴桃果实灰霉病的诱导抗性作用规律,并检测外源生长素处理后猕猴桃果实组织中抗性相关生理指标和理化品质指标及抗性相关基因的表达。
1 材料与方法
1.1 试验材料
1.1.1 果实选择与预处理
以红阳猕猴桃果实为研究对象。在授粉后第130 天,采收形状、大小、质量(93 g)、成熟度等外观品质基本相同且无机械损伤及病菌感染的果实,并在采后5 h 内运回实验室。使用0.1%的次氯酸钠(NaClO)溶液浸泡消毒2 min,再用流动的自来水冲洗,并在室温下晾干(20 ~25 ℃)后备用。
1.1.2 培养基配制
马铃薯葡萄糖固体(PDA)培养基:称取200 g新鲜马铃薯,洗净、去皮、切碎,加1 000 mL 水煮沸0.5 h,纱布过滤取汁,加入20 g 葡萄糖、20 g 琼脂,定容至1 000 mL。121 ℃高压蒸汽灭菌20 min,稍冷却后加入终质量浓度50 mg/L 卡那霉素,倒平板备用。
1.1.3 病原菌
灰霉菌为实验室保藏菌种CJLC2,菌种保存在-80 ℃超低温冰箱中。将菌种取出后,置于冰上溶解,无菌条件下接种于PDA 培养基上,在25 ℃恒温箱中培养活化3 周后,再次转接到新的PDA 培养基上,培养2 周后即可稀释并用于侵染猕猴桃果实。
1.2 试验方法
1.2.1 灰霉菌侵染试验设计
1)不同种类生长素对猕猴桃果实灰霉病抗性的诱导作用。使用已消毒的打孔器在5 组猕猴桃果实表面形成大小、深度一致的伤口(5 mm×3 mm),使用移液枪在伤口处分别注入10 μL 的IAA、IBA、2,4-D、NAA 溶液(质量浓度均为50 mg/L,已过滤除菌),以无菌水为对照(CK)。在恒温恒湿条件下(25 ℃,相对湿度高于95%)诱导处理24 h 后,在已干燥的伤口处注入10 μL 灰霉菌孢子悬浮液(每毫升孢子数量为1×104),并用PE 塑料膜密封,贮藏于恒温箱。选取4 种生长素中诱导抗性效果最好的生长素进行后续试验。
2)不同浓度生长素对猕猴桃果实灰霉病抗性的诱导作用。使用已消毒的打孔器在6 组猕猴桃果实表面形成大小、深度一致的伤口(5 mm×3 mm),使用移液枪在伤口处分别注入10 μL 10、50、100、200、500 mg/L 的生长素溶液(已过滤除菌),以无菌水为对照(CK)。在恒温恒湿条件下(25 ℃,相对湿度高于95%)诱导处理24 h后,在已干燥的伤口处注入10 μL 灰霉菌孢子悬浮液(每毫升孢子数量为1×104),并用PE 塑料膜密封,贮藏于恒温箱。
3)生长素不同诱导时长对猕猴桃果实灰霉病抗性的诱导作用。使用已消毒的打孔器在2组猕猴桃果实表面形成大小、深度一致的伤口(5 mm×3 mm),使用移液枪在伤口处分别注入10 μL 无菌水(CK)和50 mg/L 的生长素。在恒温恒湿条件下(25 ℃,相对湿度高于95%)分别诱导处理0、6、12、24、48 h 后,在已干燥的伤口处注入10 μL 灰霉菌孢子悬浮液(每毫升孢子数量为1×104),并用PE 塑料膜密封,贮藏于恒温箱。
每个处理重复3 次,每次重复9 个果实。每天定时测量并记录果实伤口的发病率和病斑直径,结果以接种后72 h 时的平均发病率和平均病斑面积表示。
1.2.2 防御酶活性检测
在使用生长素和无菌水(CK)处理猕猴桃果实0、24、48、96、120 h 后,测定果肉中防御酶活性。
1)采用愈创木酚法检测POD 活性。采集1 g 样品,加入磷酸缓冲液(pH=7.8)和石英砂研磨匀浆,离心取上清,加入反应液(0.1 mol/L 磷酸缓冲液加入28 μL 愈创木酚),待反应液溶解后加入H2O2,并迅速测定吸光度。结果以每分钟内470 nm 处光密度(A470)变化0.01 为1 个酶活力单位。
2)采用紫外吸收法测定CAT 活性。采集1 g样品,加入磷酸缓冲液(pH=7.8)和石英砂研磨匀浆,离心取上清,加入H2O2,迅速测定吸光度。以每分钟内240 nm 处光密度(A240)降低0.1 为1 个酶活力单位。
3)采用氮蓝四唑(NBT)光化还原法测定SOD 活性。采集1 g 样品,加入磷酸缓冲液(pH=7.8)和石英砂研磨匀浆,离心取上清,依次加入0.05 mol/L 磷酸缓冲液、130 nmol/L Met 溶液、750 μmol/L NBT、100 μmol/L EDTA、20 μmol/L核黄素和酶液,测定吸光度(A560)。以抑制NBT光化还原50%的酶用量为1 个酶活力单位[4]。
1.2.3 基因表达量分析
在使用生长素和无菌水(CK)处理猕猴桃果实0、24、48、96、120 h 后,将其迅速使用液氮冷冻并研磨,使用RNAiso Plus 和fruitmate 试剂盒(Takara,大连)提取猕猴桃总RNA,使用Allin-One First-Strand cDNA Synthesis SuperMix for qPCR 试剂盒(全式金,北京)合成cDNA。根据猕猴桃基因组信息(http://kiwifruitgenome.org/),克隆猕猴桃抗病相关基因PR1(Actinidia00340)、PR4(Actinidia18363) 和PAL(Actinidia32440)的CDS 全长序列,并测序验证。使用Green Two-Step qRT-PCR SuperMix 试剂盒(全式金,北京)进行基因表达量检测,内参基因选用β-actin[3]。猕猴桃qRT-PCR 引物序列见表1。

表1 猕猴桃果实抗病相关基因qRT-PCR 引物Table 1 qRT PCR primers for disease resistance related genes in kiwifruit
2 结果与分析
2.1 生长素诱导对猕猴桃果实灰霉病抗性的影响
2.1.1 不同种类生长素对猕猴桃果实灰霉病抗性的诱导作用
在灰霉菌侵染72 h 后,不同种类生长素处理下猕猴桃果实感染灰霉病的情况如图1所示。由图1可以看出,与无菌水对照组相比,使用相同浓度的4 种生长素诱导相同时长,均可有效降低猕猴桃果实灰霉病的发病率。与对照组相比,经50 mg/L 生长素IAA 处理的猕猴桃果实的灰霉病发病率降低了24 个百分点(P<0.05);经50 mg/L生长素IBA 处理的猕猴桃果实的灰霉病发病率降低了30 个百分点(P<0.05);经50 mg/L 生长素2,4-D 处理的猕猴桃果实的灰霉病发病率降低了36 个百分点(P<0.05);经50 mg/L 生长素NAA 处理的猕猴桃果实的灰霉病发病率降低了24个百分点(P<0.05)。经无菌水处理的猕猴桃果实病斑面积为1.021 cm2,经IAA 处理的猕猴桃果实病斑面积为0.773 cm2,经IBA 处理的猕猴桃果实病斑面积为0.688 cm2,经2,4-D 处理的猕猴桃果实病斑面积为0.818 cm2。选取2,4-D 进行后续试验。
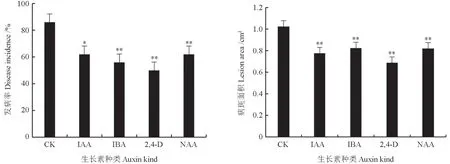
图1 不同种类生长素处理下猕猴桃果实感染灰霉病的情况Fig.1 Infection of actinidia fruit with B.cinerea under different auxin treatments
2.1.2 不同浓度2,4-D 对猕猴桃果实灰霉病抗性的诱导作用
在灰霉菌侵染72 h 后,不同浓度2,4-D 处理下猕猴桃果实感染灰霉病的情况如图2所示。由图2可以看出,不同浓度2,4-D 处理可影响猕猴桃果实灰霉病的发生和发展。当质量浓度为100 ~500 mg/L 时,2,4-D 可不同程度抑制灰霉菌在猕猴桃伤口的侵染;当质量浓度为50 mg/L 时,2,4-D 处理能显著降低猕猴桃果实上灰霉病的发病率和平均病斑面积,与对照相比,处理后猕猴桃发病率降低了40 个百分点(P<0.05),病斑面积也显著减少。
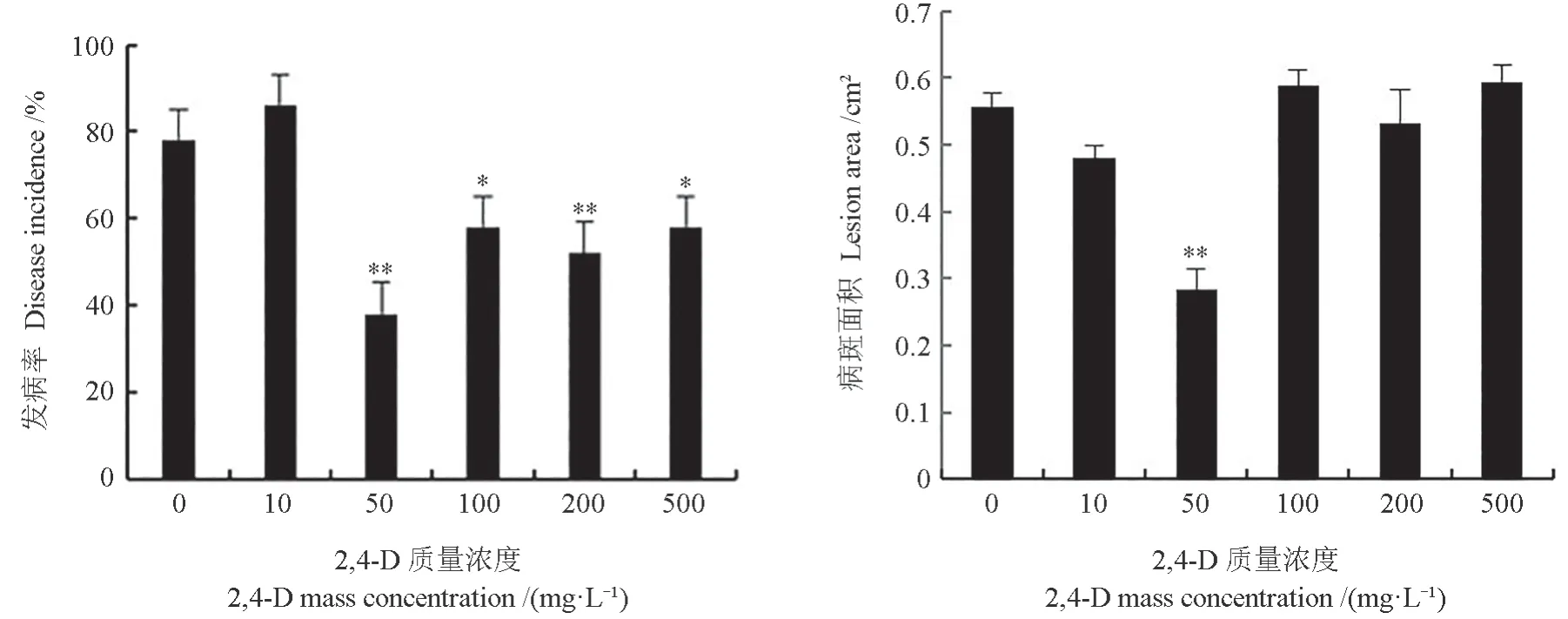
图2 不同浓度2,4-D 处理下猕猴桃果实感染灰霉病的情况Fig.2 Infection of actinidia fruit with B.cinerea under different concentrations of 2,4-D
2.1.3 不同2,4-D 诱导时长对猕猴桃果实灰霉病抗性的诱导作用
在灰霉菌侵染72 h 后,不同2,4-D 诱导时长条件下猕猴桃果实感染灰霉病的情况如图3所示。由图3可以看出,2,4-D 诱导时长可影响猕猴桃灰霉病的发生和发展。使用50 mg/L 的2,4-D 处理后直接接种,不能抑制猕猴桃果实伤口处灰霉菌的侵染。当诱导时长为12、24 和48 h 时,2,4-D 能在一定程度上抑制灰霉病的发生和发展。与对照无菌水处理相比,当诱导时长为12 h 时发病率降低了51.5 个百分点(P<0.05),当诱导时长为24 h时发病率降低了50 个百分点(P<0.05),当诱导时长为48 h 时发病率降低了58 个百分点(P<0.05)。与对照相比较,当诱导时长为12 h 时病斑面积平均减少0.429 cm2,当诱导时长为24 h 时病斑面积平均减少0.397 cm2,当诱导时长为48 h时病斑面积平均减少0.367 cm2。
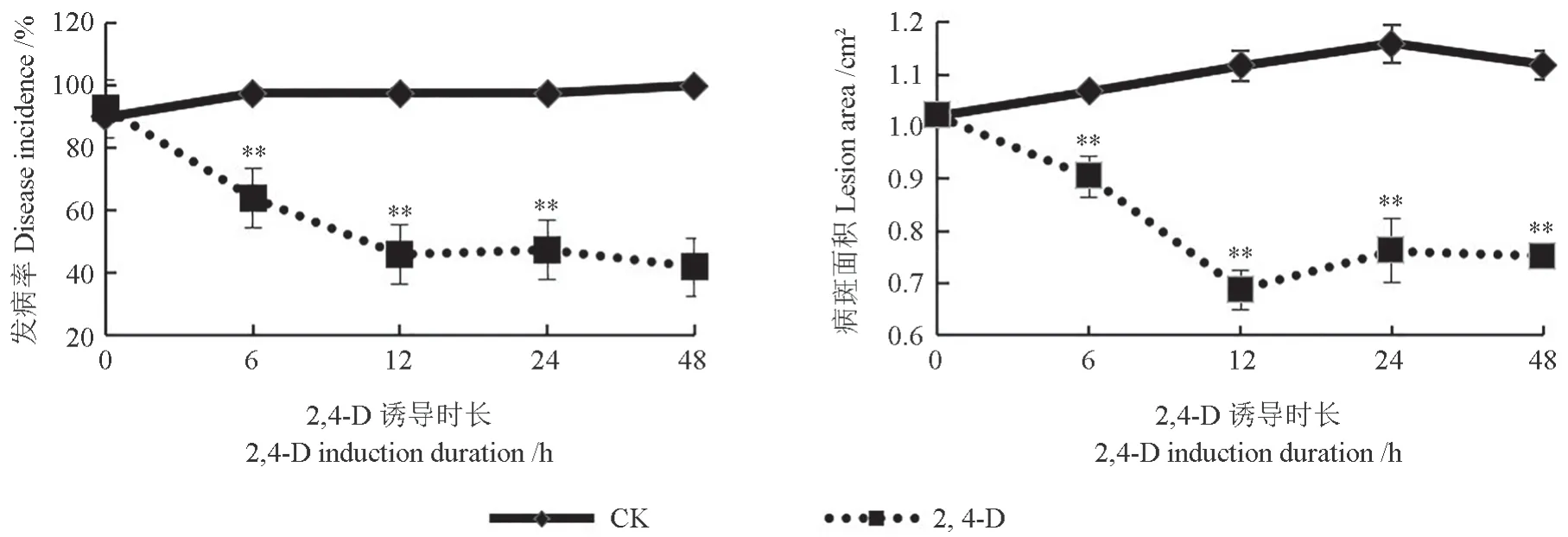
图3 不同2,4-D 诱导时长处理下猕猴桃果实感染灰霉病的情况Fig.3 Infection of kiwifruit fruit with B.cinerea under different 2,4-D induction duration treatments
2.2 2,4-D 对猕猴桃果实防御酶活性的影响
2,4-D 处理下猕猴桃果实防御酶活性的变化如图4所示。由图4可以看出,使用2,4-D 处理猕猴桃果实可诱导猕猴桃果实防御酶活性的增强。猕猴桃果实SOD 活性在2,4-D 处理24 h 时显著升高并达到峰值,约为对照组活性的1.10 倍,虽然之后活性降低,但至120 h 时活性仍然高于对照组,约是对照组的1.05 倍。猕猴桃果实CAT 活性在2,4-D 处理后呈波动上升,且在处理72 h 时达到峰值,约为对照组活性的1.19 倍,虽然之后活性降低,但至120 h 时仍然高于对照组,约是对照组的1.08倍。猕猴桃果实POD 活性在2,4-D 处理后72 h 时达到峰值,约为对照组活性的1.14 倍,虽然之后活性降低,但至120 h 时仍然高于对照组,约是对照组的1.03 倍。
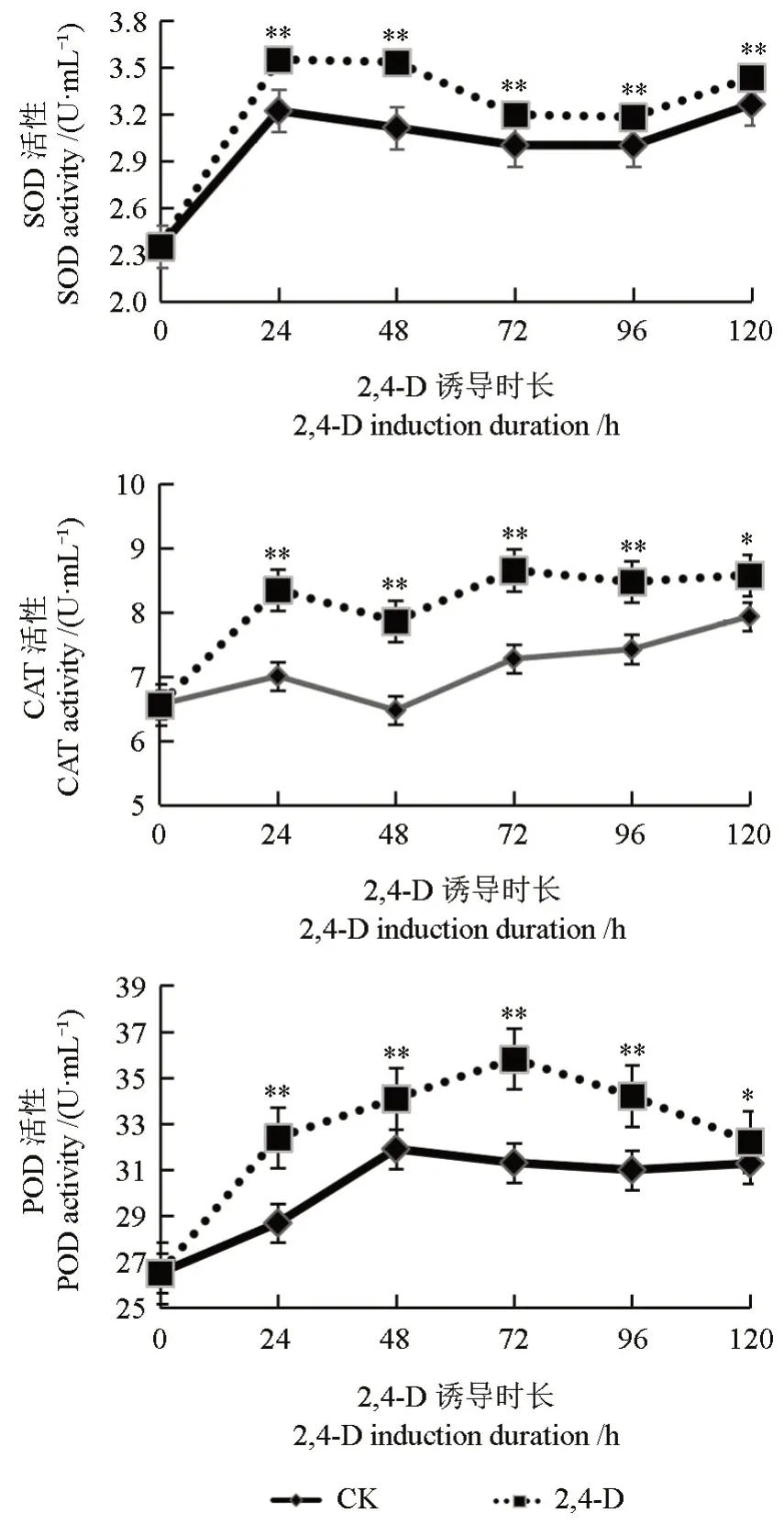
图4 2,4-D 处理下猕猴桃果实防御酶活性的变化Fig.4 Changes of defense enzyme activities in kiwifruit treated with 2,4-D
2.3 2,4-D 对猕猴桃果实抗病相关基因表达的影响
2,4-D 处理下猕猴桃果实抗病相关基因PR1、PR4和PAL表达的变化如图5所示。由图5可以看出,使用2,4-D 处理猕猴桃果实可诱导猕猴桃抗病相关基因上调表达。在使用2,4-D 处理24 h时,PR1和PR4的表达量迅速增加,与对照组相比表达量分别上调了9.33 和2.27 倍,随后两者均有逐渐降低的趋势。与对照组相比,PAL的表达量在2,4-D 处理24 h 时也出现了上调,在处理48 h 时表达量最高,是对照的5.27 倍,随后表达量下调。
3 结论与讨论
研究结果显示,浓度适宜的内源生长素IAA和IBA 以及合成生长素NAA 和2,4-D,均可诱导猕猴桃果实对灰霉菌产生抗性,但诱导抗性的强度存在差异。使用相同浓度的4 种生长素诱导相同时长后,受灰霉菌侵染的猕猴桃果实的发病率以2,4-D 处理的为最低。抑制猕猴桃果实灰霉病的最适2,4-D 质量浓度为50 mg/L,在此浓度下可显著降低灰霉病的发病率和平均病斑面积,在诱导12 ~48 h 后2,4-D 均能抑制灰霉病的发生和发展。为了解生长素2,4-D 诱导猕猴桃果实抗病的机制,检测了防御相关酶活性和抗病相关基因表达量,结果表明生长素2,4-D 可能通过增加防御酶活性及调控抗病相关基因的表达,诱导猕猴桃对灰霉病的抗性响应。因此,生长素2,4-D 处理是诱导猕猴桃果实自然抗性和抑制灰霉病的有效方法。
近年来,生长素在植物抗病及植物激素互作中的作用逐渐被关注[13,21-23]。如在玉米Zea mays中发现的抗病基因座qRfg2,可以预防玉米赤霉病以及真菌类病害如赤霉病等,qRfg2 的致病基因ZmAuxRP1可促进IAA 的生物合成,IAA 可以及时有效地调节生长-防御平衡,从而优化植物的适应性等[22]。然而关于生长素对采后果实的抗病作用机制的研究鲜有报道。Zhang 等[21]在研究生长素诱导梨果实抗性中的作用时,发现使用100 ~500 mg/L 的IAA 诱导24 ~48 h 时,梨果实对蓝霉腐病的抗性明显增强,表明IAA 在诱导梨果实对病原菌产生抗性方面具有显著作用,通过对防御酶活性及抗病相关基因的表达水平进行检测,推测该机制可能与诱导防御相关酶和调节基因表达密切相关。植物受到外源因素刺激后,不能立刻获得抗性,而是需要一定时长才能发生响应[24]。在前期试验中,将不同浓度生长素2,4-D添加至PDA 培养基对灰霉菌进行接种培养,未发现显著的抑制作用。这些结果表明,生长素可能通过诱导猕猴桃果实产生抗性,抵御灰霉菌的侵染。可以将生长素2,4-D 作为有效防治果实采后病害的手段。
生物和非生物胁迫因子诱导植物组织产生过量的活性氧。SOD、POD 和CAT 是植物组织中重要的抗氧化酶,在清除活性氧方面起重要作用[25]。例如,2年生赤皮青冈幼苗较1年生幼苗具备更强的抗氧化能力,胁迫状态下赤皮青冈幼苗POD、SOD 的响应也更为迅速,间接说明赤皮青冈能通过POD 等抗氧化物来适应一定程度下的胁迫环境[26]。本研究结果显示,使用无菌水处理猕猴桃果实时,由于造成伤口且与空气接触,果实中SOD、POD 及CAT 活性均有所增加。使用2,4-D处理后,猕猴桃果实的SOD、POD 活性可在短时间内(24 h)被诱导迅速增加,显著高于对照组,但在诱导72 h 时出现下降的趋势。
植物在受到生物或非生物胁迫时会诱发病原相关蛋白(PRs)的表达,在较多植物物种中PR1被用作系统获得抗性的分子标记[27]。本研究结果显示:在2,4-D 诱导处理24 h 时猕猴桃PR1和PR4基因的表达量迅速增加,与无菌水处理相比分别上调了9.33 和2.27 倍,随后其表达量有逐渐降低的趋势;在2,4-D 处理24 h 时,PAL基因的表达量也出现了上调,在处理48 h 时表达量最高,是对照的5.27 倍,随后表达量下调。这与前人研究结果相一致,例如:外源2,4-D 处理可导致PR4基因在柑橘类果实的上调表达,并显著减少水果腐败的发生[19];Gamma 辐射可诱导梨果实产生对病原真菌扩展青霉Penicillium expansu的抗性,并可上调表达PR1和PR4基因[28];苯丙烷代谢途径关键酶基因PAL可促进植物产生木质素等抗性次生代谢产物,与植物抗病息息相关[29];采用不同灰霉菌菌种侵染番茄果实,可诱导果实产生生长素IAA、水杨酸,并伴随着PAL 酶活性的显著提升[30]。但其具体作用机制有待进一步探索。
本研究结果证明了生长素在植物与真菌的相互作用中具有一定的重要性[31],但尚未阐明病毒蛋白与生长素调节因子之间的相互作用。后续可研究2,4-D 对未受伤猕猴桃果实自然腐烂的影响,以及在生化和分子水平上IAA 信号通路与猕猴桃果实防御机制之间的潜在相互作用。阐明生长素精确防御病毒侵染的机制,明确生长素信号通路在宿主防御反应中的作用及其被病毒破坏的机制,将有助于为提高植物的抗病毒能力提供新思路。

