黑老虎带芽茎段的组织培养及快速增殖
卢 锟,仲嘉玥,张 慧,刘 洋,王 森,杨 奥,李 泽
(1.中南林业科技大学 a.经济林培育与保护教育部重点实验室;b.食品与工程学院;c.湖南省“一带一路”热带干旱经济林国际联合研究中心,湖南 长沙 410004;2.通道南楚农业开发有限公司,湖南 怀化 418500)
黑老虎Kadsura coccinea是木兰科Magnoliaceae南五味子属Kadsura的常绿藤本植物,别名布福娜、冷饭团、臭饭团、酒饭团等,广泛分布于我国广东、广西、海南、江西、浙江、福建、湖南、贵州、四川、云南等省(区)[1-2]。黑老虎是一种集食用价值、药用价值、绿化价值、观赏价值于一体的极具开发潜力的多用途新型果树。就药用价值来说,其根、茎、叶中含有绿原酸、咖啡酸、阿魏酸、没食子酸等具有重要药理活性的化合物[3]。在黑老虎根、茎、叶这3 个器官中含有不同浓度的精油,精油中共含有116 种挥发性成分,这些成分可用于治疗皮肤炎症[4]。黑老虎种子和果皮的提取液具有抑制酪氨酸酶活性的功效,可作为美容产品中活性成分的重要来源[5]。除此之外,黑老虎还具有明显的抗肿瘤、抗HIV、抗炎、保肝、抗氧化等作用[6-7]。鉴于黑老虎的应用价值极高,有研究人员对其进行了深入研究,开发了黑老虎SSR 标记,可为其群体遗传学研究以及种质资源收集、保存、评价以及良种选育提供依据[8]。目前,低产低效严重制约了黑老虎产业的发展,主要原因之一就是无性繁殖技术不成熟,良种化程度低。黑老虎苗木主要是实生苗,不能保持母本的优良性状,子代生长性状良莠不齐,不利于其规模化育苗和产业化生产[9-10]。前人对黑老虎无性繁殖扦插及嫁接技术进行了相关研究,黑老虎扦插后苗木根系较弱,生根率仅为(75.99±0.30)%,扦插育苗技术不成熟[11-12];黑老虎嫁接技术也是一个重要的研究内容,黑老虎伤口处容易产生大量的黏液,影响嫁接成活,黑老虎嫁接成活率为80%[13]。此外,扦插和嫁接繁殖受季节限制,尚不能满足黑老虎产业发展的要求。
组织培养具有繁殖速度快,不受季节限制及可培养脱毒苗等优点,是快速繁殖优良植物品种的一条重要途径,具有广阔的商业化前景[14-15]。组织培养技术还可应用于种质保存、体细胞无性变异和突变体筛选、次生代谢物的生产以及林木育种等[16]。植物组织培养技术不受材料种类限制,可利用种子、叶片、带芽茎段等多种组织器官作为外植体进行诱导培养。孙艳艳等[17]以‘玲珑’枫香叶片为外植体进行组织培养研究,最终初步建立了‘玲珑’枫香叶片愈伤组织增殖培养和不定芽诱导体系。因此,利用植物组培技术培育黑老虎脱毒苗,有利于黑老虎品质的提高及产业的快速发展[18]。目前,关于通过组织培养获得黑老虎无菌苗的研究报道较少。梁忠厚[19]研制了适合诱导黑老虎直接胚体发生和植株再生的培养基,并详细报道了培养基的配制方法;韦荣昌等[20]报道了将黑老虎茎尖顶端幼嫩叶片培育成完整植株的方法。但是,目前黑老虎带芽茎段组织培养技术体系尚不完善,不利于后期进行工厂化育苗。本研究中主要以黑老虎带芽茎段为外植体,通过改变外植体消毒处理方式、植物生长调节剂的种类及浓度配比,研究培养黑老虎无菌苗的适宜条件,旨在为黑老虎的工厂化育苗提供参考依据。
1 材料与方法
1.1 材 料
黑老虎带芽茎段采自通道县芋头村(109°47′13.40″E,26°9′49.87″N)。2018年3月,将大田栽培的3年生黑老虎大苗移栽到高30 cm、直径25 cm 的塑料盆中,剪掉地上部分的茎段和叶片,在中南林业科技大学树木楼实验室楼顶温室内培养。正常水肥管理3 ~5 个月后,用再次萌发的半木质化带芽茎段作为试验材料。
1.2 方 法
1.2.1 外植体取样及前期处理
在晴天上午,选取生长健壮的半木质化黑老虎带芽茎段带回实验室。剪去叶片后,切成3 ~4 cm 长的茎段,每茎段带1 个腋芽。将带芽茎段放在三角瓶中用自来水冲洗1 ~2 遍,放入洗洁精冲洗1 ~2 遍,再用流水反复冲洗60 min,最后用无菌水清洗3 ~5 次,以免茎段分泌的大量黏液影响正常的消毒处理。
1.2.2 外植体材料消毒
分别以温室盆栽和大田培养的黑老虎植株的带芽茎段为外植体,在无菌条件下用75%的酒精溶液、5%的次氯酸钠溶液、0.1%的升汞溶液对黑老虎带芽茎段进行消毒处理,75%酒精溶液的消毒时长分别设置为1.5、2.0、3.0 min,5%次氯酸钠溶液的消毒时长分别设置为0、23、25 min,0.1%升汞溶液的消毒时长分别设置为0、30、35、40、45、50 min。消毒过程中用镊子在烧杯中不断搅动,消毒完成后用无菌水冲洗5 ~6 遍。在培养皿中用无菌滤纸吸干茎段表面的水分,用小刀切掉茎段两端褐化的部分,将带芽茎段接种到培养基中进行培养,25 d 后统计污染率及褐化率。
1.2.3 外植体培养
初始腋芽诱导培养以1/2MS 为基本培养基,其中含蔗糖30 g/L,琼脂7 g/L,培养基pH 为5.5 ~5.8。在无菌条件下,将经消毒的外植体接种到含6-BA(0、1.0、2.0 和3.0 mg/L)、IAA(0、0.1、0.2、0.5 和1.0 mg/L)、GA3(0、1.0 和2.0 mg/L)的培养基中诱导腋芽,培养温度为(26±1) ℃。暗培养5 d 后转到光照条件下培养,光照强度为2 100 ~2 200 lx,光照12 ~14 h/d。25 d 后统计腋芽的诱导率及生长情况。
继代增殖培养以1/2MS 为基本培养基,其中含蔗糖30 g/L,琼脂7 g/L,培养基pH 为5.5 ~5.8。在无菌条件下,将经初代培养获得的腋芽切下,接种到加入不同植物生长调节剂ZT(0、1.0 和2.0 mg/L)、IAA(0、0.1 和0.2 mg/L)、2-iP(0、1.0和2.0 mg/L)、IBA(0、0.1 和0.5 mg/L)、6-BA(0、1.0、2.0 和3.0 mg/L)的培养基中进行腋芽的增殖培养,培养温度为(26±1) ℃。暗培养2 d 后转到光照条件下培养,光照强度为2 100 ~2 200 lx,光照12 ~14 h/d。30 d 后统计增殖系数。增殖系数为增殖后芽总数量与接种时芽总数量的比值。
1.3 数据分析
使用SPSS 17.0 软件进行方差分析和多重比较分析(Duncan 氏法)。
2 结果与分析
2.1 不同消毒处理对黑老虎茎段的消毒效果
不同消毒处理对大田栽培黑老虎带芽茎段的消毒效果见表1。由表1可知,大田直接采回的黑老虎带芽茎段难以诱导出腋芽,腋芽成活率均为0。消毒时长超过50 min,腋芽全部褐化死亡(图1A),褐化后也会出现污染现象(图1B);消毒时长少于40 min,茎段容易被污染(图1C)。即使是培养30 d 后,已长大腋芽的基部仍会长出大量菌丝(图1D),1 周后培养基完全被污染。说明通过以上消毒方式无法解决大田黑老虎带芽茎段难消毒的问题。

图1 组织培养过程中黑老虎茎段的污染状况Fig.1 Contamination of the stem segment with bud of K.coccinea during tissue culture
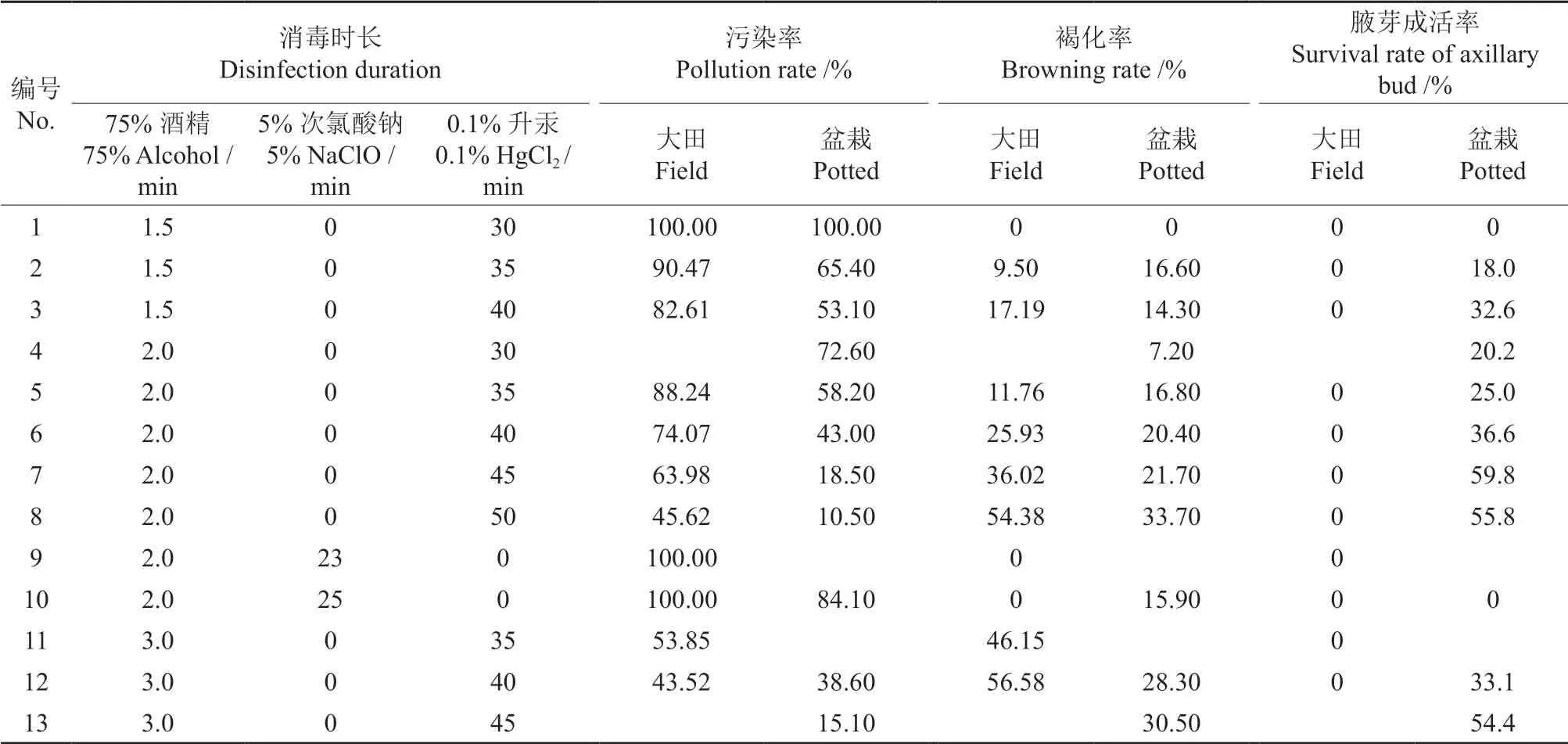
表1 不同消毒处理对黑老虎茎段的消毒效果†Table 1 Disinfection effects of different disinfection treatments on the stem segment with bud of K.coccinea
不同消毒处理对温室盆栽黑老虎茎段的消毒效果见表1。由表1可知,黑老虎带芽茎段的污染率得到了明显控制,并且腋芽诱导成活率明显提高。由此可见,温室盆栽黑老虎带芽茎段带菌少,各消毒处理的效果明显,普遍比大田栽培带芽茎段的消毒效果好。其中,使用75%酒精消毒2 min+0.1%升汞消毒45 min 处理的外植体污染率和褐化率最低,污染率为18.5%,褐化率为21.7%。
2.2 不同植物生长调节剂对黑老虎茎段初代培养的影响
将消毒后的黑老虎带芽茎段接种到初代培养基中进行腋芽诱导培养,各培养基中腋芽的生长情况见表2和图2。

图2 初代培养中黑老虎茎段腋芽生长情况Fig.2 Growth of axillary buds in stem segment of K.coccinea in primary culture
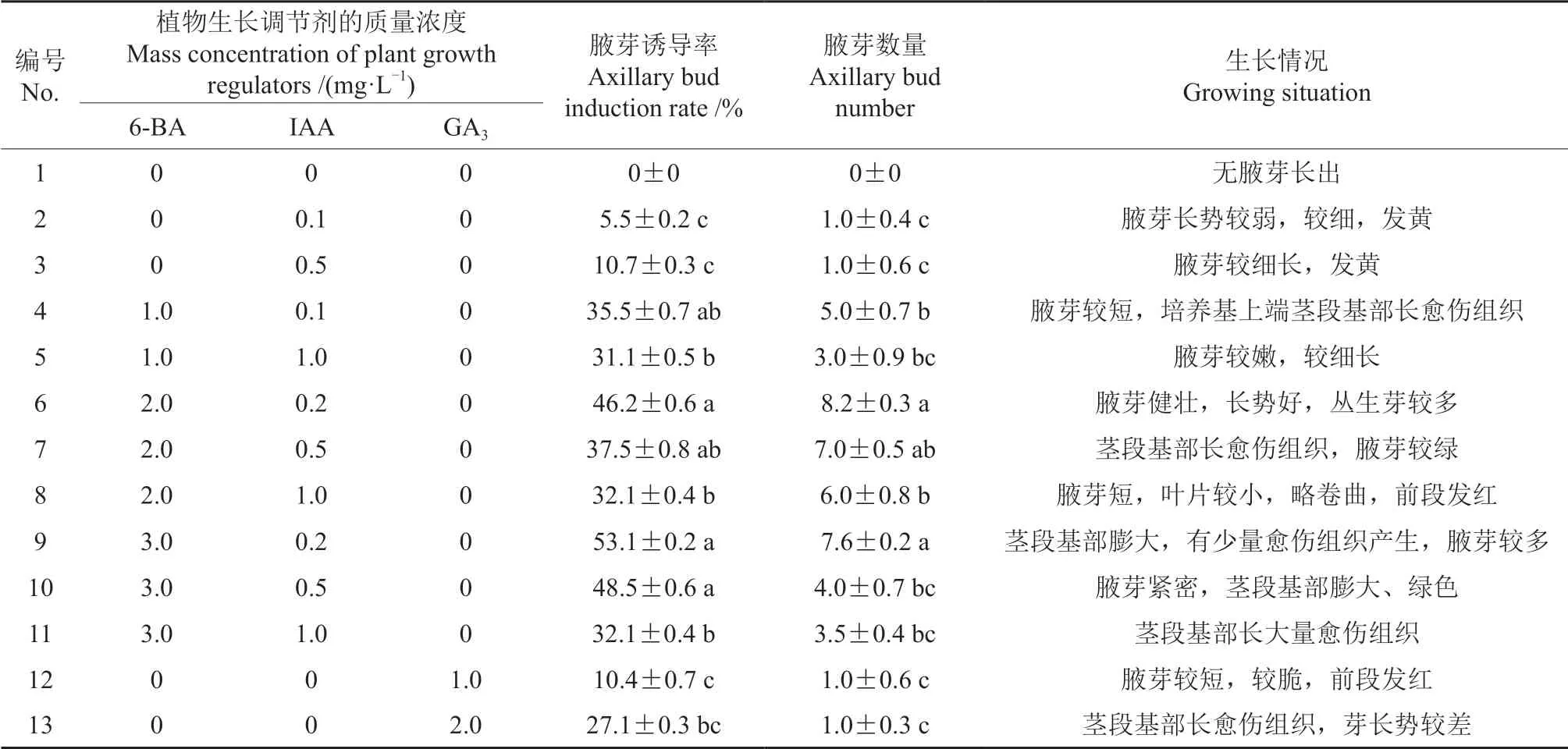
表2 不同植物生长调节剂对黑老虎茎段初代培养的影响†Table 2 Effects of different plant growth regulators on primary culture of the stem segment with bud of K.coccinea
由表2可知:培养基中仅加入IAA 或GA3时,腋芽长势弱;加入6-BA 和IAA 时,腋芽的生长状况随着6-BA 浓度的变化而变化,当6-BA质量浓度为2.0 mg/L 时,腋芽的生长状况较好。所以最终确定黑老虎带芽茎段的初代培养基为1/2 MS+2.0 mg/L 6-BA+0.2 mg/L IAA,诱导率可达46.2%,且初代培养中增殖系数达8.0 以上。
2.3 不同植物生长调节剂对黑老虎带芽茎段继代培养的影响
将经初代培养获得的腋芽切下,接种添加ZT、IAA、2ip 或添加IBA、6-BA 的1/2 MS 培养基上,进行腋芽的增殖培养,增殖结果见表3。由表3可知:ZT、IAA 和2ip 组合的处理中增殖系数均不高,腋芽的增殖效果并不明显;在添加IBA、6-BA 的处理中,腋芽的增殖系数较高,生长状况较好。因此适宜黑老虎腋芽增殖培养的培养基为1/2 MS+3.0 mg/L 6-BA+0.1 mg/L IBA,最高增殖系数可达8.5。继代培养中黑老虎茎段腋芽增殖情况如图3所示。

图3 继代培养中黑老虎茎段腋芽增殖情况Fig.3 Proliferation of axillary buds in stem segments of K.coccinea in subculture

表3 不同植物生长调节剂对黑老虎茎段继代培养的影响†Table 3 Effects of different plant growth regulators on subculture of the stem segment with bud of K.coccinea
3 结论与讨论
对采集的大田和温室盆栽黑老虎带芽茎段进行消毒处理,对比两者的污染率、褐化率及腋芽诱导率,结果表明温室盆栽黑老虎带芽茎段的消毒效果优于大田黑老虎,因此,以黑老虎带芽茎段为外植体进行组织培养时,优选室内培养的植株进行采样。以温室盆栽黑老虎的带芽茎段为外植体时,75%酒精消毒2 min,再用0.1%升汞消毒45 min 处理的污染率和褐化率最低,此时污染率为18.5%,褐化率为21.7%。将消毒后的带芽茎段接种到初代培养基中进行腋芽诱导培养,得到的最佳培养基为1/2 MS+2.0 mg/L 6-BA+0.2 mg/L IAA,诱导率可达46.2%,且增殖系数能达8.0 以上。将经初代培养诱导出的腋芽从基部切下后接种到继代增殖培养基中,得到的最佳培养基为1/2 MS+3.0 mg/L 6-BA+0.1 mg/L IBA,最高增殖系数可达8.5。
无性繁殖技术的发展解决了传统人工栽培育种中存在的诸多问题,如周期长、繁殖系数不高等,为植物种质资源的保存及开发利用提供了新途径[21]。目前,常用的无性繁殖技术包括嫁接、扦插、组织培养等[22]。本文中主要以建立黑老虎带芽茎段的组织培养技术体系为目的,选取了生长健壮、腋芽饱满的黑老虎带芽茎段作为外植体,从消毒、初代腋芽诱导培养、继代增殖培养3 个方面进行了研究。
黑老虎带芽茎段组织培养技术体系建立过程中面临的最大难题是外植体的消毒。不彻底的消毒容易造成污染,获得无菌苗的可能性较小,过度消毒则使外植体褐化。该问题严重限制了黑老虎无性繁殖脱毒苗的生产,严重阻碍了黑老虎遗传转化体系的发展。造成黑老虎带芽茎段污染的原因较多,可分为内部因素与外部因素。内部因素是黑老虎的内生菌难以消除,外部因素主要为与外界接触过程中植株附着的细菌和真菌过多。本研究中选用大田黑老虎的带芽茎段为外植体进行消毒,结果表明即使带芽茎段已消毒超过50 min 且发生褐化,但无法彻底消毒,培养过程中仍被污染。为解决该问题,将2 ~3年生的大田黑老虎苗剪掉地上部分后移栽到花盆中,在温室内培养,待植株长出新梢后,采集带饱满芽的半木质化茎段作为外植体,使用75%酒精、0.1%升汞和5%次氯酸钠进行消毒,结果表明在温室盆栽植株上采样可显著降低初代培养的污染率,成功获得了黑老虎无菌芽,基本控制了黑老虎带芽茎段初代培养的污染率。在黑老虎带芽茎段的消毒过程中,消毒时长尤为重要,既要控制污染率,又要控制褐化率。张赫岩等[23]以重瓣榆叶梅的茎段为外植体,使用75%酒精、0.1%升汞和5%次氯酸钠进行消毒,结果表明消毒时长过多和过少均会影响茎段的存活率,与本研究结果基本一致。在本研究中发现:升汞消毒时长超过50 min 会导致茎段褐化严重,茎段成活率低;升汞消毒时长少于40 min 则污染率较高。另外,黑老虎带芽茎段伤口处会分泌出大量黏液,酒精对黏液的清理效果较为显著,升汞对黑老虎外植体褐化的影响远小于酒精,因此最终采用酒精较短消毒时长、升汞较长消毒时长联合处理外植体的方法,虽然该方法耗时较长,但是其平衡污染率和褐化率的效果较好。
在进行腋芽诱导时,6-BA 和IAA 联合使用的效果明显优于GA3,在培养基添加GA3的处理中诱导率低且腋芽长势较差,但在3.0 mg/L 6-BA+0.1 mg/L IAA 处理中得到了生长旺盛的腋芽,可用于后续的继代增殖培养。在继代增殖培养中,3.0 mg/L 6-BA+0.1 mg/L IBA 处理的增殖系数最高,效果明显优于ZT、IAA、2ip 联合使用。
本研究中筛选出了能使带芽茎段稳定萌发的培养基,培育出了生长健壮的无菌苗,但无菌苗生根率较低,长出的根系较弱,无法进行炼苗移栽。因此,后续将进一步筛选促进黑老虎无菌苗根系发育的培养基配方。

