多菌灵与β-环糊精包合物的制备、表征及pH响应性行为的研究
姜宇,刘兴欢,刘升学,贾鑫
(石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室,新疆 石河子 832003)
多菌灵(CB)是一种用于防治植物多种真菌病害的内吸性杀菌剂。其主要作用机制是干扰真菌有丝分裂中纺锤体的形成,从而影响细胞分裂[1]。此外,CB具有热稳定性、毒性低的优点。市场上CB的主要剂型有可湿性粉剂、悬浮剂和水分散颗粒。这些常用剂型能够在一定程度上提高CB在水中的分散性,但在实际应用中仍存在水溶性差、生物利用率低、残留过多等缺点,极大地限制了CB在农业生产中的应用[2]。利用超分子化学中的主客体匹配原理改善农药原药的性能是超分子化学在农药学上的主要应用,利用大环分子及其主客体识别来克服上述问题已受到广泛关注。
环糊精(CDs)是1891年Villiers发现的由淀粉经过酶解得到的环状寡糖。它们是截锥状的大环化合物,具有疏水的空腔和亲水的外壁。这种独特的结构可以包合极性和尺寸合适的小分子化合物,通过主-客体相互作用形成包合物。由于CDs的细胞毒性较低,生物安全性良好,经过CDs包合后可以减少或消除药物的不良副作用。此外,难溶于水的分子可以通过与CDs形成包合物来改善其水溶性,同时改变了其理化性质[3]。α-、β-和γ-CD分别由6、7和8个葡萄糖单元组成,是研究最多的环糊精。特别是,β-CD来源多样、价格较为低廉,空腔尺寸更适合大多数疏水性分子嵌入,在医药和农药领域得到了尤为广泛的应用。Lezcano[4]使用相溶解度图研究了β-CD对CB的增溶效果。Guo[5]和Li[6]研究表明β-CD分子可以与CB形成主客体包合物。Sun[7]进一步采用共沉淀法基于有机溶剂体系制备了CB和β-CD的包合物。但有机溶剂的使用对环境有害,其后处理也较为困难,增加了生产投入。
由于pH值对CB的溶解性有很大的影响[8],本研究提出了一种制备CB和β-CD包合物的新方法,即调节水溶液的pH法,并对包合物进行表征和分析。该方法不添加任何有机溶剂,符合农业绿色发展方向。由于南方的梅雨天导致真菌大量繁殖,研究了包合物在pH=5.4(雨水的pH)的抑菌效果,其相较于CB原药显示出更加优异的抑菌效果。对比了包合物在pH为5.4和7.8(正常灌溉用水的pH)的释放情况,发现其具有pH响应性释放特性。这有利于CB的靶向应用,大大提高了CB的生物利用率,保护了环境。
1 材料与方法
1.1 仪器与试剂
紫外-可见分光光度计(Agilent Cary 60,德国);热重分析仪(STA 449F3,NETZSCH德国);粉末X射线衍射仪(Panalytical X’Pert PRO,瑞士);红外光谱仪(Bruker Vertex 70V,瑞士);扫描电镜(SU8010,HITACHI日本);核磁共振仪(Bruker Avance Ⅲ HD 400,瑞士)。
β-CD(纯度>99.0%,分子量=1 135.0),CB,NaOH (AR)均购买于上海阿达玛斯试剂有限公司。HCl(36.5 wt.%)购买于临沂茂兴化工有限公司。磷酸盐缓冲溶液(pH为5.4和7.8)由KH2PO4(AR)和K2HPO4·3H2O(AR)按一定比例配制而成。早疫病菌由石河子大学农学院提供。马铃薯葡萄糖琼脂培养基(PDA)购买于青岛海博生物科技有限公司。实验使用的水均为超纯水。
1.2 包合物与物理共混的制备
环糊精包合物的制备方法主要有溶剂挥发法,冷冻干燥法,研磨法,喷雾干燥法和共沉淀法等。本工作通过调节水溶液的pH来制备CB和β-CD的包合物。将含有0.5 mmol CB的30 mL 0.1 mmol·L-1HCl溶液缓慢加入含有0.5 mmol β-CD的30 mL 0.1 mmol·L-1NaOH溶液,控制反应温度40 ℃,搅拌速度500 r·min-1。滴加完成后,维持温度和搅拌速度不变,继续反应4 h后过滤,对滤液进行透析处理,对透析后得到的清液进行冷冻干燥,得到CB和β-CD的包合物,即CB@β-CD complex。
等摩尔的CB和β-CD研磨至混合均匀,40 ℃真空干燥后,得到CB和β-CD的物理混合物,即CB/β-CD mix。
1.3 测试和表征
对CB进行紫外全波长扫描确认其最大吸收波长为285 nm,准确称量10 mg CB于2 L的容量瓶中,并用超纯水定容,超声使得完全溶解后即制得5 μg·mL-1的CB母液。分别取80、60、40、20 mL母液置于4个100 mL容量瓶中,并用超纯水定容,即分别得到4、3、2、1 μg·mL-1的CB溶液。使用超纯水作为空白对照,测量5个浓度的CB溶液在285 nm处的吸光度。绘制标准曲线时,CB溶液浓度为横坐标,在不同浓度下的吸光度作为纵坐标,使用Origin 2018软件拟合出CB的标准曲线。
采用Higuchi和Connors[9]的方法研究CB在β-CD存在下的相溶解度。在相同体积的不同浓度(0 ~ 20 mmol·L-1)的β-CD水溶液中加入过量的CB。溶液在室温下搅拌7 d以达到溶解平衡。分离上清液,通过0.22 μm PES滤器过滤。通过测定滤液在CB最大波长处的吸光度来分析CB的浓度。通过CB和β-CD的浓度关系得到相溶解度图。
观察CB、β-CD、CB/β-CD mix、CB@β-CD complex的紫外特征吸收峰。扫描范围为200~400 nm。以超纯水作为空白对照。
热重分析(TGA)分别取适量的CB、β-CD、CB/β-CD mix、CB@β-CD complex研磨、制样。N2环境,升温速率10 ℃·min-1,温度范围25~800 ℃。
对CB、β-CD、CB/β-CD mix以及CB@β-CD complex进行XRD分析。测试条件:扫描角度5~50°,扫描速度5°/min,电压:45 kV,电流:40 mA。
使用KBr压片法,测试了CB、β-CD、CB/β-CD mix以及CB@β-CD complex在4000~500 cm-1波数范围的红外吸收数据。
使用SEM观察CB、β-CD、CB/β-CD mix以及CB@β-CD complex的微观形貌。测试之前,需对样品喷金。
CB、β-CD以及CB@β-CD complex分别溶于DMSO-d6测定核磁氢谱(1H-NMR),以残余溶剂峰作为内标。
1.4 pH响应性释放实验
南方的梅雨时节,真菌大量繁殖。此时对植物做好系统的杀菌就显得尤为重要,使用的CB会大大增加。由于南方雨水的pH范围为5.0~6.5,因此选择pH=5.4来模仿雨水的pH。经过测量,选择pH=7.8模仿灌溉用水的pH。CB分子在低pH下能形成共振稳定的阳离子[8],这是CB分子在低pH下溶解度升高的原因。根据pH对CB溶解度提高的影响,研究了包合物在pH为5.4和7.8下的释放效果。使用紫外-可见吸收光谱确定释放量。
1.5 抑菌实验
测试了CB和CB@β-CD complex在两种pH环境下对早疫病的抑菌活性。使用两种PBS(0.1 M KH2PO4、K2HPO4按一定比例配制的pH为5.4和7.8的PBS)分别配制100 μg·mL-1的CB和CB@β-CD complex药液,然后将5 mL的药液与已融化的马铃薯葡萄糖琼脂培养基(15 mL,调整至相应的pH)在培养皿中快速混合。空白对照组加入相应pH值的PBS代替药物溶液。取PDA平板上培养72 h菌落外缘相同半径圆周上圆形菌饼(D=5 mm)当混合物凝固后,用接种针将5 mm的菌饼接入平板中心,每个培养皿中只放置一个菌饼。所有培养皿在28 ℃下倒置培养72 h,用十字交叉法测定菌丝生长直径(cm)。整个实验要求无菌操作。
2 结果与讨论
2.1 相溶解度研究
相溶解度图已广泛应用于研究在CDs存在下某些药物和农药的溶解度[10]。图1为CB在不同浓度β-CD存在下的相溶解度图。从图中可以看出,CB的溶解度随β-CD浓度的增加呈线性增加,属于Higuchi和Connors定义的AL型包合物,表明CB与β-CD之间形成1∶1的包合物。通过线性拟合并使用公式(1)计算得到表观稳定常数(Kf):
(1)
S0为不含 β-CD时CB的溶解度,slope为相溶解度图的斜率。
经过计算,Kf为7 048.19 M-1, K1∶1大多在50 ~ 2 000 M-1范围内。Kf值的大小说明了β-CD空腔与CB的结合强度,因此可以看出CB进入β-CD空腔内的趋势较强。

A: CB的标准曲线; B: CB在β-CD存在下的相溶解度图。图1 相溶解度图
2.2 包合物的表征和分析
通过测试CB, β-CD, CB/β-CD mix, CB@β-CD complex的紫外吸收光谱探究包合对CB的影响。如图2A所示,CB在超纯水中的最大吸收在285 nm,而在包合物的谱图中,最大吸收峰蓝移了5 nm。β-CD在200~400 nm范围内没有特征吸收;物理共混的最大吸收峰是285 nm,这和CB是一致的,表明物理共混并不能影响CB的紫外吸收,也并不能促使包合物形成[11]。与之形成对比的是,包合物的特征吸收发生了偏移,这种现象说明CB和β-CD之间存在相互作用,其改变了CB的共轭结构,影响了电子云的排布,最终使CB的紫外吸收产生了偏移,证明了包合物的形成。
采用TGA研究了包合物的热稳定性。与热重结果对应的DTG图如图2C所示,从这两个图中可以看出,β-CD的失重过程可分为两个阶段,第1阶段为69.3~99.6 ℃,这是由于空腔内水分子的损失;在320.3~341.8 ℃,大环的熔融和热分解使这一阶段的失重率达到了69.81%。CB失重了94.88%,此过程开始于213.2 ℃,结束于328.5 ℃。混合物有3个失重阶段,分别是失水阶段、CB热分解阶段以及β-CD热分解阶段,由此可以得出物理混合并没有提高CB的热分解温度。
在包合物的热重曲线中,有2个失重阶段,第1阶段是由包合物脱水导致的,第2阶段是包合物的热分解过程。可以看出,热分解温度为237 ℃,与CB原药相比,热分解温度升高,最终失重率达到95.2%。结果表明,包合物的热稳定性优于CB, TG曲线有力地证明了包合物的成功制备。

A:CB,β-CD,CB/β-CD mix,CB@β-CD complex的;紫外吸收光谱;B:热重图; C:微商热重图;D:粉末X射线衍射;E:红外光谱。图2 CB,β-CD,CB/β-CD mix,CB@β-CD complex的表征和分析图
使用XRD证明包合物的形成[12]。CB、β-CD、混合物、包合物的XRD图如图2D所示。CB和β-CD均有一定的结晶度,CB的尖峰为10.7、18.6、25.9和28.2°(2θ),晶态较好;β-CD的特征衍射峰为10.5、12.4和22.8°(2θ)。混合物也具有结晶度,特征衍射峰10.7、12.4、18.6、22.8、22.9、25.9、28.2°(2θ)依然存在,其并没有改变CB本来的晶态,简单的物理共混并不能使两者产生相互作用[13]。包合物的晶态性质非常不明显,CB的强衍射峰18.6、25.9、28.2°在包合物中消失,表明CB进入β-CD空腔中形成了包合物,调节水溶液pH法制备这一包合物的可行性。
FT-IR可以确定包合物结构中客体分子的存在以及环糊精与客体分子之间是否形成包合物。包合物、两种单体以及混合物的红外光谱如图2E所示。在CB的谱图中,在3 056、1 637、1 593、739 cm-1的吸收峰,对应于苯环上的C-H伸缩振动,C=C伸缩振动,C-H弯曲振动;1 712 cm-1是C=O的伸缩振动。β-CD的特征峰主要有3 395、2 924、1 639 cm-1,分别是 -OH,C-H的伸缩振动和H-O-H的弯曲振动。在混合物的红外光谱中同时出现了CB和 β-CD的尖强特征峰,整体可以看作是两种化合物的特征吸收峰的简单叠加。进一步证明简单的物理混合并不能使两者发生主客体相互作用。形成包合物之后,客体分子的吸收峰发生偏移、消失或减弱,例如1 712 cm-1处的吸收峰明显减弱,1 637、1 593、739 cm-1处的吸收峰偏移到1 629、1 596、730 cm-1处。这些变化都可以说明β-CD成功包合CB。
2.3 微观形貌
包合物形成后,进入β-CD空腔的CB分子的结晶度会大大降低甚至完全消失,同样地,β-CD分子的晶态和空间结构也发生了变化,因此使用SEM可以观察到形貌特征的变化[14]。如图3A所示,CB本身呈不规则片状,尺寸分布非常分散。β-CD的形貌比CB的更加规则,并且可以观察到晶体的厚度,整体为较规整的颗粒(图3B)。在图3C中,混合物有粒状和片状两种形状,颗粒和片间的界线很清晰,结合形态和尺寸,这是β-CD和CB的形态特征。而当包合物形成后,颗粒和薄片间的界线消失,出现了小晶体颗粒堆积和粘附形成的大块形貌。包合物的微观形态特征与主客体分子以及混合物完全不同,这是由于CB和β-CD之间的主客体相互作用。

A:CB;B:β-CD;C:CB/β-CD mix;D:CB@β-CD complex的扫描电镜图。图3 扫描电镜图
2.4 核磁氢谱
核磁氢谱是证明包合物形成的有力手段[15]。CB、β-CD和包合物的核磁氢谱如图4所示,可以看到每种化学环境下的氢原子的数量。表1列出了包合前后的化学位移以及变化。化学位移的改变小于0.15 ppm,因为在包合物中主客体分子间没有形成实质的化学键,两者间的作用力主要包括范德华力、氢键和疏水作用力等弱相互作用。因此,与相应的客体分子和β-CD相比,形成包合物之后核磁氢谱化学位移改变较小(在核磁氢谱中一般小于0.30 ppm)。

图4 CB,β-CD,CB@β-CD complex在DMSO-d6中的核磁氢谱
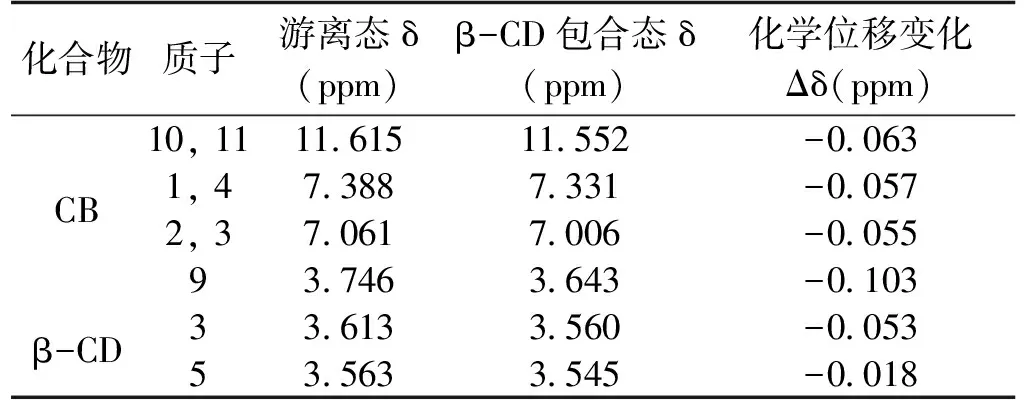
表1 CB,β-CD包合前后的核磁氢谱(在295 K,DMSO-d6中)化学位移及变化
包合物在7~7.5 ppm范围内的多重峰属于CB芳香区的质子(H-1, 4;H-2, 3),初步证实了CB存在于包合物中。CB的质子H-1, 4;H-2, 3以及活泼氢N-H (H-10, 11)在包合物的核磁氢谱中分别位移了-0.057,-0.055和-0.063 ppm。化学位移向高场移动,表明苯环上的电子密度增加,CB的微环境发生了变化,这证明了包合物的形成[16]。β-CD的质子H-3, H-5的化学位移在包合物中分别偏移了0.053和0.018 ppm,由于这两个位置的质子都位于β-CD的空腔内,H-3靠近空腔的宽口,H-5靠近窄口,所以CB是从宽口进入β-CD的空腔内。
对包合物谱图中的峰积分,7.006 ppm处的峰积分值为2,对应苯环上H-1, 4的两个质子,因此包合物中含有一个CB分子,7.331 ppm的峰也可以得出相同的结论。β-CD的H-1质子的峰在4.825 ppm附近,积分值为7[13]。由于一个β-CD分子含有7个葡萄糖单元,因此含有7个H-1质子,即包合物中含有一个β-CD分子。结果表明,包合物中CB和 β-CD的摩尔比为1∶1,这与相溶解度图的分析是一致的。核磁氢谱不仅有力地证明了包合物的形成,并且明确了包合物中主客体分子结合比。
2.5 pH响应性释放
图5A为包合物在pH 5.4和7.8的释放曲线,可以看出,经过0.5 h,pH=7.8的溶液中出现了少量的CB,但体系中检测到的CB浓度并没有随着时间的推移而增加。这可能是由于有部分未包合的CB分子残留在包合物中,弱碱性的pH并不会破坏CB和 β-CD之间的弱相互作用,被包合的CB分子无法从 β-CD的空腔中释放出来,最终pH=7.8的体系中只有极少量的CB。当pH=5.4时,溶液中CB的浓度随着时间的延长而显著增加,包合物表现出pH响应性的特性。这可能是由于在酸性条件下,一些氢离子会进入β-CD的非极性空腔使CB分子质子化,CB由非极性状态变为极性状态,破坏了CB与β-CD的主客体相互作用,使CB从β-CD的空腔中释放出来。因此,随着时间的延长释放出来的CB逐渐增多,溶液中CB的浓度逐渐增加。在36 h后,溶液中CB浓度基本稳定,累积释放率达到71.06%,该包合物具有pH响应性释放的特性。

A:包合物在pH 为5.4和7.8的释放曲线;B:CB和包合物在pH 为5.4和7.8的抑菌效果;C:菌落在pH 7.8时(Ⅰ)加入PBS,(Ⅱ)加入CB,(Ⅲ)加入包合物的生长情况以及菌落在pH 5.4时(Ⅳ)加入PBS,(Ⅴ)加入CB,(Ⅵ)加入包合物的生长情况。图5 药效对比图
2.6 抑菌实验
图5B是在pH为7.8和5.4时,CB和包合物对菌落生长的抑制情况。pH=5.4时,正常生长菌落的直径为2.95 cm(图5C Ⅳ),pH=7.8时,正常生长菌落的直径为2.85 cm(图5C Ⅰ),出现这种差异是因为早疫病菌生长的最适pH为5.0~7.0。在pH为5.4和7.8的培养基中加入CB,菌落的生长直径分别为2.45 cm(图5C Ⅴ)和2.40 cm(图5C Ⅱ)。在弱酸性条件下,部分CB分子质子化,增加了CB在溶液中的溶解度。早疫病菌在环境pH和CB的双重影响下,生长情况略有差异。在pH为5.4和7.8的培养基中加入包合物,菌落生长直径分别为2.00 cm(图5C Ⅵ)和2.45 cm(图5C Ⅲ)。在酸性环境中,包合物有更好的抑菌效果,说明其具有pH响应性。抑菌实验平行进行3组,同一条件下菌落生长情况的差异体现在图5B的误差棒上,可以看到的是,平行实验间的差异是非常小的,并不影响整体的规律性。抑菌实验的结果与pH响应性释放实验的结果相符。尤为重要的是,pH为5.4时,包合物的抑菌效果优于CB。说明在特定的环境刺激下,使用包合物可以明显减少CB的投入,提高CB的生物利用率。综上所述,包合物适合在南方的梅雨时节使用,预防植物病害。
3 结论
这项研究使用调节水溶液pH法制备了主客体比为1∶1的CB和β-CD包合物。该方法充分利用了客体分子的溶解特性,制备过程不使用有机溶剂,比传统的制备环糊精包合物的方法更符合农业绿色发展方向。包合物具有pH响应性释放的特性,尤其适合用于南方的梅雨季节。在弱酸性条件下,相同质量的包合物的抑菌效果优于CB原药,大大提高了CB的生物利用率。

