模拟持续干旱胁迫对4株沙漠小球藻生长的影响及比较研究
李红,谭君,牟云,高剑峰*
(1 石河子大学药学院/新疆植物药资源利用教育部重点实验室,新疆 石河子 832003;2 石河子大学生命科学学院,新疆 石河子 832003)
小球藻是一种真核、单细胞绿色微藻,广泛分布于淡水、土壤和荒漠中[1]。它是一种光合自养生物,已广泛用于与微藻能源生产相关的研究[1-2]。国内外学者对小球藻的研究多集中于淡水小球藻,而关于沙漠藻类的研究很有限。沙漠小球藻生长在极其干旱的环境中,酷热时最高气温67.2 ℃,昼夜温差40 ℃以上,蒸发量大,冬季寒冷,降水量少[3]。Lewis等[4]发现,沙漠绿藻从水生绿藻至少独立进化了5次。因此,沙漠小球藻适应了极其恶劣的干旱环境,使其成为研究单细胞水平抗逆分子生物学的绝佳材料[5]。
近些年来,对沙漠微藻的研究主要集中在微生物结皮的藻类组成、结皮形成的特征和功能[4,6],以及沙漠微藻的分类、培养方法、油脂富集上[6-8]。对干旱胁迫下微藻包括小球藻生长特性的研究较少[9-10]。聚乙二醇(PEG)具有较高的亲水性,被广泛用作微藻水分胁迫剂模拟干旱环境进行研究[5,11]。丁振等[11]研究发现聚乙二醇模拟干旱胁迫会抑制发状念珠藻的生长。牟云等[5]研究发现,PEG-6000抑制小球藻生物量的增长和可溶性蛋白的合成。
为了弄清楚干旱胁迫与小球藻生长特性之间的关系,本研究以新疆沙漠来源小球藻TLD2A1、TLD6B、GTD7c-2、GTD8A1为实验材料,通过比较4株小球藻在模拟干旱胁迫条件下,其OD680值、致死率、生物量、比生长速率受到的影响,筛选出了对干旱胁迫耐受性最优的沙漠小球藻菌株,并优化了菌株的持续干旱胁迫条件。本研究将为后期沙漠小球藻耐干旱胁迫的生理学和分子生物学研究提供材料和基础,也为小球藻耐旱藻种的选育应用,及其生态功能的研究提供参考依据。
1 材料与方法
1.1 实验材料
1.1.1 藻种来源
供试TLD2A1、TLD6B、GTD7c-2、GTD8A1的4株沙漠藻种由本实验室从新疆古尔班通古特、塔克拉玛干沙漠收集,从沙样中分离、纯化并鉴定为小球藻(Chlorellasp.)[6,12-13]。
1.1.2 培养基
小球藻的培养采用BBM培养基[14]。
1.2 实验方法
1.2.1 小球藻干旱胁迫处理
干旱胁迫处理:将初始OD680≈0.1,处于对数生长期的4株小球藻藻种按照20%的等体积比例接种量接种于300 mL BBM培养基中,并添加PEG-6000使培养基中PEG-6000的浓度分别保持在0.1、0.2、0.3、0.4、0.5 g·mL-1,以模拟不同水平的干旱胁迫处理,并最终补充培养基至500 mL,同时以不添加PEG-6000的小球藻培养液为对照,所有实验每个重复3次。接种后放置于光照强度72 μmol·m-2·s-1,光暗周期12 h/12 h,温度23 ℃的光照箱中进行一批次培养,每天定时摇匀3次,防止其贴壁生长,培养周期为24 d。分别在第0、6、12、18、24 d的同一时间测定每组藻细胞OD680和生物量等指标。
1.2.2 测定指标及方法
细胞密度用光密度表示,每隔48 h取藻液样品3 mL用分光光度计测量吸光度(OD680),绘制不同培养条件下4株小球藻的生长曲线[7]。微藻致死率计算参照刘婷婷等[15]的方法,致死率=[(对照组测定值OD值-实验组测定OD值)/对照组测定OD值]×100%。每隔6 d取藻液样品50 mL,8 000 r·min-1离心15 min,去离子水涡旋洗涤藻体3遍(每次5~10 s),离心弃上清,于80 ℃下烘干24 h,测干重得生物量[16]。比生长速率计算使用Wang等[17]的方法。
(1)
式中μ为比生长速率(mg·L-1·d-1),N0为前一次取样时的生物量(mg·L-1),N1为本次取样时的生物量(mg·L-1),t0和t1是对应的培养时间,此处t1-t0=6(d)。
1.3 数据处理与分析
实验数据采用SPSS 20.0和Excle进行统计分析,实验数据据采用“平均值±标准差”表示,两组间采用单因素方差分析确定组间差距,并进行LSD 检验,P<0.05为差异具有统计学意义。图采用SigmaPlot 12.5绘制。
2 结果与分析
2.1 模拟持续干旱胁迫对4株沙漠小球藻生长的影响及比较
正常培养条件下,4株沙漠小球藻在第6 d进入对数生长期,在第18 d前迅速增加,在第24 d时明显减慢,进入稳定期,在第30 d左右出现衰亡(图1)。同等培养条件下,小球藻TLD2A1的OD680值显著低于其它3株(P<0.05),其余3株小球藻正常状态下的生长曲线相似,小球藻TLD6B、GTD8A1的OD680值大于其他2株藻,且稳定。基于4株小球藻的生长曲线,后续胁迫实验选择测定生长的取样时间点为第0、6、12、18、24 d。

*: P<0.05。图1 4株小球藻正常状态下生长曲线
模拟持续干旱胁迫下,与对照组相比4株小球藻OD680值随PEG-6000浓度的增大而显著减小(图2,P<0.05),致死率随着PEG-6000浓度的增大而显著增大(图3,P<0.05)。干旱胁迫后,小球藻TLD2A1的OD680值明显小于其他3株藻;PEG-6000浓度为0.1 g·mL-1持续胁迫第12 d时,小球藻GTD7c-2的OD680值差异不显著(P<0.05),但PEG-6000浓度为0.2 g·mL-1时,OD680值剧减到0.14~0.24;小球藻TLD6B的OD680值略大于GTD8A1(图2)。当PEG-6000的浓度大于等于0.3 g·mL-1时,4株小球藻在第24 d致死率达到61.2%~81.2%,小球藻细胞数量基本不增长,说明此干旱胁迫严重抑制了小球藻的生长。
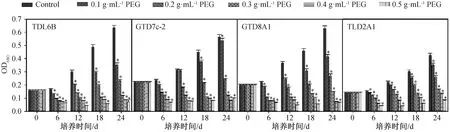
*: P<0.05。图2 模拟持续干旱胁迫对4株小球藻生长的影响(OD680)
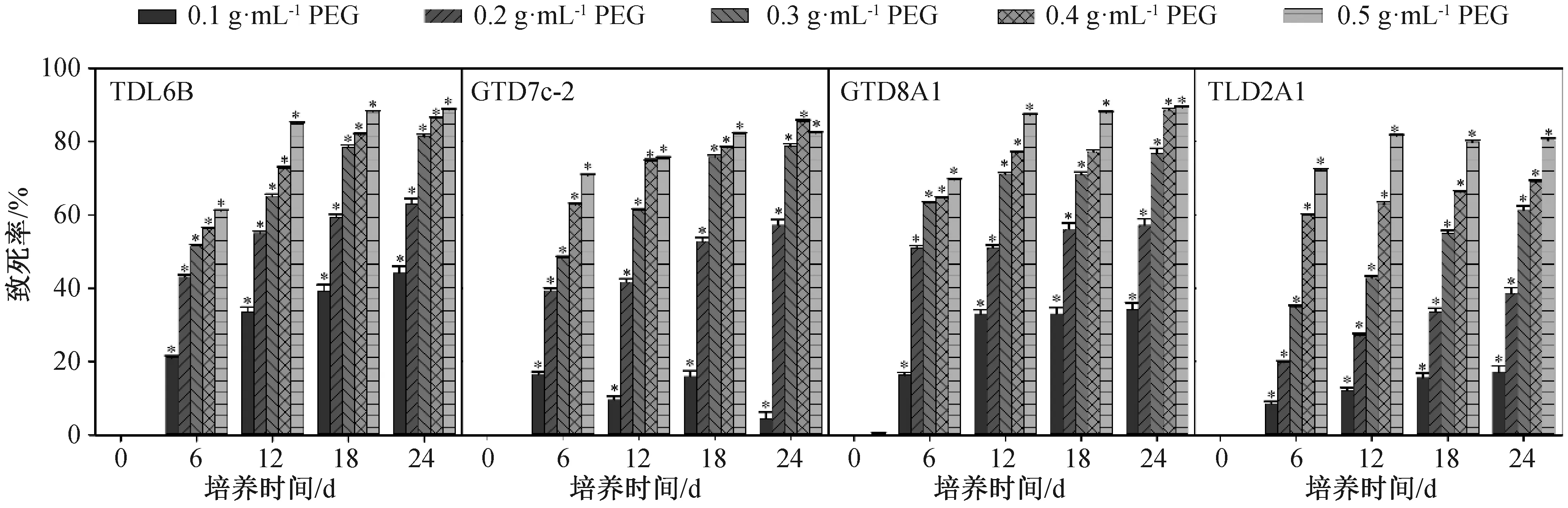
*: P<0.05。图3 模拟持续干旱胁迫对4株小球藻的致死曲线
模拟持续干旱胁迫下,与对照组相比4株小球藻生物量随PEG-6000浓度的增大而显著减小(P<0.05),随胁迫时间的延长而逐渐增大(图4);整体上,比生长速率随着PEG-6000浓度的增大而显著减小(P<0.05),随着胁迫时间的延长先增大后减小(图5)。干旱胁迫后,小球藻TLD2A1的生物量明显小于其他3株藻;其中小球藻GTD7c-2的生物量略小于TLD6B、GTD8A1,但当PEG-6000浓度为0.2 g·mL-1时,其生物量剧减到0.15~0.26;小球藻TLD6B、GTD8A1的生物量相近(图4)。当PEG-6000的浓度大于等于0.3 g·mL-1时,4株小球藻在前6 d的比生长速率小于0,但此后比生长速率均恢复正值,说明此干旱胁迫初期小球藻的生长受到了严重的抑制。此外,发现模拟持续干旱胁迫下,与对照组相比4株小球藻生物量的变化与OD680值的变化具有相似的趋势,进一步地说明干旱胁迫抑制了小球藻的生长。

*: P<0.05。图4 持续干旱胁迫对4株小球藻生物量的影响

*: P<0.05。图5 持续干旱胁迫对4株小球藻比生长速率的影响
基于图2—4,通过比较胁迫条件与正常培养条件下4株沙漠小球藻生长的情况,模拟干旱胁迫下4株小球藻生长都受到了不同程度的抑制。
总体来说,菌株GTD7c-2干旱胁迫后生长不稳定;TLD2A1耐干旱胁迫,但生物量、比生长速率最小;小球藻TLD6B生长速率最大,生物量最大,显示了极好的干旱胁迫耐受性,且生长稳定。因此,选择小球藻菌株TLD6B作为进一步研究干旱胁迫下沙漠小球藻生理特性的藻株。
2.2 小球藻TLD6B模拟持续干旱胁迫梯度的确定
根据模拟干旱胁迫下小球藻TLD6B生长的状况,从菌株资源开发利用的角度,确定干旱胁迫下小球藻TLD6B培养液中PEG-6000浓度范围为:0.0~0.3 g·mL-1。进一步精细化确定模拟胁迫的梯度,PEG-6000浓度分别为0.0、0.05、0.1、0.2、0.3 g·mL-1,小球藻菌株TLD6B的生长速率逐渐下降,但在持续干旱胁迫第24 d OD680值仍然达到0.125,致死率在9.58%~81.20%之间。初步确定小球藻TLD6B的耐旱范围为0.0~0.3 g·mL-1的PEG-6000(图6)。

图6 持续干旱胁迫下小球藻TLD6B OD680测量值和致死率的变化
OD680值、致死率两项指标,结果显示,小球藻菌株TLD6B干旱胁迫耐受性是4株菌株中最优的。轻度干旱胁迫(PEG-6000浓度小于等于0.05 g·mL-1)下,致死率小于19.24%;中度干旱胁迫(PEG-6000浓度为0.1~0.2 g·mL-1)下,致死率在20.96%~62.9%之间;重度干旱胁迫(PEG-6000浓度为0.3 g·mL-1)下,致死率在51.5%~81.2%之间。
3 讨论
水分是影响微藻生理活性的重要因素,适量的水分是维持微藻生长和生理代谢所必需的物质[9]。沙漠小球藻长年生长在持续干旱、高盐、水分流失迅速的沙漠环境,其生长和繁殖主要依赖降雨和地表水[18]。这样的缺水环境使它具有很强的抗旱适应性[5]。研究表明[19],严重干旱时会引起细胞代谢紊乱等,最终抑制藻体的生长和发育。本研究显示,在不同的PEG-6000浓度下,4株沙漠小球藻的OD680值、生物量、比生长速率等生长指标随着干旱胁迫水平的增大而显著下降,致死率随着干旱胁迫水平的增大而显著增大。周娟等[9]研究发现干旱胁迫会抑制发状念珠藻生长,牟云等[5]研究发现干旱胁迫会抑制沙漠小球藻生长,与本研究一致。
干旱胁迫是限制藻类生长和产量的主要环境因子之一[5,11,19],不同微藻对干旱胁迫的耐受性差异很大,这取决于藻种、发育阶段以及胁迫的强度和持续时间,最终导致生长抑制和藻体受到损伤[19-20]。周娟等[9]研究发现在不同的PEG-6000干旱胁迫下,在培养1~2 d内细胞生长明显下降,从第3 d开始,细胞生长速率开始增加,10% PEG-6000干旱胁迫对发状念珠藻细胞损伤最严重。本研究显示,干旱胁迫下4株小球藻的OD680值、生物量、比生长速率都随胁迫水平的增大而显著下降,模拟持续干旱4株小球藻比生长速率在培养前6 d明显下降,从第6 d开始比生长速率开始增大,OD680值、致死率、生物量随胁迫时间的延长而逐渐增大,这与周娟等[9]研究一致,说明持续干旱胁迫初期4株小球藻的生长受到了严重抑制,然后很快恢复增长,也说明4株小球藻具有适应持续干旱胁迫的能力。
牟云等[5]研究发现沙漠小球藻TLD6B在PEG-6000添加量为30%时生长受到严重抑制,本研究的4株沙漠小球藻都可以耐受0.3 g·mL-1PEG-6000的干旱胁迫,只是每株藻的耐受阈值不同,菌株TLD6B、GTD8A1、GTD7c-2耐受0.3 g·mL-1PEG-6000的干旱胁迫第24 d时,生长受到严重抑制[21],菌株TLD2A1甚至可以耐受0.5 g·mL-1PEG-6000的干旱胁迫。沙漠小球藻生长在干旱、高盐的环境下,容易使细胞失水,造成渗透胁迫,进而抑制细胞的生长[8,22]。而不同藻株受到的影响不同,进而导致不同藻株生物量和质量总体下降不同[19-20]。具体的沙漠小球藻胞内生理特性变化有待于进一步研究。
综上所述,模拟干旱胁迫下4株沙漠小球藻的生长都受到了不同程度的抑制,沙漠小球藻TLD6B对干旱胁迫的耐受性最优,它可以耐受0.3 g·mL-1PEG-6000的干旱胁迫。本研究将为后期沙漠小球藻耐干旱胁迫的生理学和分子生物学研究提供材料和基础,也为小球藻耐旱藻种的选育提供参考依据。

