膜联蛋白A1的N末端肽Ac2-26对高糖刺激的小鼠巨噬细胞极化的影响*
夏崇建,黄俊杰,张煜,卓嘉英,吴娟娟,陈刚,范琰琰
(温州医科大学基础医学院,浙江 温州 325035)
糖尿病是以高血糖为特征的代谢性疾病,在中国成人中发病率高,可引起多种并发症[1-3]。其中,糖尿病患者的伤口难以愈合已成为医学界研究的重点问题之一[3]。伤口内浸润的巨噬细胞是介导伤口炎症期向增殖期过渡的关键细胞,在炎症期它们极化为M1表型介导炎症反应,在增殖期它们极化为M2表型促进伤口修复[4]。在糖尿病伤口愈合期间,巨噬细胞呈现从M1型向M2型的转换障碍,继而引起伤口内持续的炎症反应及修复迟滞[3-4]。
膜联蛋白超家族在结构上均具有保守的中心结构域和承担独特功能的N端结构域,膜联蛋白A1(annexin A1,ANXA1)属于该家族的一员,被体内多种细胞表达,其与甲酰肽受体2(formyl peptide receptor 2,FPR2)结合可发挥抗炎、保护神经元和促进肠黏膜修复等作用[5-8]。ANXA1裂解后可产生N末端肽Ac2-26,Ac2-26具有ANXA1的类似功能[5-6]。我们的前期研究提示,对糖尿病小鼠伤口应用Ac2-26可抑制伤口内的炎症反应,并上调M2型巨噬细胞数量,但其作用机制尚不清楚[9]。在本研究中,我们拟体外培养小鼠骨髓来源的巨噬细胞(bone marrow-derived macrophage,BMDM)并予以高糖刺激,在此基础上探讨Ac2-26对高糖刺激的小鼠巨噬细胞极化的影响及其机制。
材料和方法
1 实验材料
清洁级C57BL/6雄性小鼠36只,6~8周龄,20~25 g,购自南京大学生物医药研究院,许可证号为SCXK(苏)2018-0008。DMEM培养液、D-葡萄糖和胎牛血清(fetal bovine serum,FBS)购自Thermo Fisher;巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)购自Merck;Ac2-26和FPR2拮抗剂WRW4购自Tocris Bioscience;磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)抑制剂wortmannin购自碧云天生物技术有限公司;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)、IL-10和 转化 生 长 因 子β1(transforming growth factor-β1,TGF-β1)ELISA试剂盒购自R&D;抗F4/80抗体、抗ANXA1抗体、抗诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗 体 及 抗 甘 露 糖 受 体(mannose receptor)/CD206抗体购自Abcam;抗PI3K及磷酸化PI3K(p-PI3K)抗体、抗蛋白激酶B(protein kinase B,PKB/AKT)及磷酸化AKT(p-AKT)抗体和β-actin抗体购自Cell Signaling Technology;辣根过氧化物酶(horseradish peroxidase,HRP)标记的Ⅱ抗购自Biorbyt。
2 主要方法
2.1 小鼠BMDM的提取与培养处死小鼠后,将其放置在75%的乙醇中消毒3 min。然后分离出小鼠的股骨和胫骨,置入含75%乙醇的培养皿中,转移至超净工作台。在无菌环境下,使用预冷的PBS洗去骨表面的乙醇,并剔除骨周围的软组织,将股骨和胫骨分开,再将骨置入PBS中清洗3次。然后剪掉骨的两端,用含2% FBS的PBS将骨髓冲出,离心、弃上清,用含M-CSF(10µg/L)、D-葡萄糖(5.5 mmol/L)、10% FBS及1%青链霉素的DMEM培养液重悬骨髓细胞,放入37℃、5% CO2环境的孵箱中培养,第3天和第5天更换新鲜的培养液,第7天收集贴壁的细胞。使用F4/80抗体检测巨噬细胞纯度,每次获得的巨噬细胞纯度均在90%以上[10-11]。
2.2 高糖刺激将BMDM接种,培养过夜让其贴壁后换液,加入含30 mmol/L葡萄糖的DMEM培养液[12],分别在高糖刺激后的6、12和24 h收集细胞。另外,直接收集培养过夜的贴壁细胞作为高糖刺激0 h的细胞。
2.3 干预实验将BMDM接种、培养过夜让其贴壁,然后对细胞进行分组处理:(1)对照(control)组:用含5.5 mmol/L葡萄糖的DMEM培养液进行培养;(2)高糖(high glucose,HG)组:用含30 mmol/L葡萄糖的DMEM培养液进行培养;(3)高糖+Ac2-26(HG+Ac2-26)组:在含30 mmol/L葡萄糖的DMEM培养液中加入Ac2-26(1µmol/L或5µmol/L)[13];(4)高糖+Ac2-26+FPR2拮抗剂(WRW4)组:在含30 mmol/L葡萄糖的DMEM培养液中加入WRW4(10µmol/L)[13],孵育30 min后再加入Ac2-26(5µmol/L);(5)高糖+Ac2-26+PI3K抑制剂(wortmannin)组:在含30 mmol/L葡萄糖的DMEM培养液中加入Ac2-26(5µmol/L)和wortmannin(1µmol/L)[14-15]。各组在干预24 h后收集细胞及其培养液,进行后续检测。
2.4 ELISA检测将细胞培养液离心、取上清,使用ELISA试剂盒检测上清液中TNF-α、IL-6、IL-10和TGF-β1的含量。检测步骤按照试剂盒制造商的说明书进行。
2.5 Western blot检测用含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液提取细胞总蛋白,测定蛋白浓度、配平。在每个蛋白样品中加入上样缓冲液,金属浴加热5 min,使蛋白充分变性。将蛋白样品上样、电泳、转至PVDF膜上,然后将膜转移至5%脱脂牛奶中封闭2 h,再使用相应的Ⅰ抗孵育过夜。TBST洗膜3次,HRP标记的Ⅱ抗室温孵育2 h。洗膜3次后,使用ECL试剂盒发光显影。曝光成像后,用ImageJ软件分析各显影条带。
3 统计学处理
用SPSS 26.0统计软件分析数据。数据采用均数±标准误(mean±SEM)表示,多组间比较采用单因素方差分析,事后比较采用LSD法。以P<0.05为差异有统计学意义。
结 果
1 不同时间的高糖刺激对小鼠BMDM的iNOS、CD206及ANXA1表达的影响
实验结果表明,与高糖刺激0 h相比,iNOS(M1型极化标志物)的表达在高糖刺激12 h后开始显著升高(P<0.05),于刺激24 h后进一步升高(P<0.01);高糖刺激24 h后也显著下调了CD206(M2型极化标志物)的表达(P<0.05);高糖刺激6、12和24 h没有显著影响小鼠BMDM的ANXA1表达,见图1。后续的干预实验选取24 h为干预时点。
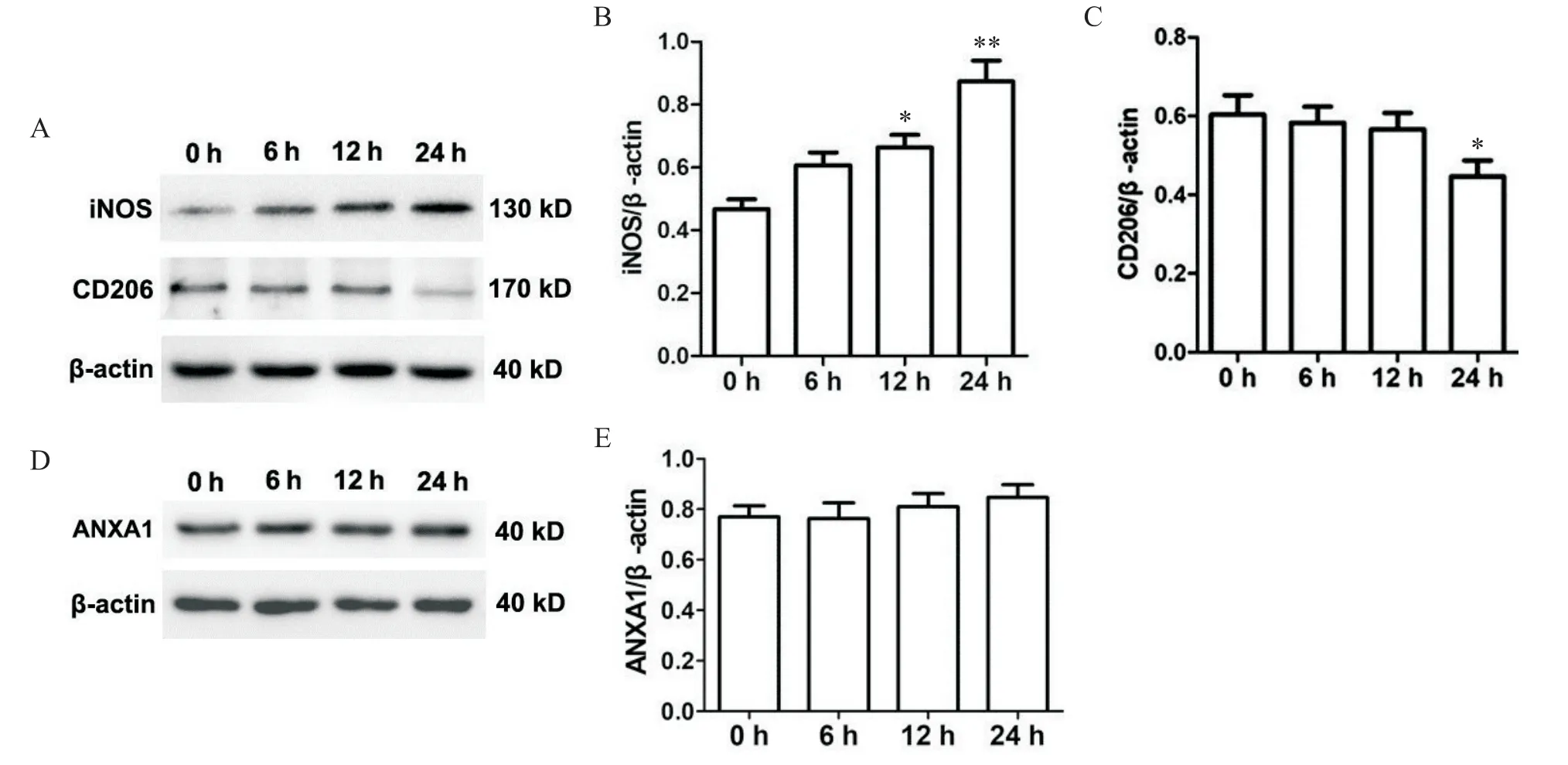
Figure 1.The time-dependent effects of high glucose(30 mmol/L)on the expression of iNOS,CD206,and ANXA1 in BMDM.A and D:the protein expression of iNOS,CD206,and ANXA1 in BMDM was detected by Western blot;B,C and E:the protein levels of iNOS,CD206,and ANXA1 were evaluated by normalizing againstβ-actin.Mean±SEM.n=3.*P<0.05,**P<0.01 vs 0 h group.图1 不同时间的高糖刺激对iNOS,CD206及ANXA1表达的影响
2 Ac2-26对高糖环境下小鼠BMDM极化的干预效应及WRW4对Ac2-26作用的影响
Western blot检测结果显示,与正常糖浓度的对照组相比,高糖组的iNOS表达显著增加(P<0.01),CD206的表达显著减少(P<0.05);与高糖组相比,Ac2-26(1µmol/L或5µmol/L)能够显著抑制iNOS的表 达(P<0.05,P<0.01),促 进CD206的表 达(P<0.01);与高糖+Ac2-26(5µmol/L)组相比,WRW4(10µmol/L)抑制了Ac2-26(5µmol/L)的干预效应,显著上调了iNOS的表达(P<0.05),下调了CD206的表达(P<0.01),见图2。
ELISA检测结果显示,与对照组相比,高糖组BMDM产生的TNF-α和IL-6显著增多(P<0.01),而IL-10的分泌显著减少(P<0.01);与高糖组相比,Ac2-26(1µmol/L或5µmol/L)可以显著下调TNF-α和IL-6的产生(P<0.05,P<0.01),Ac2-26(5µmol/L)可以显著上调IL-10的产生(P<0.01);与高糖+Ac2-26(5µmol/L)组相比,WRW4(10µmol/L)显著抑制了Ac2-26(5µmol/L)对TNF-α、IL-6和IL-10分泌的调节作用(P<0.05,P<0.01);见图3A~3C。TGF-β1的分泌在各干预组之间无显著差异,见图3D。

Figure 2.The effects of high glucose,Ac2-26,and WRW4 on the expression of iNOS and CD206 in BMDM.A:the protein expression of iNOS and CD206 in BMDM was detected by Western blot;B and C:the protein levels of iNOS and CD206 were evaluated by normalizing againstβ-actin.Mean±SEM.n=3.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs HG group;△P<0.05,△△P<0.01 vs HG+Ac2-26 group.图2 高糖、Ac2-26及WRW4对iNOS和CD206表达的影响
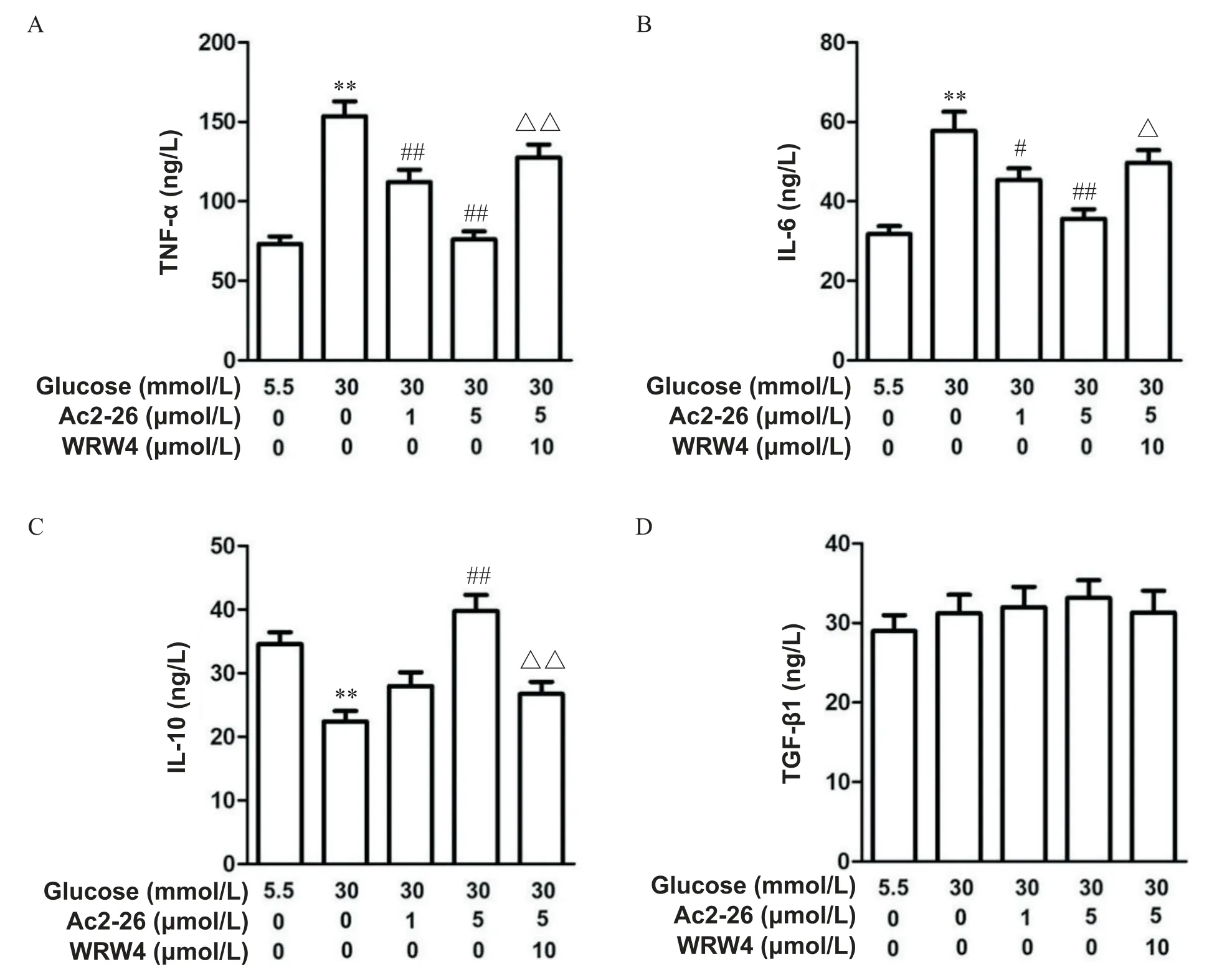
Figure 3.The effects of high glucose,Ac2-26,and WRW4 on the secretion of cytokines in BMDM.A to D:the concentrations of TNF-α,IL-6,IL-10,and TGF-β1 in the culture supernatants of BMDM were measured by ELISA,respectively.Mean±SEM.n=3.**P<0.01 vs control group;#P<0.05,##P<0.01 vs HG group;△P<0.05,△△P<0.01 vs HG+Ac2-26 group.图3 高糖、Ac2-26及WRW4对BMDM细胞因子分泌的影响
3 高糖、Ac2-26及WRW4对细胞内PI3K/AKT信号通路的影响
为了探讨高糖和Ac2-26影响巨噬细胞极化的机制,我们检测了PI3K/AKT信号通路在小鼠BMDM中的激活情况。检测结果显示,与对照组相比,高糖组PI3K和AKT的磷酸化相对水平显著降低(P<0.05);与高糖组相比,Ac2-26(1µmol/L或5µmol/L)可以显著 上 调PI3K和AKT的 磷 酸 化 水 平(P<0.05,P<0.01),促进PI3K/AKT的激活;与高糖+Ac2-26(5µmol/L)组相比,WRW4(10µmol/L)抑制了Ac2-26(5µmol/L)的干预效应,显著下调了PI3K和AKT的磷酸化水平(P<0.05或P<0.01),见图4。

Figure 4.The effects of high glucose,Ac2-26,and WRW4 on PI3K/AKT signaling pathway in BMDM.A:Western blot analysis of PI3K,p-PI3K,AKT,and p-AKT in BMDM;B:relative level of p-PI3K/PI3K;C:relative level of p-Akt/Akt.Mean±SEM.n=3.*P<0.05 vs control group;#P<0.05,##P<0.01 vs HG group;△P<0.05,△△P<0.01 vs HG+Ac2-26 group.图4 高糖、Ac2-26及WRW4对细胞内PI3K/AKT信号通路的影响
4 PI3K抑制剂对高糖环境下Ac2-26调节小鼠BMDM极化的影响
为了进一步探讨Ac2-26是否通过PI3K/Akt信号通路调节高糖刺激的小鼠巨噬细胞极化,高糖刺激的小鼠BMDM被予以Ac2-26干预或Ac2-26+PI3K抑制剂(wortmannin)的干预,然后检测巨噬细胞极化标志物的表达情况。检测结果显示,与高糖+Ac2-26组相比,应用PI3K抑制剂(wortmannin)显著抑制了Ac2-26对BMDM极化标志物表达的影响,上调了iNOS的 表达(P<0.05),下 调了CD206的 表 达(P<0.01),见图5。

Figure 5.PI3K inhibitor(wortmannin)inhibited the effects of Ac2-26 on BMDM polarization in high glucose environment.A:the protein expression of iNOS and CD206 in BMDM was detected by Western blot;B and C:the protein levels of iNOS and CD206 were evaluated by normalizing againstβ-actin.Mean±SEM.n=5.*P<0.05,**P<0.01 vs control group;##P<0.01 vs HG group;△P<0.05,△△P<0.01 vs HG+Ac2-26 group.图5 PI3K抑制剂对高糖环境下Ac2-26调节小鼠BMDM极化的影响
讨 论
巨噬细胞是机体内重要的免疫细胞,具有吞噬、杀菌、呈递抗原、促炎、抗炎及促修复等多种功能。巨噬细胞的功能多样性可能与其表型的可塑性有关,在不同微环境的刺激下,巨噬细胞可以向M1或M2表型极化[16-17]。M1型巨噬细胞高表达iNOS和促炎因子,参与促炎反应及病菌清除;而M2型巨噬细胞高表达CD206及精氨酸酶1(arginase-1,Arg-1)等,可以分泌抗炎因子或生长因子,抑制炎性反应,促进损伤修复[3-4,16-17]。
糖尿病伴有免疫反应异常,可引起持续的炎症损害,继而促进糖尿病及其并发症的发展[18-22]。高血糖诱导单核巨噬细胞向促炎的M1表型极化,可能与上述的病理生理进程有关[21-23]。我们的前期研究提示,应用Ac2-26可以抑制小鼠糖尿病伤口的炎症反应,并上调伤口内M2型巨噬细胞的数量,促进伤口愈合[9]。Ac2-26是分子量较小的多肽,合成的成本较低,明确其作用机制,再转化于临床治疗,将有较好的开发利用前景。
本研究显示,高糖刺激可以上调小鼠BMDM的iNOS表达及促炎因子(TNF-α和IL-6)产生,下调CD206表达和抗炎因子(IL-10)产生。使用Ac2-26对高糖刺激的小鼠BMDM进行干预,可抑制高糖的促炎作用和iNOS表达,并上调BMDM的CD206表达和IL-10产生。本研究结果提示,高糖刺激可以诱导小鼠BMDM向促炎的M1型极化,而Ac2-26可以抑制高糖的刺激作用,促进BMDM向抗炎的M2型极化。
TGF-β是一种促进纤维性修复的生长因子,在伤口愈合期间主要由巨噬细胞分泌,继而介导成纤维细胞增殖和肌成纤维细胞分化[4]。我们的前期研究显示,应用Ac2-26可以上调小鼠糖尿病伤口内TGF-β的蛋白水平[9]。而本研究表明,高糖刺激和Ac2-26干预均未显著影响小鼠BMDM分泌TGF-β1,提示Ac2-26不能直接调节TGF-β的产生。据文献报道,Ac2-26可以促进巨噬细胞吞噬凋亡的中性粒细胞,此吞噬过程伴随着TGF-β的释放[24]。在小鼠糖尿病伤口愈合期间,Ac2-26是否可增强巨噬细胞对凋亡细胞的吞噬作用,继而促进TGF-β的分泌,仍需进一步研究证实。
PI3K/AKT是经典的细胞内信号转导通路,它的激活可抑制炎症反应、促进巨噬细胞向M2型极化,而抑制PI3K/AKT信号通路可以促进M1型极化[25-27]。本研究显示,高糖刺激可减少PI3K/AKT在小鼠BMDM中的磷酸化水平,抑制PI3K/AKT的激活,而应用Ac2-26可以促进PI3K/AKT的激活。而且,PI3K/AKT信号通路抑制剂(wortmannin)抑制了Ac2-26对BMDM极化标志物表达的影响。研究结果提示,Ac2-26可能通过PI3K/AKT信号通路调节小鼠BMDM的极化。
FPR2是介导ANXA1抗炎作用的受体,属于G蛋白偶联受体家族,被激活后可启动细胞内的信号转导[5-6,28]。而且,Ac2-26可通过激活FPR2调节小胶质细胞的极化[13]。本研究显示,使用FPR2拮抗剂(WRW4)抑制了Ac2-26的干预效应,提示FPR2可能介导了Ac2-26对小鼠BMDM极化的调控。但是,小鼠BMDM本身也表达ANXA1,WRW4也有可能阻断内源性ANXA1和FPR2的结合。鉴于ANXA1和Ac2-26在功能上的相似性,WRW4的干预效果也可能部分来自于其对内源性ANXA1作用的阻断。此外,本研究显示高糖刺激24 h未显著影响小鼠BMDM的ANXA1蛋白表达。据文献报道,高糖刺激48 h可上调大鼠心肌细胞内ANXA1 mRNA的表达[29],刺激72 h可下调人类成纤维细胞的ANXA1蛋白表达[30]。由此可见,不同类型的细胞受到不同时间的高糖刺激,可以对ANXA1的表达产生不同的影响。至于长期高糖刺激对巨噬细胞ANXA1表达的影响、高糖环境下内源性ANXA1在巨噬细胞极化中的作用,尚需研究阐明。
综上所述,本研究提示Ac2-26可以抑制高糖诱导的M1型巨噬细胞极化,并促进小鼠BMDM向抗炎的M2型极化,FPR2/PI3K/AKT信号通路的激活可能介导了Ac2-26对小鼠BMDM极化的调控。

