小分子热休克蛋白HSPB1通过上调SIRT1减轻H2O2诱导的人血管内皮细胞早衰*
侯常苗,刘更盛,蒋宇,刘艳娟,邹联洪,陈芳,刘协红△
[1湖南省人民医院(湖南师范大学附属第一医院),湖南省急救医学研究所,急危重症代谢组学湖南省重点实验室,湖南 长沙 410005;2湖南中医药大学临床医学院,湖南省脑科医院,湖南 长沙 410007;3益阳市中心医院,耳鼻咽喉头颈外科,湖南 益阳 413099]
动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)包括中风、心肌梗死和心源性猝死,是目前全球发病率和死亡率的主要原因之一[1]。ASCVD的患病率与血管内皮细胞(vascular endothelial cells,VECs)早衰引起功能障碍有关。血管内皮功能障碍会降低细胞的抗凝、抗增殖、抗炎和血管舒张过程,从而导致ASCVD风险增加[2]。血管内皮细胞的功能对于内皮屏障功能至关重要,其可维持血管稳态[3]。同时,功能性黏附分子可以支持和控制血管内皮连接的完整性[4]。但目前对血管内皮细胞功能的调控机制,内皮细胞衰老对血管功能的影响及其相关分子机制仍不清楚。
细胞可以通过由内在和外在应激因素引起的DNA损伤进入衰老状态,称为应激诱导的过早衰老(stress-induced premature senescence,SIPS)[5]。衰老细胞的特征是细胞形态的改变、DNA损伤、细胞周期负调控因子p16和p21阳性及衰老相关β-半乳糖苷酶(senescence-associatedβ-galactosidase,SA-β-Gal)活性增加[6-7]。其中,氧化应激引起活性氧(reactive oxygen species,ROS)水平的变化是导致SIPS的主要因素[8]。持续的高ROS水平可导致细胞大分子损伤、内皮功能受损,从而通过激活氧化应激反应导致衰老,进而促进动脉粥样硬化的发展[9]。
HSPB1是最先在人类细胞中发现的相对分子质量为27 kD(大鼠为25 kD)的小分子热休克蛋白,又称为HSP27(或HSP25)[10]。大量研究证实HSPB1在细胞的氧化应激损伤,如缺血再灌注损伤和脑缺血损伤中发挥了保护作用[11-12]。HSPB1可通过增加葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)和谷胱甘肽还原酶(glutathione reductase,GR)的活性使谷胱甘肽(glutathione,GSH)保持还原状态从而减少ROS的产生[13]。以上研究提示,HSPB1在调控氧化应激水平中具有重要作用。但是,HSPB1是否通过调控氧化应激减缓血管内皮细胞衰老有待进一步研究。
本研究探讨HSPB1在H2O2诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)早衰中的作用及其机制。我们假设HSPB1参与抑制内皮细胞衰老和调节沉默信息调节因子1(silent information regulator 1,SIRT1)的表达,从而减轻了内皮细胞的功能障碍。本研究结果可能会揭示内皮细胞衰老的机制,并有助于确定动脉粥样硬化和其它与衰老相关疾病的潜在治疗靶点。
材料和方法
1 主要材料
源自ATCC的HUVECs购于上海拜力生物科技有限公司。DMEM培养液和胎牛血清均(Gibco);H2O2(Sigma);Lipofectamine 2000(Invitrogen);无内毒素质粒提取试剂盒(CWBIO);荧光定量检测试剂盒和第一链合成试剂[天根生化科技(北京)有限公司];Total RNA Extraction Kit(Promega);SA-β-Gal染色试剂盒(北京索莱宝科技有限公司);抗SIRT1抗体、抗p53抗体、抗p16抗体、抗p21抗体、抗γH2AX抗体和抗β-actin抗体(Affinity)。
2 主要方法
2.1 实验分组及干预方法根据文献建立H2O2诱导的HUVECs SIPS模型[12]。细胞群倍加数(cell population doubling level,PDL)是指从培养开始至现在细胞群的倍增次数。将PDL8 HUVECs随机分为空白对照(control)组、H2O2处理组和H2O2+HSPB1过表达组,观察HSPB1对H2O2诱导的HUVECs早衰的影响。将PDL8 HUVECs分为对照(control)组、H2O2处理组、H2O2+HSPB1过表达组、H2O2+SIRT1siRNA组和H2O2+SIRT1siRNA+HSPB1过表达组,观察HSPB1是否通过SIRT1调控内皮细胞早衰。
2.2 SA-β-Gal活性测定根据试剂盒操作流程检测SA-β-Gal活性。简单地说,HUVECs在磷酸盐缓冲液中清洗3次,用固定液在室温下固定15 min,然后在37℃下与新鲜的SA-β-Gal染色溶液在pH 6.0下孵育过夜。通过计数200个细胞样本中阳性染色的细胞(×200)来计算SA-β-Gal的百分比。
2.3 流式细胞术检测细胞内ROS水平用2",7"-二氯荧光素二乙酸酯(2",7"-dichlorofluorescin diacetate,DCFH-DA)测定ROS水平。将培养的HUVECs接种于6孔板中,转染pCMV-c-Myc-HSPB1质粒,加入50µmol/L H2O2作用48 h后,收集细胞,用10µmol/L DCFH-DA在37℃孵育30 min,用流式细胞仪进行检测。
2.4 RT-qPCR检测p16和p21的mRNA表达将HUVECs用Trizol裂解,提取总RNA,用PrimeScriptTMRT reagent Kit将RNA逆转成cDNA,操作按试剂盒说明书进行,再用TB Green®Premix Ex TaqTM进行检测。反应程序为:95℃15 s,60℃30 s,72℃30 s,共40个循环。引物由上海生工生物公司合成,序列见表1。以β-actin为内参照,采用2-ΔΔCt法对p16和p21 mRNA表达进行相对定量分析。
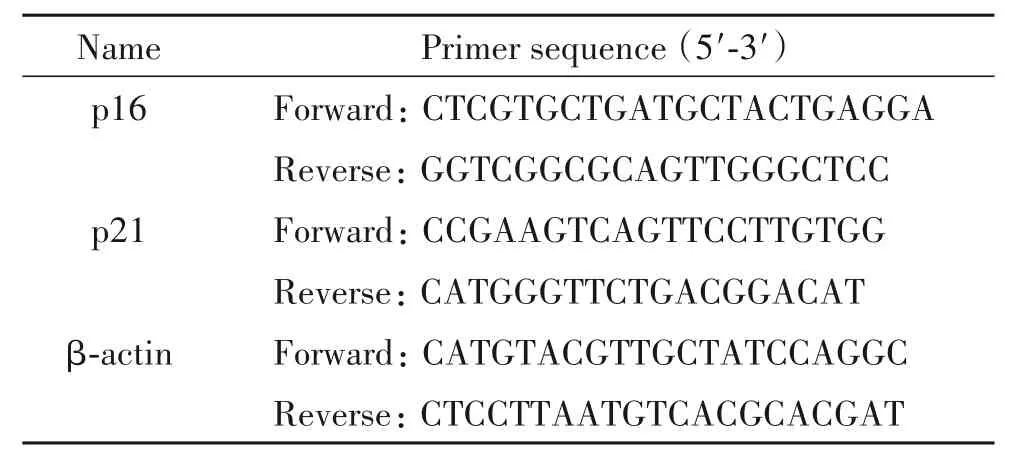
表1 RT-qPCR引物序列Table 1.The sequences of the primers for RT-qPCR
2.5 Western blot检测蛋白表达收集细胞分别提取总蛋白,SDS-PAGE分离蛋白后转膜,5%脱脂奶粉封闭1 h后加Ⅰ抗(1∶1 000),4℃孵育过夜,TBST振荡洗涤3次后,加入Ⅱ抗37℃孵育1 h,TBST振荡洗涤后,ECL发光显色,ChemiDoc™成像系统(BLM Biotechnology)扫描分析。使用ImageJ软件(NIH)对条带进行量化。
3 统计学处理
采用GraphPad Prism 5软件进行图形绘制和统计学分析。至少3个独立数据集的结果,表示为均数±标准差(mean±SD)。对于统计分析,两组间均数比较采用t检验,多组间比较采用单因素方差分析,两两比较采用Bonferroni校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 HSPB1对H2O2诱导HUVECs的早衰的影响
50µmol/L H2O2作 用 于PDL8的HUVECs 48 h后,p16和p21的mRNA表达水平显著升高,而过表达HSPB1可显著降低p21和p16的mRNA水平(P<0.05或P<0.01),见图1A、B。同时,如图1C所示,H2O2作用HUVECs后,SA-β-Gal活性显著增加,衰老细胞数由对照组的(15.97±2.18)%增加到H2O2处理后的(74.1±3.19)%(P<0.01),同时细胞形态变扁平,细胞面积显著增加;而与H2O2处理组比较,过表达HSPB1可显著减少H2O2诱导的衰老细胞数(P<0.01),维持细胞正常的形态。另外,HUVECs经H2O2处理后,ROS水平较基础水平显著升高(P<0.01);而转染HSPB1过表达质粒后,ROS水平较基础水平显著降低(P<0.01);同时,与H2O2处理组比较,过表达HSPB1显著降低了H2O2引起的ROS水平(P<0.01),见图1D。
2 HSPB1对H2O2诱导的HUVECs中早衰相关分子及黏附分子表达的影响
为探讨HSPB1延缓HUVECs衰老的机制,采用Western blot法观察与早衰相关蛋白p53及周期素依赖性蛋白激酶抑制分子(p21和p16)的表达。如图2A所示,与对照组比较,H2O2处理显著提高p53、p21和p16的蛋白水平(P<0.01);而HSPB1过表达可部分逆转H2O2诱导的p53、p21和p16的增高(P<0.05或P<0.01)。同时,过表达HSPB1可降低H2O2诱导的黏附分子VCAM-1与ICAM-1的表达(P<0.01),见图2B。

Figure 1.HSPB1 delayed H2O2-induced HUVEC senescence.A and B:after PDL8 HUVECs were transfected with 2µg pCMV-c-Myc-HSPB1 for 24 h and then treated with H2O2 for 48 h,the mRNA expression of p16 and p21 in HUVECs was detected by RT-qPCR;C:senescence-associatedβ-galactosidase(SA-β-Gal)staining of HUVECs(scale bar=20µm);D:the reactive oxygen species(ROS)levels were detected by flow cytometry.Mean±SD.n=3.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs H2O2 group.图1 HSPB1延缓H2O2诱导的HUVECs衰老
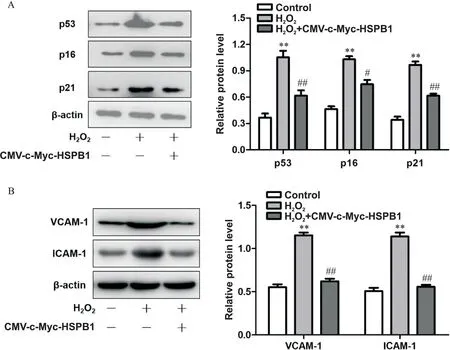
Figure 2.HSPB1 decreased the expression of senescence-related molecules and adhesion molecules in H2O2-induced HUVECs.The PDL8 HUVECs were transfected with 2µg pCMV-c-Myc-HSPB1 for 24 h and then treated with H2O2 for 48 h.A:the protein levels of p53,p21 and p16 were detected by Western blot;B:the protein levels of vascular cell adhesion molecule-1(VCAM-1)and intercellular adhesion molecule-1(ICAM-1)were detected by Western blot.Mean±SD.n=3.**P<0.01 vs control group;#P<0.05,##P<0.01 vs H2O2 group.图2 HSPB1降低H2O2诱导的HUVECs衰老相关分子及黏附分子的表达
3 沉默SIRT1可阻断HSPB1减缓HUVECs早衰的作用
为了进一步探讨SIRT1是否是HSPB1调控SIPS的关键因子,我们用SIRT1siRNA沉默HUVECs中的SIRT1基因,观察p16和p21 mRNA表达、DNA损伤标志物γH2AX蛋白水平及SA-β-Gal活性,检测SIRT1基因沉默对HSPB1延缓HUVECs衰老作用的影响。如图3A所示,与未转染组比较,SIRT1siRNA转染组的SIRT1蛋白表达水平显著降低(P<0.01),干扰效率达70%。在H2O2诱导的HUVECs中,与H2O2单独处理组比较,H2O2+SIRT1siRNA组中p16和p21的mRNA表达水平显著升高(P<0.01),H2O2+CMV-c-Myc-HSPB1组中p16和p21的mRNA水平显著降低(P<0.05或P<0.01),而H2O2+SIRT1siRNA+CMV-c-Myc-HSPB1组p16和p21的mRNA表达水平无显著差异,见图3B、C。Western blot结果显示,在H2O2诱导的HUVECs中,SIRT1siRNA逆转了pCMV-c-Myc-HSPB1引起的γH2AX蛋白水平下降(P<0.05),见图3D。同时,如图3E所示,与H2O2处理组比较,H2O2+SIRT1siRNA组衰老细胞的数量显著增加(P<0.01);与H2O2+CMV-c-Myc-HSPB1组比较,H2O2+SIRT1siRNA+CMV-c-Myc-HSPB1组衰老细胞的数量显著增加(P<0.01)。
另外,如图4A所示,与H2O2+CMV-c-Myc-HSPB1组比较,H2O2+SIRT1siRNA组和H2O2+SIRT1siRNA+CMV-c-Myc-HSPB1组中p53和p21蛋白表达均显著增高(P<0.01)。而我们也观察到沉默SIRT1可逆转HSPB1对p16的下调作用(P<0.01),见图4B。
讨 论

Figure 3.Transient transfection of SIRT1 siRNA abrogated the anti-senescence effect of HSPB1 in HUVECs.A:the efficiency of SIRT1 siRNA transfection was detected by Western blot.The HUVECs were treated with pCMV-c-Myc-HSPB1 and/or SIRT1 siRNA for 48 h,followed by treatment with H2O2 for 24 h.B and C:the mRNA expression levels of p16(B)and p21(C)in HUVECs were detected by RT-qPCR;D:the protein level ofγH2AX was detected by Western blot;E:senescence-associatedβ-galactosidase(SA-β-Gal)staining of HUVECs(scale bar=20µm).Mean±SD.n=3.△△P<0.01 vs control group;▲▲P<0.01 vs negative group;*P<0.05,**P<0.01 vs H2O2 group;#P<0.05,##P<0.01 vs H2O2+CMV-c-Myc-HSPB1 group.图3 瞬时转染SIRT1 siRNA逆转HSPB1在HUVECs中的抗衰老作用
血管衰老相关的主要不良心血管事件是败血症幸存者和有心血管风险的老年人的一个潜在特征。在这些患者中,加速血管衰老可能是潜在的促进机制之一[14-16]。SIPS经常被用作研究衰老的模型,因为它具有衰老细胞的特征,如DNA氧化损伤水平增加、端粒缩短加速和细胞周期调节的改变[17-18]。有研究表明,H2O2预处理HUVECs后炎症因子分泌增多,氧化应激增加,即H2O2通过诱导慢性炎症和氧化应激促进细胞衰老[18]。本实验表明,经H2O2处理后,HUVECs的SA-β-Gal活性显著增加,细胞形态发生改变,ROS水平升高,说明H2O2诱导的HUVECs氧化应激引起衰老模型构建成功。
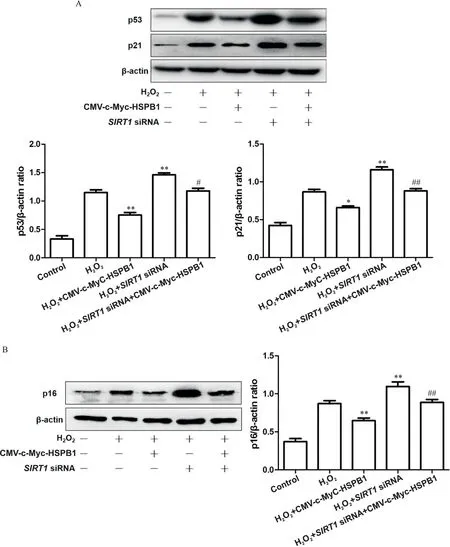
Figure 4.HSPB1 attenuated H2O2-induced senescence of HUVECs through SIRT1/p53/p21 and SIRT1/p16 pathways.The HUVECs were treated with pCMV-c-Myc-HSPB1 and/or HSPB1 siRNA for 48 h,followed by treatment with H2O2 for 24 h.A:the protein levels of p53 and p21 were detected by Western blot;B:the protein level of p16 was detected by Western blot.Mean±SD.n=3.*P<0.05,**P<0.01 vs H2O2 group;#P<0.05,##P<0.01 vs H2O2+CMV-c-Myc-HSPB1 group.图4 HSPB1通过SIRT1/p53/p21及SIRT1/p16途径减轻H2O2诱导的HUVECs衰老
HSPB1的生物学功能是保护细胞免受环境中的自由基、热、缺血和有毒物质等各种应激因素的影响。此外,HSPB1还参与细胞增殖、分化和凋亡的信号转导和调控[19]。有研究探讨了啮齿动物中分子伴侣在与年龄相关的蛋白质之间的关系,结果显示在啮齿动物肌肉和肝脏中长寿蛋白和HSPB1蛋白质表达水平之间具有最佳拟合线性回归[20]。同时,裸鼹鼠(最低寿命31年)中在脑、肺和肾组织中HSPB1的表达比其他小鼠高2~10倍[21]。细胞内p53和p21蛋白水平的升高被认为是内皮细胞衰老的功能标志[22],这是由p53介导的细胞周期停滞导致的,在衰老相关的DNA损伤和端粒功能障碍中p21的表达增加[15,23]。在本研究中,过表达HSPB1可减轻H2O2诱导的p53、p21、VCAM1和ICAM-1蛋白水平升高,这说明HSPB1可以保护HUVEC免受氧化损伤相关的过早衰老,提示HSPB1在血管老化和氧化环境改变引起的疾病中具有保护作用。
SIRT1是一种脱乙酰酶,可通过增加内皮一氧化氮的产生、减少炎症和氧化应激以及诱导自噬等不同机制,在防止血管衰老和动脉粥样硬化方面发挥重要作用[24]。人参皂苷Rb1可通过调控SIRT1相关通路延缓HUVECs的衰老[25],而硫化氢可通过上调SIRT1抵抗高糖诱导的HUVECs衰老[26]。SIRT1可通过p53/21或p16途径参与细胞的生长、分化和衰老等生理和病理过程[27]。在阿霉素诱导的H9c2细胞损伤中,HSPB1通过SIRT1调控p53乙酰化,继而减轻细胞的凋亡[28]。同时,我们以上结果提示,HSPB1可能通过SIRT1途径延缓了HUVECs氧化应激诱导的早衰。为了证实我们的假说,我们利用小分子干扰片段沉默了SIRT1基因的表达,HSPB1对H2O2诱导的HUVECs的早衰和DNA损伤保护作用减弱,表明HSPB1的抗衰老作用依赖SIRT1信号通路。
综上所述,我们的研究表明,HSPB1可通过调节SIRT1/p53/p21及SIRT1/p16信号途径保护HUVECs免受H2O2诱导的过早衰老,这提示HSPB1作为一种潜在的治疗靶点来延缓血管衰老和预防包括动脉粥样硬化在内的与年龄相关的血管疾病。但本实验存在一定的局限性,仅在HUVECs中进行研究,并没有在整体动物模型或原代血管内皮细胞中进行探讨,还需要在后续实验中进行验证。

