不同海拔高度对大鼠肾功能及生物标志物的影响*
潘锦超,刘献,高敬,3,汤响林△,高月△
(1广东药科大学,广东 广州 510006;2军事科学院军事医学研究院辐射医学研究所,北京 100850;3河南大学,河南 开封 475004)
我国是世界上高原地区面积最大、平均海拔最高、定居人口最多的国家。每年有大约1亿人因各种原因前往高海拔地区[1]。高海拔地区低压缺氧及强紫外线的环境对从平原来到高原的人群产生不适影响,许多人会出现头痛、胸闷、乏力等轻微症状,严重者会患急性高原病。因此探究高原低压缺氧对机体损伤的机制已成为研究热点。目前低压缺氧对机体的损伤研究大多集中在脑、肺以及心脏方面,但对缺氧同样敏感的肾脏这一器官,高原缺氧对其功能损伤的研究仍有欠缺。已有的文献证明急性高原缺氧能够导致急性肾损伤[2],并且持续的急性肾损伤会导致急性肾功能衰竭或慢性肾病,因此需要尽早发现急性肾损伤并进行治疗。在目前已有的高原急性肾损伤研究中,用来评价肾损伤的指标主要集中在血清肌酐(serum creatinine,SCr)[3-4]、血尿素氮(blood urea nitrogen,BUN)[5-6]、尿中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)[4,7]、尿肾损伤分子1(kidney injury molecule-1,KIM-1)[3,8]、尿白细胞介素18(interleukin-18,IL-18)、尿Na+/H+交换蛋白3(Na+/H+exchanger 3,NHE3)[9]等。然而,已有研究仅局限于单一的海拔高度,对不同海拔高度肾脏损伤情况尚不清楚。另外,传统的SCr仅在肾小球滤过率下降超过50%才会显著降低,因此不能及时反映肾脏功能的变化。除NGAL和KIM-1外,目前的临床研究也证明了其他几种生物标志物如肝型脂肪酸结合蛋白(liver-type fatty acid-binding protein,L-FABP)、金属蛋白酶组织抑 制 因 子2(tissue inhibitor of metalloproteinase-2,TIMP-2)和胰岛素样生长因子结合蛋白7(insulinlike growth factor binding protein 7,IGFBP7)均能很好地评价急性肾损伤,然而在动物水平上的评价作用研究较少。因此,本研究通过模拟不同海拔高度,观察低、中、高三个不同海拔高度下大鼠肾脏的损伤程度,以及L-FABP、TIMP-2和IGFBP7在大鼠肾脏中的表达情况,旨在探究潜在新型标志物在大鼠不同程度高原肾损伤中的变化情况,同时对三种新型肾损伤标志物的灵敏度进行评价,为新型标志物在高原肾脏损伤及其他肾脏疾病中的应用提供依据。
材料和方法
1 实验仪器及试剂
动物低压氧舱(贵州风雷航空军械有限公司);血细胞分析仪(Sysmex);生化分析仪(Hitachi);酶标仪(PerkinElmer);Heraeus高速冷冻离心机(Thermo Scientific)。超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(货号:MM-0386R1)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)试剂盒(货号:MM-0180R1)、L-FABP试 剂 盒(货号:MM-70115R1)、TIMP-2试剂盒(货号:MM-0127R1)和IGFBP7试剂盒(货号:MM-70148R1)均购自江苏酶免实业有限公司。
2 实验方法
2.1 实验动物及分组8周龄健康SPF级SD大鼠64只,雌雄各半,体重180~200 g,均购自北京维通利华公司[生产许可证号:SCXK(京)2016-0011]。动物饲养1周后开始实验,将大鼠随机分为高原缺氧组和对照组,高原缺氧组又分为海拔3 500 m组、海拔4 500 m组及海拔5 500 m组,每组16只。
2.2 模型制备将3 500 m组大鼠于第1天上午8:00置于低压氧舱中,连续缺氧72 h;于第3天晚8:00对大鼠禁食处理,第4天上午8:00将大鼠从低压氧舱中取出,同时将4 500 m组大鼠置于低压氧舱中;于第6天晚8:00对大鼠禁食处理,第7天上午8:00将大鼠从低压氧舱中取出,同时将5 500 m组大鼠置于低压氧舱中;于第9天晚8:00对大鼠禁食处理,第10天上午8:00将大鼠从低压氧舱中取出。对照组大鼠在常压常氧环境下饲养。实验期间各组大鼠自由进食饮水。高原缺氧组大鼠从低压氧舱中取出后立即注射10%水合氯醛进行麻醉,迅速剪开腹腔取腹主动脉血和双侧肾脏。对照组大鼠与海拔5 500 m组大鼠在同一时段内取材。
2.3 血细胞含量测定取部分腹主动脉血装入抗凝管中,用血细胞分析仪测大鼠全血中血细胞含量。
2.4 SCr、BUN、血清尿酸(uric acid,UA)含量测定剩余血液装入不含抗凝剂的EP管中,室温放置2 h后于4℃、2 012.4×g离心15 min,取一部分上清液用生化分析仪检测SCr、BUN和血清UA含量。
2.5 肾组织SOD、TNF-α、L-FABP、TIMP-2和IGFBP7水平测定取部分右肾放入2 mL EP管中,加入预冷的PBS,用组织匀浆机匀浆,离心取上清液,按试剂盒说明书检测各指标。
2.6 肾脏组织病理染色取左肾,纵向切开,切取1 cm×1 cm×1 cm大小组织块放入4%多聚甲醛固定液中固定,脱水包埋、切片,分别进行HE染色及Masson染色后置于光学显微镜下观察肾组织病理情况。
3 统计学方法
用GraphPad Prism 8.0.2软件统计并绘图。数据均以均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析及LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 大鼠血细胞含量变化
对各组大鼠外周血象数据进行分析,结果见图1。与对照组相比,高原缺氧组大鼠全血中红细胞(red blood cell,RBC)计数和红细胞比容(hematocrit,HCT)均有一定升高,其中4 500 m组和5 500 m组有显著差异(P<0.01),血红蛋白(hemoglobin,HGB)含量和网织红细胞(reticulocyte,RET)计数均显著升高(P<0.05或P<0.01)。

Figure 1.Changes of blood cells in rats at different altitudes.A:changes of red blood cell(RBC)count in each group;B:changes of hemoglobin(HGB)content in each group;C:changes of hematocrit(HCT)in each group;D:changes of reticulocyte(RET)count in each group.Mean±SD.n=16.*P<0.05,**P<0.01 vs normal control(NC)group.图1 不同海拔高度下大鼠血细胞变化情况
2 SCr、BUN和血清UA含量变化
与对照组相比,高原缺氧组大鼠SCr含量均有所升高,其中4 500 m组和5 500 m组显著升高(P<0.01);3 500 m组大鼠BUN含量与对照组相比有升高趋势,5 500 m组显著升高(P<0.05);与对照组相比,仅4 500 m组大鼠血清UA含量显著升高(P<0.05),见图2。

Figure 2.Changes of serum creatinine(SCr),blood urea nitrogen(BUN)and serum uric acid(UA)levels in rats at different altitudes.A:changes of SCr content in each group;B:changes of BUN content in each group;C:changes of serum UA content in each group.Mean±SD.n=16.*P<0.05,**P<0.01 vs normal control(NC)group.图2 不同海拔高度下大鼠SCr、BUN和血清UA含量变化
3 肾组织中SOD、TNF-α、L-FABP、TIMP-2和IGFBP7水平
与对照组相比,高原缺氧组大鼠肾组织中SOD活性均显著降低(P<0.05),其中5 500 m组降低更为显著(P<0.01);高原缺氧组大鼠肾组织中TNF-α含量均显著升高(P<0.01);大鼠肾组织中L-FABP、TIMP-2和IGFBP7含量均随海拔高度的增加而逐渐升高(P<0.05或P<0.01),见图3。
4 肾组织HE染色结果
HE染色显示,对照组大鼠肾组织结构正常,肾皮质内可见大量毛细血管缠绕形成的肾小球,肾小球间质内排列大量肾小管,肾皮质与髓质界限清晰,髓质内分布大量集合管,组织形态结构正常,未见明显病理改变;与对照组相比,3 500 m组大鼠肾组织中部分肾小管上皮细胞刷状缘脱落,部分肾小管上皮细胞水肿,细胞肿胀、胞质淡染;4 500 m组大鼠肾皮质区内部分肾小管上皮细胞水肿,细胞肿胀、胞质淡染,部分肾小管上皮细胞刷状缘脱落;5 500 m组大鼠肾组织内大量肾小管出现损伤,上皮细胞水肿,细胞肿胀、胞质淡染,部分肾小球萎缩,球内毛细血管数量减少,且可见明显肾小球分叶现象。肾组织病理评分结果显示,高原缺氧组与对照组相比差异均有统计学意义(P<0.01)。见图4。

Figure 3.Changes of superoxide dismutase(SOD),tumor necrosis factor-α(TNF-α),liver-type fatty acid-binding protein(LFABP),tissue inhibitor of metalloproteinase-2(TIMP-2)and insulin-like growth factor binding protein 7(IGFBP7)levels in kidney tissue of rats at different altitudes.A:changes of SOD activity in each group;B:changes of TNF-αcontent in each group;C:changes of L-FABP content in each group;D:changes of TIMP-2 content in each group;E:changes of IGFBP7 content in each group.Mean±SD.n=16.*P<0.05,**P<0.01 vs normal control(NC)group.图3 不同海拔高度下大鼠肾组织中SOD、TNF-α、L-FABP、TIMP-2和IGFBP7水平的变化
5 肾组织Masson染色结果
Masson染色显示,对照组大鼠肾组织结构无显著纤维化情况,高原缺氧组大鼠肾组织出现显著纤维化变化;计算胶原纤维面积百分比结果显示,由于3 500 m组和5 500 m组大鼠组内存在个体差异,因此仅4 500 m组与对照组相比差异有统计学意义(P<0.01),见图5。
讨 论
目前已知高原低压缺氧环境能够对心脏、脑、肺造成损伤,对肾脏功能影响的报道较少。研究表明急进高原早期健康人群肾脏功能有一定改变,表现为尿IL-18、尿NAGL、尿KIM-1、BUN、SCr、血UA和血cystatin C水平的变化[6,8],提示肾小球滤过、肾小管重吸收和分泌功能受到损伤,且随海拔高度的增加而加重。由于肾脏的代偿作用,这种损伤会随缺氧时间的延长而减弱[10]。目前对高原肾损伤的动物实验研究往往停留在单一海拔高度,且评价肾损伤的标志物灵敏度较差。因此本研究评价了新型肾损伤标志物在评价动物水平高原肾损伤中的灵敏度,为其在动物肾脏疾病研究的应用提供科学依据。
本研究结果表明:缺氧后大鼠全血中红细胞、血红蛋白、网织红细胞含量及红细胞比容较对照组有不同程度升高,这表明随海拔的升高,大鼠全血中与携氧能力有关的血细胞与蛋白呈现出梯度的升高趋势。急性低压缺氧后,大鼠肾组织中炎症因子(TNFα)含量增加。炎症在许多高原疾病中都有参与,虽然目前尚不清楚其具体作用机制,但在其他能够产生低氧微环境的疾病中,已被证明HIF-1α具有调节炎症反应[11-13],加重炎症损伤的功能[14]。另外,炎症因子能够通过NF-κB通路激活HIF[15-18],进而调控HIF下游蛋白的表达。氧化应激是机体产生ROS的含量超过抗氧化能力时的一种状态[19]。缺氧能够通过HIF-1α/NOX4通路积累ROS[20],造成氧化应激,本研究结果显示低压缺氧后大鼠肾组织中SOD含量减少,大鼠抵抗氧化应激能力减弱。一直以来,肾小球滤过率都被认为是评价肾脏健康与否的黄金指标[21],而SCr常作为估计肾小球滤过率的重要指标[22]。目前临床经常使用SCr或BUN来作为评价肾损伤的指标,然而这两者的值往往在肾小球滤过率低于50%时才会发生显著升高,并且BUN受疾病、饮食等因素影响较大,因此用SCr与BUN诊断早期肾脏损伤很可能是不准确的。寻找更灵敏的评价肾脏损伤的标志物是十分重要的。
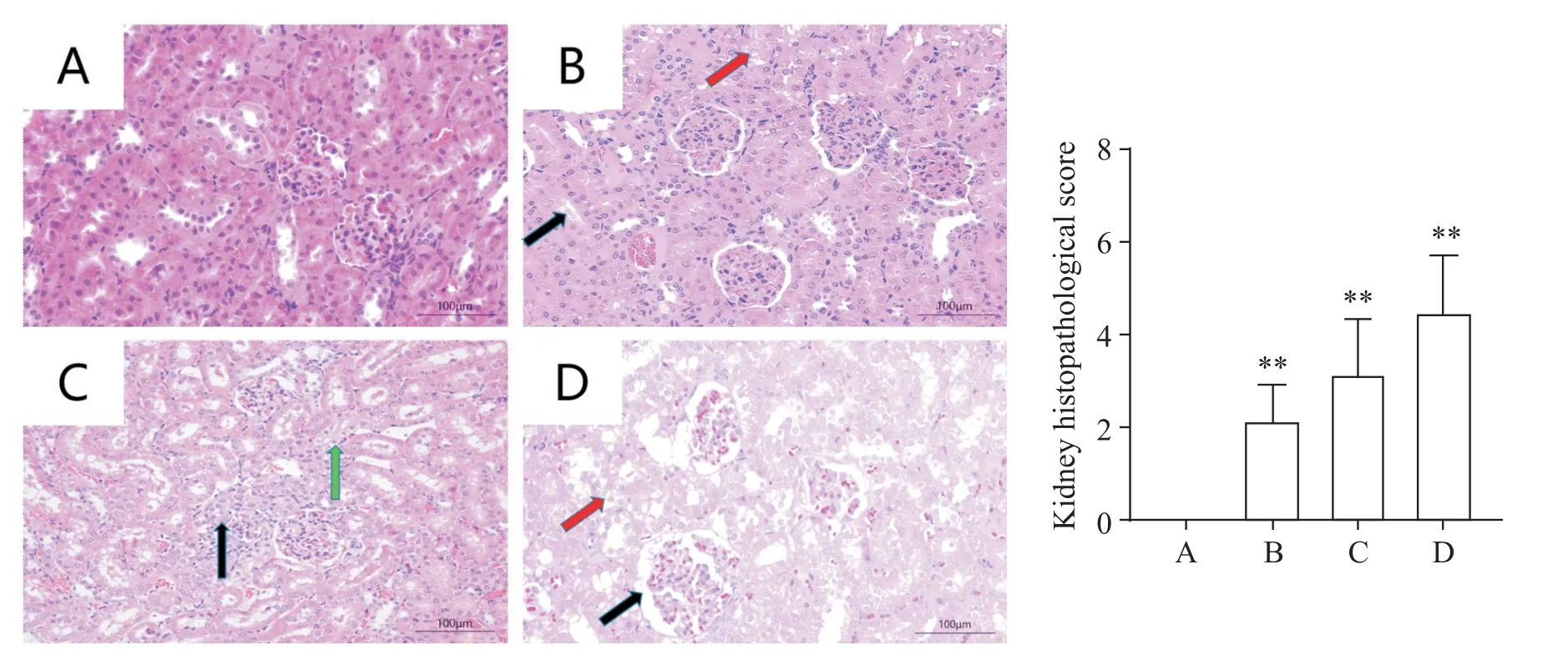
Figure 4.Pathological changes of kidneys in rats at different altitudes(HE staining,scale bar=100µm).A:normal control group;B:3 500 m group[part of renal tubular epithelial cells with brush border exfoliation(black arrow),and some renal tubular epithelial cell edema(red arrow)];C:4 500 m group[edema of some renal tubular epithelial cells(green arrow)and brush margin exfoliation of some renal tubular epithelial cells(black arrow)];D:5 500 m group[edema of renal tubular epithelial cells(red arrow),atrophy of some glomeruli,reduction of intraglomerular capillaries,and glomerular paging(black arrow)].Mean±SD.n=16.*P<0.05,**P<0.01 vs A.图4 不同海拔高度下大鼠肾脏病理形态变化(HE染色)

Figure 5.Renal pathomorphological changes(Masson staining,scale bar=100µm)in each group at different altitudes.A:normal control group;B:3 500 m group;C:4 500 m group;D:5 500 m group.Mean±SD.n=16.*P<0.05,**P<0.01 vs A.图5 不同海拔高度下大鼠肾脏病理形态变化(Masson染色)
L-FABP是哺乳动物细胞内脂肪酸结合蛋白家族的成员,它在调节脂肪酸新陈代谢和细胞内运输方面起着至关重要的作用[23]。除了在肝脏中表达外,它在肾脏近端肾小管上皮细胞中也有表达,并在肾小管损伤时分泌到尿液中[24]。临床研究表明,心血管手术患者术后尿L-FABP值对其是否会发生急性肾损伤具有较好的预测作用[23]。另外,研究表明,FABP1基因启动子区域含有缺氧反应元件[25],在肾小管遭受缺血缺氧时FABP1分泌增多,因此FABP1可以作为一个表征缺氧性肾脏损伤的指标。
TIMP-2是肾组织远端小管表达并分泌的一种物质[26],是一种细胞周期阻滞蛋白,已被证明TIMP-2与α3β1整合素结合,使细胞停留在G1期,从而抑制内皮细胞增殖[27]。IGFBP7主要在近端小管表达[26],其能够在肾小管上皮细胞受到损伤后以自分泌和旁分泌的方式释放并作用于未受到损伤的细胞,通过调控p53和p21的表达来阻断细胞周期的进程[28]。这两者均能够在肾小管细胞损伤的早期阶段释放并参与G1期停滞[29]。已有的临床研究也表明TIMP-2与IGFBP7对患者发生急性肾损伤的预测作用优于其他生物标志物[28]。因此这3种物质在能够急性肾损伤早期起到预测作用,且较SCr有更好的敏感性,然而它们在动物水平肾损伤的预测作用研究较少。
在本研究中,与对照组相比,高原缺氧组大鼠SCr及肾组织L-FABP、TIMP-2和IGFBP7含量升高,提示高原缺氧能够降低大鼠肾小球滤过率,造成急性肾损伤;高原缺氧组各组之间相比,肾脏病理变化随海拔高度增加逐渐明显。与4 500 m组及5 500 m组相比,3 500 m组大鼠肾脏损伤程度相对较小,SCr变化较少,然而TIMP-2和IGFBP7含量在3 500 m组就已发生显著升高。这提示TIMP-2和IGFBP7较SCr灵敏度更佳,在病理形态尚未出现明显改变时可提示损伤的发生,而L-FABP的灵敏度较TIMP-2和IGFBP7稍差,仅在海拔4 500 m时发生明显升高。BUN与血清UA含量并未随海拔高度的升高逐渐增多,推测可能是其他因素影响了这两者含量的变化。
在高原缺氧导致的大鼠肾脏损伤中,氧化应激和炎症似乎参与了这一进程,然而在病理结果上并未出现明显的炎性细胞浸润,因此关于高原缺氧导致的肾脏损伤机制需要进一步研究。另外,本实验是基于健康大鼠,对于患有糖尿病肾病、高血压或其他肾功能不良的大鼠,高原缺氧能否加重其肾脏功能损伤,还有待进一步研究。在健康人水平上,由于急进高原初期健康人肾脏功能有一定改变,因此初上高原1周内,要密切关注高原驻防官兵的肾脏功能,对于出现肾脏相关指标异常的官兵,要及时给予纠正,以免损伤加重。另外在相关药物的使用方面要注意药量的调整,避免发生由于药量过高产生的毒副作用。

