基于体内外实验探讨蒙药七味清肝散对大鼠肝纤维化的作用及机制*
高晓阳,金蓉,颜羽昕,张春艳,赵晓璐,马月宏
(内蒙古医科大学基础医学院,内蒙古 呼和浩特 010000)
肝纤维化(hepatic fibrosis,HF)是以细胞外基质(extracellular matrix,ECM)过度积聚为特征的慢性肝损伤的病理生理结果[1-2],它是一个动态过程,涉及实质细胞(肝细胞)、肝星状细胞(hepatic stellate cells,HSCs)、肝窦内皮细胞以及驻留和浸润的免疫细胞间的相互作用[3]。其中,HSCs是受损肝脏中产生ECM的主要细胞,HSCs的增殖活化是肝纤维化发生和发展的核心事件。持续性的肝损伤会不断激活HSCs,最终导致纤维疤痕形成,并进一步发展为肝硬化、肝癌和肝衰竭等[4]。蒙药七味清肝散是被明确记载在《内蒙古蒙成药标准》中的经典药方,别名“额力根-7味”散,由蓝盆花、红花、香青兰、瞿麦、石膏、五灵脂和人工牛黄等7味药组成,具有清肝热的功效,临床上已用于肝热、目赤黄疸、肝区疼痛、发热口渴和头痛等症状的治疗[5-6],不足的是,该方的具体适应症及其药理作用机制仍尚不明确。基于课题组前期对七味清肝散的研究,通过转录组测序,并运用网络药理学分析可知,七味清肝散的药理作用可能通过影响微小RNA(microRNA,miR)和/或磷酸酶与张力蛋白同源物(phosphatase and tensin homolog deleted on chromosome ten,PTEN)/磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋 白 激 酶B(protein kinase B,PKB/Akt)信号通路发挥作用[7-8]。研究表明,由四氯化碳(CCl4)、胆管结扎(bile duct ligation,BDL)或硫代乙酰胺(thioacetamide,TAA)诱导的HF动物模型中,miR-21在血清和肝脏中的表达均明显上调[9-10]。在机制上,miR-21的过表达激活HSCs,促进氧化,增加胶原合成,并通过Smad7/Smad2/3/NADPH氧化酶4、程序性细胞死亡4(programmed cell death 4,PDC4)/AP-1和PI3K/Akt等途径激活血管紧张素,增加纤维化风险;当miR-21基因被敲除后,脂肪变性、炎症和脂肪细胞凋亡均将减少,有利于抗纤维化[11]。因此,本项工作通过构建HF大鼠模型和设计细胞实验,探讨七味清肝散对miR-21和PTEN/PI3K/Akt信号通路表达水平的影响,以期为HF治疗提供参考资料。
材料和方法
1 实验动物及细胞系
清洁 级6~8周龄雄性Wistar大鼠50只,体重(200±20)g,购自北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2016-0006]。所有大鼠均饲养于内蒙古医科大学动物实验中心,温度(20±2)℃,自由进食、饮水,适应性饲养1周后进行后续实验。
大鼠肝星状细胞株HSC-T6购于北京北纳科技有限公司。
2 药品与主要试剂
蓝盆花、红花、香青兰、瞿麦、石膏、五灵脂和人工牛黄7味药材购自内蒙古天盛蒙中医有限责任公司,已由内蒙古医科大学蒙医药学院蒙药炮制实验中心鉴定为真品。丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)和羟脯氨酶(hydroxyproline,HYP)试剂盒购自南京建成生物工程研究所有限公司产品;苏木素-伊红(hematoxylin-eosin,HE)染色液、Masson染色试剂盒、MTT试剂盒及Triquick Reagent购自北京索莱宝科技有限公司产品;miRNA模拟物和抑制剂和转染试剂购自广州锐博生物技术有限公司产品;FastKing cDNA第一链合成试剂盒、SuperReal荧光定量预混试剂购自北京天根生化科技有限公司;免抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、免抗Ⅰ型胶原蛋白(collagen type I,Col I)、免抗PTEN、免抗PI3K、免抗Akt及免抗GAPDH抗体购自北京博奥森生物技术有限公司。
3 主要方法
3.1 动物分组、建模及处置取30只Wistar大鼠随机分为对照(control)组、模型(model)组、低剂量(135 mg·kg-1·d-1)七味清肝散(low dose)组、中剂量(270 mg·kg-1·d-1)七清肝散(medium dose)组和高剂量(405 mg·kg-1·d-1)七味清肝散(high dose)组,每组6只。参照文献[7,12],所有大鼠均以基础饲料喂养,除对照组外,其余大鼠按2 mL/kg的剂量以50% CCl4-橄榄油溶液灌胃,每周2次,同时低、中、高剂量组以相应剂量药物灌胃,每天1次,持续8周。最后一次灌胃12 h前禁食不禁水,灌胃后1~2 h内用10%水合氯醛溶液(3 mL/kg)麻醉,腹主动脉采血,静置20 min,1 006.2×g离心15 min,得到血清,并取肝组织进行后续实验。
3.2 七味清肝散含药血清的制备七味清肝散处方中除人工牛黄的各味药材(蓝盆花60 g、红花180 g、香青兰60 g、瞿麦60 g、石膏180 g、五灵脂60 g)粉碎过100目筛,得到的粉末再与人工牛黄80 g混合,以0.5%羧甲基纤维素钠溶解。将20只Wistar大鼠随机分为2组,即对照组(等量氯化钠溶液)和给药组(1.35 g/kg七味清肝散溶液)[7],每天灌胃1次。第8天给 药1~2 h后 腹主动 脉采血,静置20 min,1 006.2×g离心15 min,56℃、30 min灭活后用0.22µm滤膜过滤,得到含药血清。对照组操作同前。
3.3 检测血清生化指标及HYP含量按照试剂盒说明书,检测各组大鼠血清中ALT、AST、ALP及HYP的含量。
3.4 肝组织病理学观察选取适量肝组织(右侧最厚一叶),置于4%甲醛溶液中固定48 h,梯度乙醇脱水各2 h,二甲苯透明30 min,石蜡包埋,切片厚度4µm。最后根据标准程序进行HE和Masson染色,在光学显微镜下观察肝脏的病理变化。
3.5 细胞培养和处理取HSC-T6细胞,培养于含10%胎牛血清的DMEM培养液,保存在37℃培养箱,湿度95%,5%CO2。待细胞贴壁并长至培养皿的80%~90%时,各组细胞加入2µg/L转化生长因子β1(transforming growth factor-β1,TGF-β1)孵育24 h,弃上清,用10%(low dose)、15%(medium dose)和20%(high dose)的含药血清[7]预处理24 h,收集细胞用于进一步实验。
3.6 细胞转染转染分组为miR-21 mimics组、miR-21 inhibitor组以及各自的无效序列对照(negative contorl,NC)组(miR-21 mimics NC组和miR-21 inhibitor NC组)。
取对数生长期的(0.5~1)×106个细胞移至24孔板,当细胞密度达到80%~90%,将4个转染组提前配制好的riboFECTTMCP混合液加到24孔板中,轻轻混匀,重新放回37℃、5% CO2的培养箱中培养48 h。每个转染样品设5个复孔。
3.7 细胞活力的测定采用MTT试剂盒检测HSC T6细胞活力。以每孔5×103个细胞的密度接种在96孔板中,分别用不同浓度的含药血清孵育24、48和72 h,加入10µL MTT溶液继续培养。在对照孔中,将微孔板读数器归零,酶标仪490 nm处测量吸光度(A)值。每组设4个复孔。
3.8 纤维化及相关因子的表达
3.8.1 RT-qPCR实验用Trizol法提取细胞总RNA,溶解 于DEPC水后 测RNA浓度。通过FastKing cDNA第一链合成试剂盒将RNA逆转录得到cDNA,再将SuperReal荧光定量预混试剂用于qPCR分析。在7500 Fast荧光定量PCR系统上按照以下方案进行qPCR反应:95℃、15 min预变性;95℃、10 s变性,60℃、32 s退火,40个循环;60℃、32 s延伸。采用2-ΔΔCt法进行数据处理。所有体系分析均设3次重复。引物由上海生工生物科技有限公司合成,序列见表1。

表1 RT-qPCR引物序列Table 1.Primer sequence for RT-qPCR
3.8.2 Western blot将含有PMSF的RIPA裂解液加到肝组织和HSC-T6细胞中,4℃、14 000×g离心10 min,收集上清液,获得蛋白样品用于Western blot。在变性的条件下,用8%或10% SDS-PAGE分离等量的蛋白,转移到硝酸纤维素膜上。室温下5%脱脂牛奶在含有吐温20的TBST缓冲液中封闭1 h,4℃Ⅰ抗过夜,次日加入Ⅱ抗孵育1 h。这些信号使用近红外加入激光成像系统可视化,ImageJ分析Western blot的蛋白表达灰度值。以上实验步骤独立进行3次。
4 统计学处理
采用SPSS 26.0软件对数据进行统计分析,使用GraphPad Prism 8.0软件绘制统计图。所有数据以均数±标准差(mean±SD)表示,样本数用n表示。若数据满足正态分布且方差齐,多组间比较采用单因素方差分析;若数据不满足正态分布和/或方差齐性,组间比较采用Kruskal-Wallis H检验。以P<0.05为差异具有统计学意义。
结 果
1 七味清肝散抗CCl4致大鼠肝纤维化作用
与对照组相比,模型组大鼠血清中的ALT、AST、ALP和HYP含量均显著升高(P<0.05);而各剂量给药组与模型组相比,大鼠血清中的ALT、AST、ALP和HYP含量均有不同程度的下降(P<0.05或P<0.01),见图1。

Figure 1.Effects of QiweiQinggan powder on serum biochemical indexes and HYP content of rats in each group.A:ALT;B:AST;C:ALP;D:HYP.Mean±SD.n=6.#P<0.05 vs control group;*P<0.05,**P<0.01 vs model group.图1 七味清肝散对各组大鼠血清生化指标及HYP含量的影响
HE和Masson染色显示,正常肝细胞排列规则、致密,以中央静脉为中心向四周呈索状排列,肝小叶结构完整且界线清楚;在CCl4处理后的大鼠中,HE染色的肝组织间有大量炎症细胞浸润,肝细胞肿胀、坏死,肝小叶损伤明显,Masson染色的肝组织中可见广泛的胶原沉积。这些观察到的组织学改变都能被七味清肝散显著减弱,且改善的程度随药物剂量的增加而增加,见图2。

Figure 2.Pathological changes of HE(A)and Masson(B)staining in liver tissue.The scale bar=50µm.图2 肝组织HE和Masson染色病理学改变
2 七味清肝散抑制HSC-T6细胞活力
用不同剂量的含药血清孵育HSC-T6细胞24、48和72 h后结果显示,相同时间内,与模型组相比,各剂量组的A值显著降低(P<0.05或P<0.01),且给药24 h后七味清肝散含药血清对细胞活力的抑制率明显高于48 h和72 h,故后续实验给药时间定为24 h,见图3。
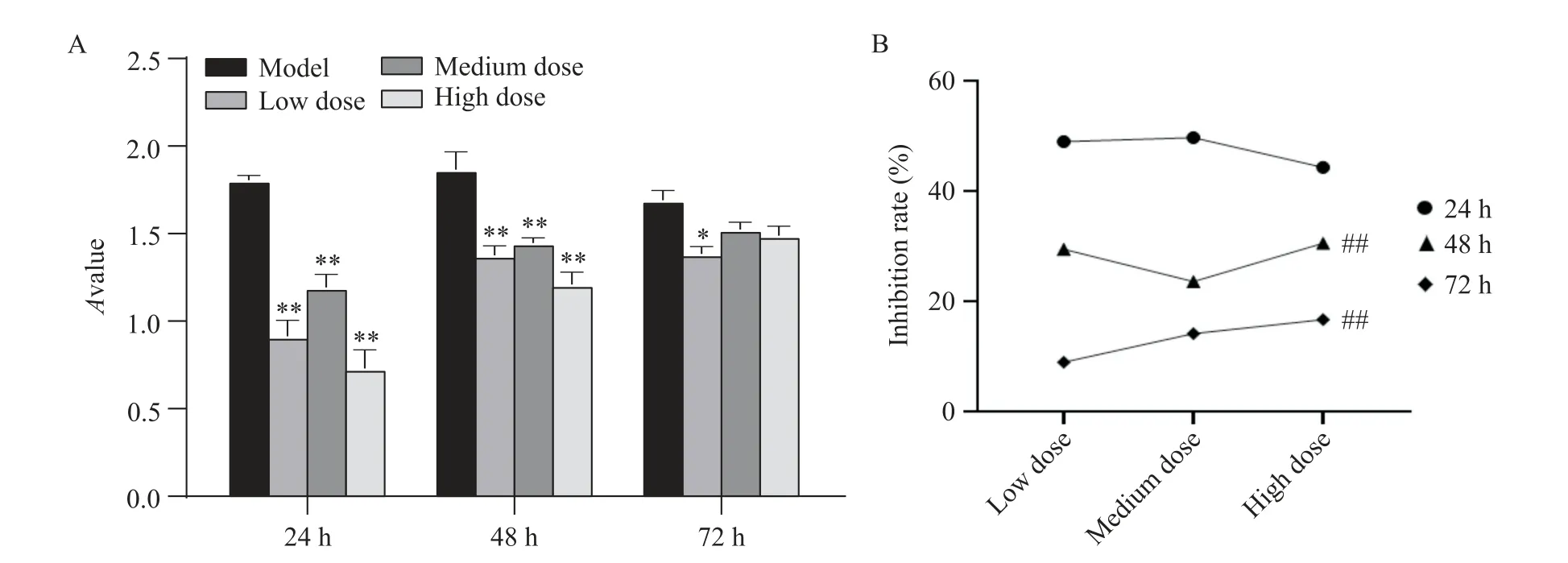
Figure 3.Effects of Qiwei-Qinggan powder-containing serum on the viability of HSC-T6 cells(A)and the inhibition rate of cells in each group at different time points(B).Mean±SD.n=4.*P<0.05,**P<0.01 vs control group;##P<0.01 vs 24 h group.图3 七味清肝散含药血清对HSC-T6细胞活力的影响以及不同时点各组细胞的活力抑制率
3 七味清肝散通过PTEN/PI3K/Akt信号通路抗HF的作用机制
3.1 大鼠肝组织中α-SMA、Col I、PTEN、PI3K和Akt的蛋白表达水平与对照组相比,接受CCl4处理的大鼠肝组织中α-SMA、PI3K和Akt蛋白表达显著上调(P<0.05,P<0.01);当同时给予CCl4和不同剂量的七味清肝散时,上述指标的蛋白水平均显著下调(P<0.01),PTEN蛋白表达水平与上述指标相反(P<0.01)见图4。

Figure 4.Relative protein expression levels of fibrosis-related factors in liver tissue of rats in each group.Mean±SD.n=6.#P<0.05,##P<0.01 vs control group;*P<0.05,**P<0.01 vs model group.图4 各组大鼠肝组织中纤维化相关因子的蛋白表达水平
3.2 HSC-T6细胞中α-SMA、Col I、PTEN、PI3K和Akt的蛋白表达水平与模型组相比,随着七味清肝散含药血清剂量的增加,HSC-T6细胞中α-SMA、Col I、PI3K和Akt的蛋白表达均显著降低(P<0.05或P<0.01),PTEN蛋白表达显著升高(P<0.01),见图5。

Figure 5.Relative protein expression levels of fibrosis-related factors in HSC-T6 cells of rats in each group.Mean±SD.n=3.*P<0.05,**P<0.01 vs model group.图5 各组HSC-T6细胞中纤维化相关因子的蛋白表达水平
4 七味清肝散下调miR-21的表达
测定HSC-T6细胞中miR-21表达的变化,结果显示,模型组HSC-T6细胞中有miR-21的明显表达,给予不同剂量含药血清后,各组中miR-21表达显著降低(P<0.01),见图6。
5 miR-21负向调节PTEN
与各自的NC组相比,PTEN的mRNA和蛋白表达水平被miR-21 mimics显著下调(P<0.05或P<0.01),而被miR-21 inhibitor显著上调(P<0.05或P<0.01),见图7。
6 HSC-T6细胞调控miR-21抗HF的作用机制
6.1 HSC-T6细胞转染后α-SMA、Col I、PI3K和Akt的mRNA表达水平HSC-T6细胞miR-21mimics后α-SMA、Col I、PI3K和Akt的mRNA表达水平显著升高(P<0.01),而转染miR-21 inhibitor显著降低α-SMA、Col I、PI3K和Akt的mRNA表达水平(P<0.05或P<0.01),见图8。
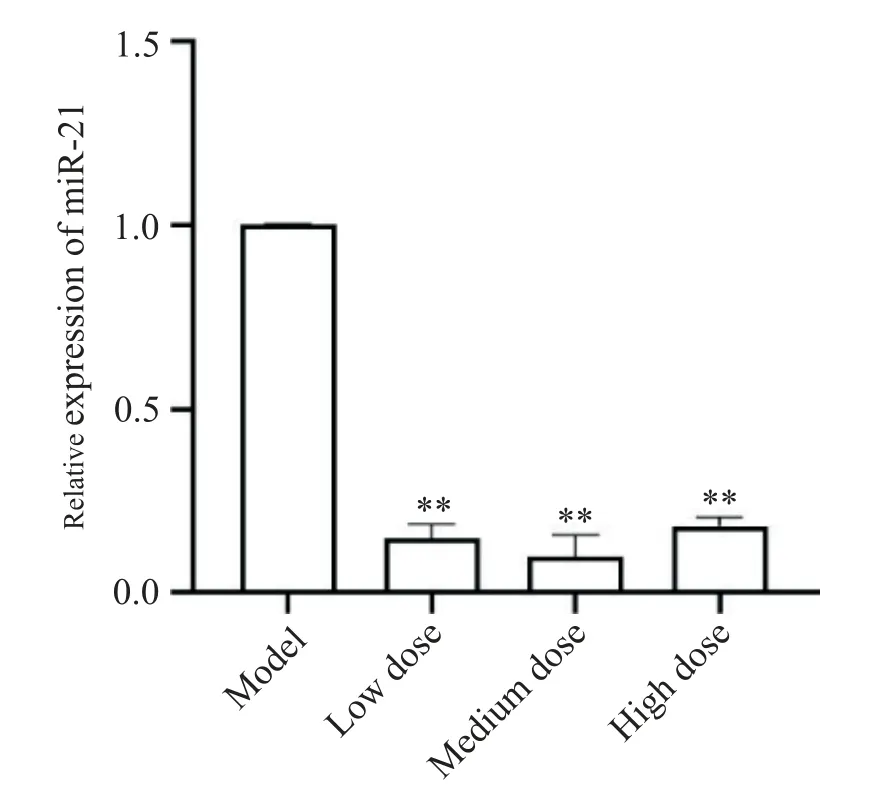
Figure 6.The expression level of miR-21 in HSC-T6 cells of each group.Mean±SD.n=3.**P<0.01 vs model group.图6 各组HSC-T6细胞中miR-21的表达水平

Figure 7.The mRNA(A)and protein(B)expression levels of PTEN in HSC-T6-transfected cells in each group.Mean±SD.n=5.*P<0.05,**P<0.01 vs miR-21 mimics NC group;#P<0.05,##P<0.01 vs miR-21 inhibitor NC group.图7 各组HSC-T6转染细胞中PTEN的mRNA和蛋白表达水平
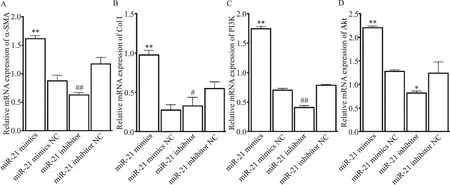
Figure 8.The mRNA expression levels ofα-SMA(A),Col I(B),PI3K(C)and Akt(D)in HSC-T6-transfected cells in each group.Mean±SD.n=5.**P<0.01 vs miR-21 mimics NC group;#P<0.05,##P<0.01 vs miR-21 inhibitor NC group.图8 各组HSC-T6转染细胞中α-SMA、Col I、PI3K及Akt的mRNA表达水平
6.2 HSC-T6细胞转染后PI3K和Akt的蛋白表达水平结果显示,与miR-21 mimics NC组相比,miR-21 mimics组中PI3K和Akt蛋白表达水平显著升高(P<0.01);与miR-21 inhibitor NC组相比,miR-21 inhibitor组中PI3K和Akt蛋白表达水平显著降低(P<0.01),见图9。
讨 论
肝脏作为人体内最大的实体器官,受损后会发生一系列炎症事件。随着时间的推移,慢性炎症导致HSCs活化并转分化成肌成纤维细胞,使ECM大量堆积,最终导致HF的形成[13]。虽然纤维化已被视为是一种保持组织完整性的“伤口愈合”过程,但持续的慢性纤维化也可能成为新的病原,逐渐发展成为肝硬化及其他相关疾病[14]。因此迫切需要找到一种更有效、更安全的抗纤维化药物来改善HF。在本研究中,我们确定了七味清肝散的抗HF作用。七味清肝散能显著改善HF大鼠模型的肝功能,减轻肝组织病理改变和胶原纤维沉积,抑制HSC-T6细胞活力。

Figure 9.The protein expression levels of PI3K and Akt in HSC-T6-transfected cells in each group.Mean±SD.n=5.**P<0.01 vs miR-21 mimics NC group;#P<0.05,##P<0.01 vs miR-21 inhibitor NC group.图9 各组HSC-T6转染细胞中PI3K及Akt蛋白表达水平
HSCs活化是分泌ECM蛋白和形成肌成纤维细胞的主要细胞来源,是肝纤维化的主要驱动力。来自受损上皮细胞、纤维化组织微环境、免疫和全身代谢失调、肠道菌群失调和肝炎病毒产物的旁分泌信号可直接或间接诱导HSCs活化[15]。而失调的细胞内信号转导和细胞应激反应通过诱导恢复到灭活状态、细胞衰老、细胞凋亡以及免疫细胞清除是HSCs失活的候选靶标[16]。在本研究中,我们主要探讨了PTEN/PI3K/Akt信号通路在HF中的作用。研究表明[17],PI3K/Akt信号通路中的一系列磷酸化事件可能会激活转录因子,参与和改变重要细胞过程(增殖、分化)的蛋白表达、细胞凋亡、细胞周期和血管生成等,所以下调PI3K和Akt的表达,可能有利于疾病治疗。而PTEN作为PIEK/Akt通路的天然抑制剂,可抑制PI3K/Akt信号通路的激活,限制细胞增殖和肿瘤进展[18]。同时,有大量文献报道PI3K/Akt信号通路能够有效调节纤维化反应,譬如ECM的重塑和肌成纤维细胞的转化;下调PI3K、Akt和mTOR等可抑制胶原表达,阻断成纤维细胞的增殖、分化,延缓纤维化疾病的进展[19]。在我们的研究结果中,七味清肝散就是通过上调PTEN,下调α-SMA、collagen I、PI3K和Akt表达来发挥抗HF作用。
研究证实miRNA的上、下调表达影响HF的发病机制[20]。在本研究,我们聚焦于miR-21,揭示了七味清肝散能通过miR-21影响PTEN/PI3K/Akt信号通路来抗HF。研究显示[21-22],PTEN是miR-21的下游靶标,两者呈负向调控,而活化的HSC-T6细胞中miR-21明显上调,这与已有的研究结果一致,七味清肝散降低了HSCs中miR-21表达。此外,细胞转染实验显示,在mRNA和蛋白水平上,miR-21 mimics抑制PTEN的表达,上调PI3K和Akt表达,而miR-21 inhibitor对PTEN/PI3K/Akt通路的影响与七味清肝散类似。
综上所述,本实验通过动物和细胞模型初步探讨了七味清肝散具有抗大鼠HF作用,其作用机制可能是通过下调miR-21,进而调控PTEN/PI3K/Akt信号通路来实现的,为七味清肝散在HF中的临床应用提供了参考资料。

