白杨素衍生物的抗氧化和抗炎活性研究进展
凡春玲,申栋帅,冯小明,肖 攀,陆 璐,王红义,牛廷献
(中国人民解放军联勤保障部队第九四〇医院,兰州 730050)
白杨素化学名称为5,7二羟基总黄酮(chrysin),化学结构如图1所示,来源于木蝴蝶、山白松和芒松等植物,具有抗氧化、抗病毒、抗肿瘤、抗炎、抗癌、抗糖尿病、抗高血压、抗菌等广泛药理活性, 但因其不溶于水、生物利用度低、口服给药会产生严重的“首过效应”等原因不能用于临床[1],因此成为了通过结构修饰来进行新药开发研究中的一个非常重要的原料。
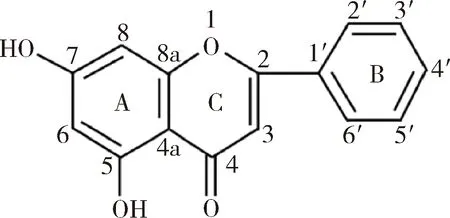
图1 白杨素的结构
新的白杨素衍生物合成后主要被用于抗癌或抗肿瘤活性筛选,而对其它药理活性的研究较少,但白杨素之所以具有众多的药理活性与其抗炎和抗氧化作用有着非常紧密的联系[2]。炎症和氧化应激是包括癌症在内的众多疾病产生的诱因或并发症,因此能够显著地抑制体内的炎症或氧化应激过程的药物,理论上可以对其它疾病产生一定的药效,阿司匹林等非甾体类抗炎药物往往具有众多药理作用的原因就在于此[3-4]。基于目前白杨素的衍生物数量众多,单个衍生物已验证的药理活性较少,以及炎症和氧化应激在疾病发生发展过程中的重要地位,本文将主要对已验证具有明显抗炎或抗氧化活性的白杨素衍生物进行综述,通过对它们的化学结构进行展示,结合该化合物的药效研究结果,促进研究人员对白杨素可进行的结构修饰方向的了解,以及不同结构修饰后的化合物是否具有良好药理活性的前景分析。综上所述,希望本文对基于白杨素或白杨素衍生物结构基础上的新兽药研发提供思路和信息支持。
1 抗氧化活性
1.1 抗氧化损伤 李红侠等合成了一种新型白杨素衍生物(CD,结构如图2所示),并分别以人正常肝细胞株(L-O2细胞)和昆明小鼠为实验对象来研究CD的抗氧化活性。使用双氧水(H2O2)诱导L-O2细胞氧化损伤模型,结果表明经该衍生物处理后,L-O2细胞中谷胱甘肽过氧化物酶(GSH-Px)、过氧化物酶(CAT)和超氧化物歧化酶(SOD)的活性显著升高,丙二醛(MDA)的含量明显降低。此外使用小鼠进行体内实验,模型组通过双氧水诱导小鼠氧化损伤,同时设置CD注射给药组(5 mg·kg-1),最终检测小鼠血液和肝脏组织中GSH-Px、SOD、CAT的活性及MDA含量。结果表明与模型组相比,当小鼠给药浓度为5 mg·kg-1时,小鼠血液中MDA含量相比模型组下降47.01%,GSH-Px、CAT和SOD活性分别升高了108.41%, 74.29%和54.00%。小鼠肝脏组织中MDA含量下降了54.00%,GSH-Px、CAT和SOD活力则分别增加了44.91%,55.21%和45.17%,上述结果说明CD具有明显的抗氧化活性[5]。
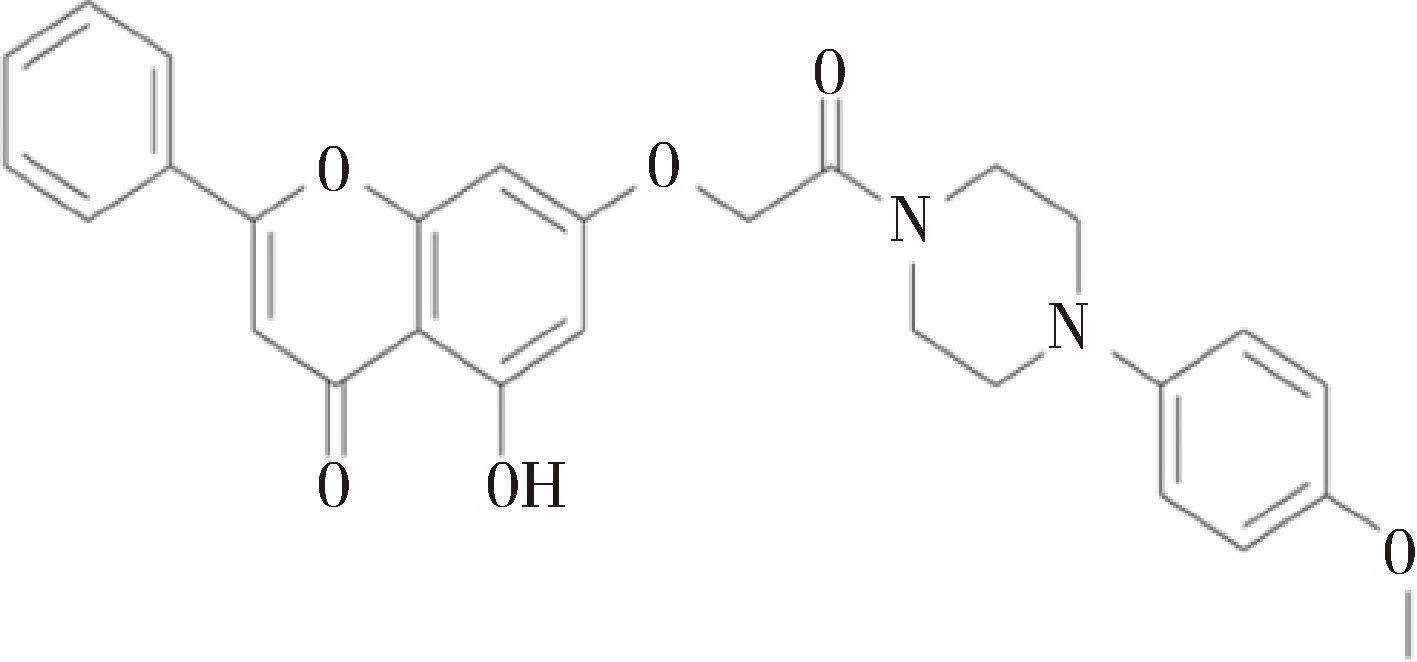
图2 CD的结构
Zhu等合成了白杨素-β-D-半乳糖苷(结构如图3所示),通过紫外灯诱导氧化损伤模型,并对其进行氧化损伤相关指标评价。结果表明白杨素-β-D-半乳糖苷的氧自由基清除能力强于白杨素。在无紫外光照射下,白杨素-β-D-半乳糖苷的超氧阴离子清除率是32.79%,相比白杨素升高15%。而在紫外线灯照射下,白杨素-β-D-半乳糖苷的超氧阴离子清除率达到了60%,远超此时白杨素的清除率[6]。

图3 白杨素-β-D-半乳糖苷的结构
Rahul V等将白杨素和不同的哌嗪、吡啶、吗啉环进行偶联,得到了7a-7w共计23种化合物,主要结构如图4所示,区别在于R取代基不同。进行了DPPH抗氧化试验和ABTS氧自由基清除实验,结果表明这23种化合物在这两种实验中的IC50范围分别是20.30~34.06 μg/mL和5.569~8.971 μg/mL,整体表现出较强的抗氧化损伤的活性,其中7f, 7j, 7k, 7l, 7n, 7q, 7v和7w的抗氧化损伤的活性最强[7]。Veronika等则是将类胡萝卜素与不同的黄酮类物质进行偶联,并进行抗氧化活性筛选。合成的5种偶联物(结构如图5所示),通过Trolox等效抗氧化能力(TEAC)试验评价其抗氧化活性。结果表明,23号胡萝卜素白杨素偶联物具有极强的抗氧化活性,其余4种同样具有抗氧化活性,但远远弱于23号偶联物[8]。Liu等合成了7种白杨素衍生物(结构如图6所示),并筛选了它们的抗菌和抗氧化活性。采用DPPH自由基清除实验和β-胡萝卜素漂白法两种方法进行抗氧化活性的测定,具体结果如表1所示。结果表明,7种化合物都具有良好的抗氧化活性,其中4号化合物的抗氧化效果最好,且优于阳性对照药物二丁基羟基甲苯(BHT)[9]。

图4 Rabul V等所合成的23种白杨素衍生物主要结构
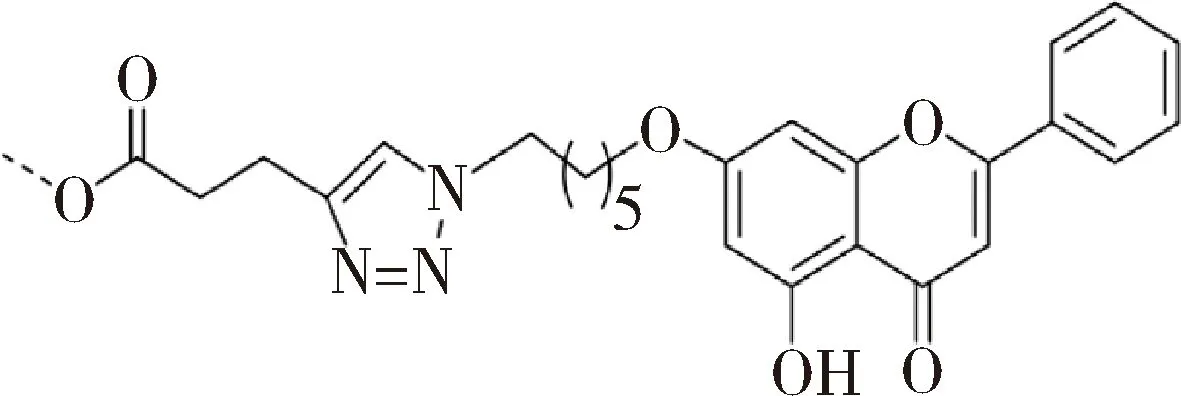
图5 VeronikaV等合成的5种白杨素与胡萝卜素偶联物(22-25)的结构

图6 Liu等所合成的7种白杨素衍生物结构
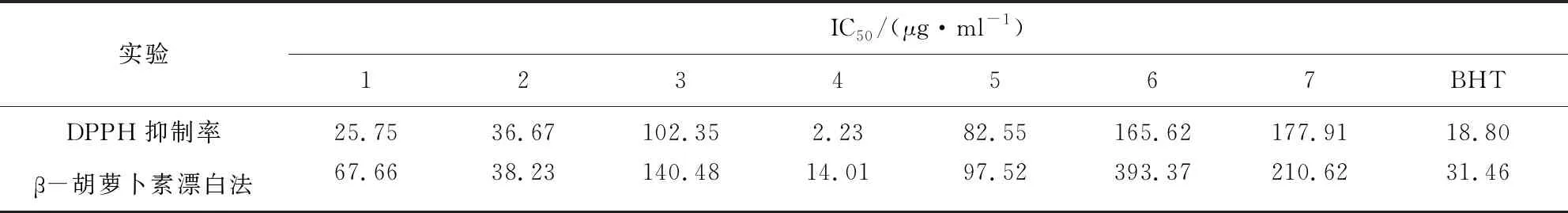
表1 Liu等所合成的七种白杨素衍生物的抗氧化活性测试
Navarro等提取了叶下珠属植物叶子中的酚类物质,共得到20种化合物。其中的8种类黄酮类物质中有1种为白杨素衍生物,结构如图7所示。这些衍生物混合在一起进行了抗氧化活性测试,在DPPH自由基清除实验中,混合物的IC50为0.15 ± 0.01,远低于爵床质素B(14.28 ± 0.30)和抗环血酸(3.74 ± 0.05)。氧化自由基吸收能力(ORAC)试验测得的混合物抗氧化能力指数为(2.76±0.05),比爵床质素B(0.95±0.02)和抗坏血酸(1.62±0.07)明显增高[10]。杨芽黄素是天然黄酮类物质,与白杨素结构极其相似,结构如图8所示。Bian等在研究二芳基庚烷的抗氧化活性时,同样对杨芽黄素的抗氧化活性进行了DPPH测试。结果表明,杨芽黄素的IC50大于1000 μg/ml,即抗氧化活性较差,并分析可能与7号位羟基缺失有关[11]。
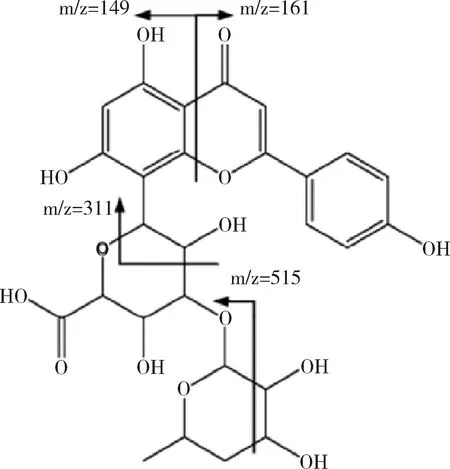
图7 Navarro等所提取得到的白杨素衍生物结构

图8 杨芽黄素的结构
1.2 抗缺氧 机体在缺氧状态下,会有大量的氧自由基产生,继而诱发脂质过氧化,最终导致机体的氧化损伤[12]。研究高原缺氧疾病的相关学者对白杨素进行结构修饰,以期能够用作治疗高原缺氧的药物。如图9所示,为了提高白杨素的水溶性,范小飞等合成了4种新型的三氮唑白杨素衍生物。通过建立小鼠缺氧模型,对这4种衍生物进行抗缺氧活性检测,证实这4种化合物均能延长小鼠的存活时间,其中1b和4b组小鼠的存活时间最高,分别为(42. 71±4. 89)和(40. 49±3. 59)min,甚至高于阳性药乙酰唑胺组的(36. 60±3.84)min[13]。
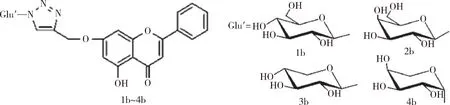
图9 范小飞等合成的4种三氮唑白杨素衍生物的结构
景临林等以白杨素为原料,先后合成了HPN和HEPN两种化合物,结构如图10所示,并先后验证了两个化合物对低氧状况下小鼠心脏氧化损伤的保护作用。结果表明,HPN和HEPN均可以明显升高缺氧小鼠的心脏组织中的SOD, CAT和GSH-Px的活性,降低活性氧(ROS)和MDA的含量。此外,两个化合物能够增加Nrf-1和OH-1的表达,进而维持了ATP酶的活性。此外,两个衍生物显著降低Caspase-3, Bax和Bcl-2的表达量及Bax/Bcl-2的比例[14]。此外,HPN在PC12细胞中以及HEPN在脑缺血大鼠中的抗氧化作用同样得到了证实[15-16]。同样以白杨素为先导化合物,陈莉莉设计合成了6种化合物,结构如图11所示。抗缺氧实验结果表明这些化合物均可以明显延长缺氧小鼠的存活时间、断头后小鼠的喘息时间以及亚硝酸钠中毒小鼠的存活时间,这证实了此6种化合物的抗缺氧作用,其中化合物a的抗缺氧效果最好[17]。

图10 HPN和HEPN的结构
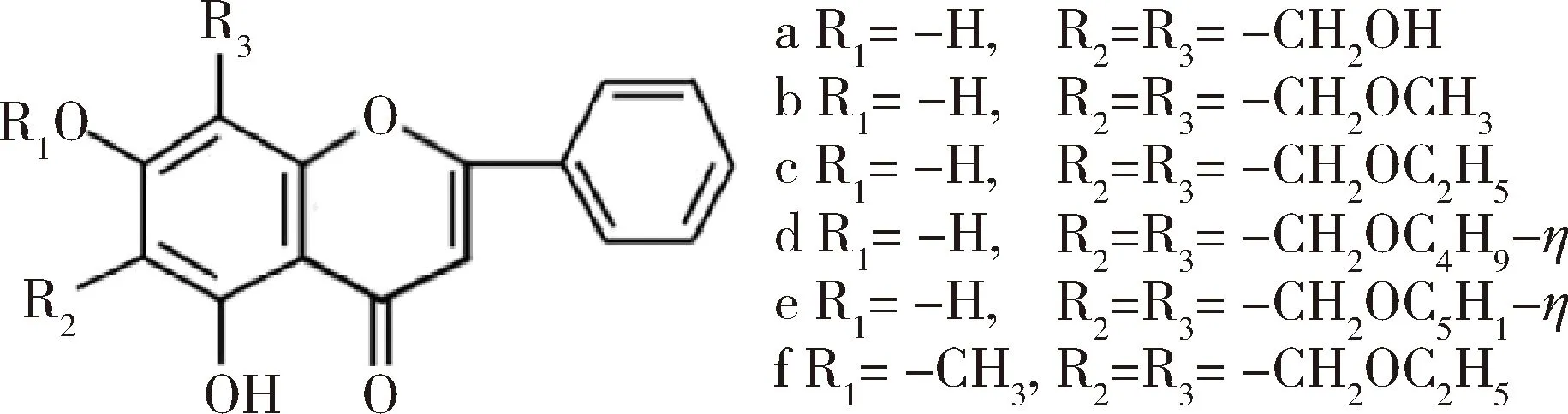
图11 白杨素羟甲基化衍生物的结构
1.3 抗癌 Leon等合成了白杨素和钒的复合物(VOchrys),结构如图12所示,证明了该化合物在MG-63人骨肉瘤细胞模型中的抗癌活性与在该细胞中抗氧化应激活性有着紧密联系[18]。上述Rahul V等合成的23种化合物除进行抗氧化活性筛选外,同样进行了抗癌活性筛选。结果与抗氧化结果相似,大部分化合物均表现出抗癌活性,其中7H, 7j, 7L和7O四种化合物抗癌活性最显著[7]。Monika等合成了白杨素衍生物5-羟基-7-甲氧基黄酮(HMF),结构如图13所示。ROS是内质网应激诱导的关键介质,可导致细胞内ca2+释放、JNK磷酸化和线粒体凋亡通路的激活。HMF处理人结肠癌细胞(HCT-116细胞)导致线粒体和细胞质ROS生成增加,抗氧化酶表达减少。在HMF处理后,IRE1-α的表达和JNK的磷酸化有明显的上调,ROS大量产生,从而调控线粒体介导的凋亡信号通路,上述结果表明HMF是一种可以通过促进癌细胞的氧化损伤继而治疗结肠癌的前景光明的药物[19]。
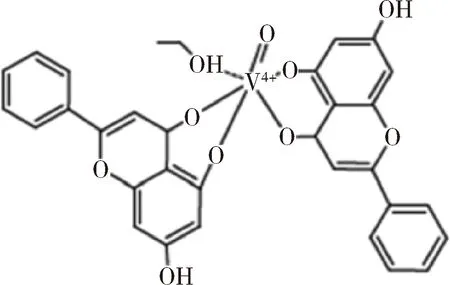
图12 VOchrys的结构
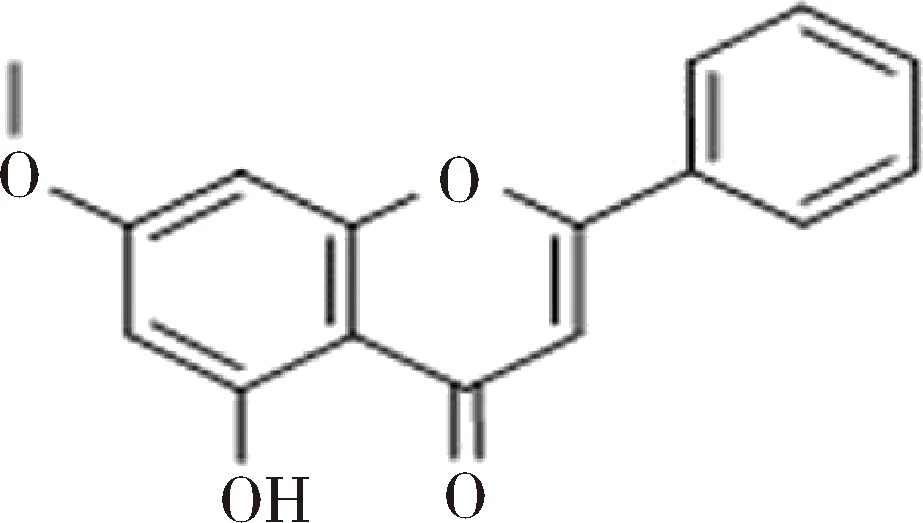
图13 HMF的结构
2 抗炎活性
2.1 抑制环氧化酶和抗癌 花生四烯酸的代谢过程可以产生多种具有生物活性物质,如前列腺素E2(PGE2)和血栓烷素A2(TXA2)等,这些产物广泛参与了机体的多种生理活动。环氧化酶(COX)是花生四烯酸(AA)代谢过程中的关键限速酶,对COX的影响可以间接控制花生四烯酸代谢产物的产生,继而调节机体多种生理过程。COX主要包括两种亚型,即COX-1和COX-2,COX-1主要为结构型酶,在多种组织或细胞中表达量恒定;而COX-2主要为诱导型酶,在正常组织中无表达或微量表达,而当细胞受到病理刺激时,COX-2的表达急剧上升,此现象通常被认为是COX-2对促炎介质的快速应答,即其在炎症发生的病理过程中扮演着重要角色[20]。而当前研究进一步证实对肿瘤细胞中COX-2的抑制作用,可以对肿瘤细胞产生生长抑制和凋亡[21]。
Singh 等将白杨素与吲哚或吡唑等结构进行拼合,构建了多种新型的白杨素杂合衍生物,结构如图14和表2所示。大部分杂合物能够选择性地抑制COX-2的活性,化合物23对COX-2和COX-1的IC50值分别为0.7和118 μmol/L,证明对两者的选择性明显;而对照药物吲哚美辛对COX-2和COX-1的IC50值分别为0.96和0.08 μmol/L,选择性远低于合成的衍生物。分子对接研究再次证明,化合物23能够对接到COX-2的活性位点,而不能与COX-1的活性位点结合[22]。Heeyeong等以白杨素为原料合成了4种衍生物,其中Ch-2和Ch-4对脂多糖诱导的小鼠Raw264.7巨噬细胞有着显著地抑制作用,而仅仅只有Ch-4能够显著抑制COX-2的活性,相比COX-1,其对COX-2有着明显的选择性。Ch-4对iNOS无明显作用,而Ch-2对iNOS有着微弱的抑制作用[23]。
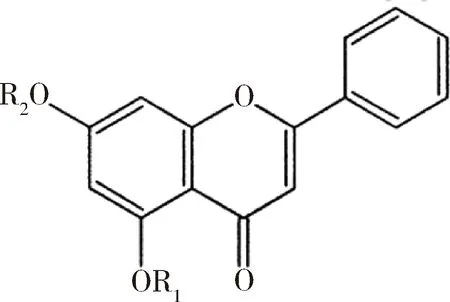
图14 Ch-12~Ch-5的结构

表2 Ch-2~Ch-5的R1和R2取代基
Lim等在其实验室前期合成的白杨素衍生物Wogonin的结构基础上,最新合成了白杨素衍生物C-721,Wogonin和C-721的结构如图15所示。Wogonin已经被证实能够抑制小鼠RAW 264.7巨噬细胞中COX-2和iNOS的活性[24],因此Lim等对C-721在小鼠RAW 264.7巨噬细胞中的抗氧化活性进行了检测。在脂多糖诱导的RAW 264.7巨噬细胞炎症模型中,C-721可以显著抑制COX-2酶的活性,继而降低前列腺素E2的含量;通过降低iNOS的活性,一氧化氮的含量随之降低;降低TNF- α和IL-6的产生[25]。
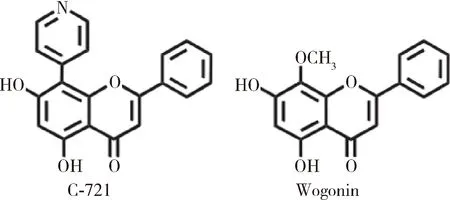
图15 C-721和Wogonin的结构
2.2 抗血小板活化和聚集 当血小板活化后,便启动了血小板内部的花生四烯酸代谢过程,代谢产物TXA2可以显著诱导血小板的进一步活化和聚集,是血小板活化过程中信号放大的关键因素[26]。如上文所说,炎症过程中COX-2大量表达,通过抑制COX-2的活性,就可以减少TXA2的产生,进而抑制了血小板的活化过程。为了进一步提高白杨素的抗血小板聚集活性,Ravishankar等合成了白杨素-钌配合物(29)和硫代白杨素-钌配合物(30),结构如图16所示,这些衍生物的生物利用度和细胞通透性相比白杨素均增加。与白杨素相比,化合物29显示出4倍于白杨素的抗血小板聚集活性,而化合物30的活性稍弱。纤维蛋白结合试验表明,两种化合物均能抑制血小板通过纤维蛋白进行结合,即它们能够显著抑制整合素αⅡbβ3通路[27]。
2.3 抗结肠炎、皮肤炎、关节炎 Song等通过γ辐射得到了羟乙基化的白杨素,结构如图17所示。在体外,通过脂多糖刺激来提高骨髓来源树突状细胞(BMDC)的氧化应激水平,与羟乙基白杨素或白杨素孵育后,细胞中促炎细胞因子水平、表面分子水平、抗原呈递能力和T细胞增殖/活化的水平均降低,相比白杨素,该衍生物抑制BMDC细胞成熟的效果更加明显。此外,羟乙基白杨素可以调控丝裂原活化蛋白激酶和核因子-κB蛋白的表达量。对小鼠灌胃8天,模型组给予脂多糖和生理盐水的混合物来诱导结肠炎模型,给药组给予脂多糖和羟乙基白杨素的混合物,结果表明羟乙基白杨素给药组结肠炎相关的炎症指标结果明显降低[28]。
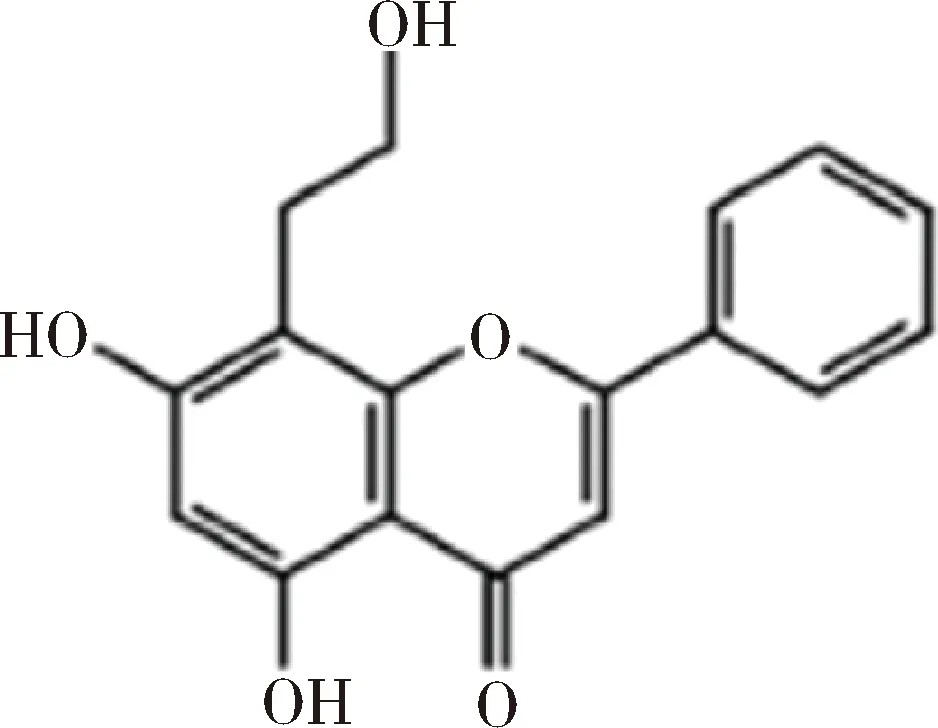
图17 Song等合成的羟乙基白杨素的结构

图18 CPD 6的结构
Yu等以白杨素为原料,合成了9种化合物,并主要对化合物6(CPD6)进行抗炎活性测试。在脂多糖诱导的巨噬细胞氧化损伤模型中,CPD6能够显著抑制一氧化氮等炎症因子,对一氧化氮的半数有效浓度为3.613 μM。在培养的角质细胞中,CPD6同样显著抑制了炎症细胞因子的释放,以及NF κ B和JAK2/STAT1 信号通路,并激活Nrf2 / HO-1信号途径。在小鼠急性和慢性皮肤炎模型中,CPD6对上述指标有着明显的抑制作用[29]。Kim对C-721同样进行了体内实验,口服和腹腔注射10 - 100 mg·kg-1时,对角叉菜胶诱导的小鼠足肿胀模型分别有25.2%和44.3%的抑制作用。此外,当小鼠腹腔注射50 mg·kg-1, 3 次/周时,该化合物对胶原诱导的关节炎有显著的抑制作用[25]。
2.4 抗癌 Byun等合成了白杨素衍生物CM1,结构如图19所示,为研究其抗癌活性及机制,使用脂多糖(LPS)诱导形成RAW 264.7巨噬细胞炎症模型。LPS刺激后,巨噬细胞内释放出大量的促炎介质,细胞因子TNF-α和IL-6以及一氧化氮(NO)含量明显上升,丝裂原活化蛋白激酶家族(MAPK)和NF-κB信号通路被激活,而CM1可以显著降低这些炎症指标。此外,CM1能够剂量和时间依赖性地提高Toll样蛋白相互作用蛋白(Tollip)的表达,通过流式检测发现细胞表面分子(CD80、CD86和MHC)的表达显著降低,TNF-α和IL-6含量以及COX-2与iNOS蛋白表达量显著降低,上述结果说明CM1具有良好的抗炎活性,并因此具有潜在的抗肿瘤活性[30]。Byun等另外合成了白杨素衍生物CM2,结构如图19所示,在二硝基氯苯诱导的小鼠皮肤炎模型中,炎症因子IL-5、IL-4、IFN-γ和IL-17被CM2显著抑制。此外在巨噬细胞中,CM2能够明显抑制Lps诱导的IL-6等炎症因子的分泌。CM1对巨噬细胞存在一定的毒性作用,而CM2对巨噬细胞无明显毒性损伤,因此CM2更具备开发价值[31]。

图19 CM1和CM2的结构
Mahaboob等合成了二甲氧基黄酮(dimethxy flavone, DMF),结构如图20所示。该衍生物在早期肝癌大鼠模型中显著抑制n -亚硝基二乙胺(DEN)诱导的大鼠肿瘤前病变的发生,机制在于DMF对DEN诱导的肿瘤前结节中炎症介导的Wnt通路、NF-kB通路以及凋亡相关基因含量有显著影响。相比于对照组,DEN处理组COX-2和iNOS明显增加,p53、caspase-3和bax等凋亡介导因子明显减少。DMF (100 mg·kg-1)组可抑制肝结节发生率和多发率分别达82%和78%,DMF还逆转了NF-kB和Wnt通路的激活和蛋白的表达降低。本研究的结果表明,DMF的化学预防作用可能与Wnt通路的衰减和NF-kB与COX-2介导的炎症反应的抑制有关[32]。

图20 二甲氧基黄酮的结构
3 展 望
新兽药研发过程具有周期长、前期化合物合成与筛选过程工作量大、耗费资金量大等特点,因此,如能以某一具有良好药理活性的化合物为基础,进行结构改造,则可以大大简化研发难度,并提高研发成功率。白杨素就是这样一个良好的结构母体,其拥有广泛的药理作用,但受困于不溶于水、生物利用度低、口服给药会产生严重的“首过效应”等原因无法继续开发。科研人员对白杨素进行了多种结构修饰的尝试,主要包括磺化、硝化、烷基化、酯化、磷酰化等,以期在保留白杨素广泛的药理活性的同时,获得更好的实用价值。关于白杨素衍生物的报道日益增多,已经合成且已经完成活性初筛的化合物众多,但新兽药研发领域未见有研究团队涉足白杨素衍生物的研发。针对人药禁止兽用的现状,新兽药研发过程更显重要,而白杨素具有多种药理活性,合成产生的白杨素衍生物可进行多方面的活性筛选,有希望在多个药理活性方向上有所收获。如前文所述,所列出的白杨素衍生物具有良好的抗炎或抗氧化活性,部分化合物同时具有抗癌或抗血小板聚集活性,可基于这些衍生物的结构进行宠物抗炎、抗血小板聚集或抗癌药的开发。其中表一所示的4号化合物抗氧化效果最好,CM2(结构如图19所示)抗炎效果非常显著,ch-4(结构如图14和表2所示)可以选择性抑制环氧化酶的COX-2亚型,在表现出较强的抗炎活性的同时还具有抗癌和抗血小板聚集活性,基于上述三个衍生物的结构改造值得重点关注。此外,白杨素除了本文所介绍的抗氧化和抗炎活性之外,还具有良好的抗菌活性。针对严峻的细菌耐药性现状,以白杨素为母体的抗菌药物研发同样具有可能性。
白杨素药理活性众多,其改造后的衍生物是否同样具有广泛的药理活性值得验证,而目前存在的主要问题是许多已表明某方面明显药理活性的水杨素衍生物,却没有对其它药理活性的研究。这主要表现在大多数白杨素衍生物均会进行抗癌或抗肿瘤活性筛选,却忽略了其它的药理活性的验证,无显著抗癌或抗肿瘤活性的化合物可能是拥有其它药理活性的良药。基于炎症和氧化应激在机体疾病发生发展历程中的重要作用,本文对具有抗炎和抗氧化作用的白杨素衍生物进行综述,同时也倡导科研人员将合成的白杨素衍生物除了抗癌活性筛选外,也对其抗炎、抗氧化活性进行筛选,进一步判断新化合物是否具有广泛的药理活性。本文通过对相关白杨素衍生物的化学结构进行展示,在此衷心希望通过本文能引起兽药研发人员对白杨素或白杨素衍生物的重视,一定程度上促进基于白杨素或白杨素衍生物的兽药研发过程,愿本文能对这一过程提供思路和信息支持,最后祝愿通过对白杨素或白杨素衍生物的结构修饰,能够开发得到用于兽医临床的专属新兽药。

