阿胶不同酶解物HPLC指纹图谱建立
付英杰, 王 肖, 贾玉民, 侯 林, 王建安, 于定荣, 赵颖异
(1.济宁医学院药学院,山东 日照 276826;2.东阿阿胶股份有限公司,国家胶类中药工程技术研究中心,山东 聊城 252201;3.山东中医药大学药学院,山东 济南 250355;4.中国中医科学院中药研究所,北京 100700)
阿胶是传统动物药,主含胶原蛋白[1]。由于加工时间长、步骤繁琐、辅料多,工艺指标难以量化,成分复杂,产品为随机结构的水解物。阿胶中所含成分是蛋白质、肽和氨基酸,还含有丰富的微量元素[2],其中小肽段组分为阿胶等动物药的药效物质基础[3-4]。
目前国内外对胶剂质量控制方法各有优缺点。HPLC法精密度高,但耗时长、样品处理难度较大;HPLC-MS法灵敏度最高,但需要大型数据库的支持,分析费用昂贵[5-6];普通凝胶电泳法简单快速,但由于胶剂的分子量是在一个范围,因而普遍存在精密度较低、条带模糊的现象[7-8]。其他方法各有其理论及假说支持[9-16],但相关设备的普及性尚显不足。2015年版《中国药典》采用MS法对阿胶进行质量控制[1]。研究胶剂时发现中药胶剂水溶液的普通SDS-PAGE电泳谱有2~4条模糊条带,鉴定依据不足,然而其胰蛋白酶水解液的Tricine-SDS-PAGE电泳谱出现多条固定位置的细条带,且采用不同酶对动物胶进行水解,由于不同蛋白酶的酶切位点不同,条带位置具有一定差异。该法可对不同物种(阿胶、鹿角胶、龟甲胶)胶剂进行分辨,但无法分辨不同厂家相同物种胶剂,且方法较繁,精细度不足,仅作为胶剂定性鉴别思路之一[8]。
采用不同蛋白酶对中药胶剂进行酶解,取不同蛋白酶的酶解产物作为样品进行HPLC特征谱带研究,相当于把1个样品划分为多个样品,其显示的信息量是单一药材的多数倍,且由于酶切位点固定,样品会按照酶解规律进行裂解,成为固定的低分子量肽,如能进行分离,则可显示其指纹特征性。
1 材料
α-糜蛋白酶(批号B604BA0026,1 000 U/mg)、胰蛋白酶(批号C119BA0026,≥300 U/mg)木瓜蛋白酶(批号B709BA0015,≥3 500 U/mg)、胃蛋白酶(批号B326BA0296,3 000 U/mg)、胰糜蛋白酶(批号B329BA0126,2 400∶400 U/mg)均购于生物工程(上海)股份有限公司。阿胶(山东东阿阿胶股份有限公司,批号1305077、1407017、1505039)。其余试剂均为色谱纯。
PH-3E酸度计(南京桑力电子设备厂);岛津LC-20A高效液相色谱仪[岛津国际贸易(上海)有限公司];SYC-15c超级恒温水浴(南京桑力电子设备厂)。
2 方法
2.1 酶解液的制备 阿胶加纯水加热配成体积分数为5%的溶液,40 ℃水浴中酶解4 h,制成胃蛋白酶酶解液(将pH调至2.0,加胃蛋白酶10万U/g)、胰蛋白酶酶解液(将pH调至8.0,加胰蛋白酶5 000 U/g)、木瓜蛋白酶酶解液(将pH调至6.0,加木瓜蛋白酶10万U/g),接着于95 ℃水浴中灭活20 min,冷却后依次使用脱脂棉、定量滤纸和0.45 μm微孔滤膜进行过滤,得阿胶酶解物样品。
2.2 色谱条件 Dikma C18色谱柱;流动相0.2 mol/L Na2SO4-H3PO4(pH 2.3)(A)-90%乙腈(B),梯度洗脱(0~5 min,90%~84%B;5~25 min,84%~72%B;25~35 min,72%~60%B;35~40 min,60%~48%B);体积流量1 mL/min;进样量20 μL;检测波长280 nm。
2.3 酶种类的筛选 拟筛选蛋白酶种类有胃蛋白酶(切断氨基或羧基端为芳香族氨基酸或亮氨酸的肽键)、胰蛋白酶(选择性的水解蛋白质中由赖氨酸或者精氨酸的羧基所构成的肽链)、木瓜蛋白酶(切断L-精氨酸、L-赖氨酸、甘氨酸、L-瓜氨酸残基羧基参与形成的肽键)、糜蛋白酶(切断多肽链中的芳香族氨基酸残基的羧基一侧)、胰糜蛋白酶。糜蛋白酶酶解条件为pH 8.0,加酶量25 000 U/g;胰糜蛋白酶酶解条件为pH 8.0,加酶量25 000 U/g。
2.4 蛋白酶用量的考察 按“2.1”项下方法,分别制备胃蛋白酶、胰蛋白酶、木瓜蛋白酶酶解液。以峰形、分离度等为指标,筛选出蛋白酶的用量。
2.5 干扰因素考察 辅料干扰,由于阿胶在制作过程中加入了黄酒、豆油、冰糖,因此,需要考虑将这些干扰因素去除,因样品为水溶液,且经过脱脂棉过滤,已经去除了油脂,所以辅料干扰主要为黄酒和冰糖;试剂干扰,由于在酶解过程中加入了NaOH调节pH,所以可能会有试剂的干扰峰;蛋白酶的干扰[17]。
按“2.1”项下方法,分别制备黄酒、冰糖(5 g)、黄酒+冰糖、NaOH(pH 8.0)、纯水、NaHCO3(pH 8.0)的胰蛋白酶酶解液,以及NaOH (pH 8.0)水溶液、4种酶的水溶液。上述样品均配制5 mL,以确定干扰峰。
2.6 精密度试验 按“2.1”项下方法,分别制备阿胶的胃蛋白酶、胰蛋白酶、木瓜蛋白酶酶解液。按“2.2”项下色谱条件进样测定,通过中药色谱指纹图谱相似度评价系统软件,以S1为参照图谱,时间窗为0.2 min,进行全谱峰匹配,然后计算相似度,酶解液相似度分析结果应达到0.90以上,且主要色谱峰的保留时间及峰面积RSD<5%。
2.7 稳定性试验 按“2.1”项下方法,分别制备胃蛋白酶、胰蛋白酶、木瓜蛋白酶酶解液,当日不进样的样品迅速冷冻,在第2、3、4、5天融化后分别进样。以第1天色谱图作为对照,考察同一批阿胶在制成样品后的稳定性。
2.8 重现性试验 按“2.1”项下方法,分别制备胃蛋白酶、胰蛋白酶、木瓜蛋白酶酶解液。以相似度为指标,考察使用不同C18色谱柱、不同人员进行HPLC获得色谱图的重现性。
2.9 验证性试验 随机称取3批次的阿胶各10 g,按“2.1”项下方法,分别制备胃蛋白酶、胰蛋白酶、木瓜蛋白酶、糜蛋白酶酶解液,按“2.2”项下色谱条件进样测定。截取5~40 min色谱图,扣除掉干扰进行结果分析。
3 结果
3.1 酶种类的筛选 由图1可知,胰蛋白酶、木瓜蛋白酶、糜蛋白酶酶解液分离出较多峰,其次为胃蛋白酶,而胰糜蛋白酶有较多小峰,难以与噪音区分,这是因为双酶合用,酶解后形成的肽分子量小,且酶解产物更不稳定,因此弃用胰糜蛋白酶。

注:S1为胃蛋白酶酶解,S2为胰蛋白酶酶解,S3为木瓜蛋白酶酶解,S4为糜蛋白酶酶解,S5为胰糜蛋白酶酶解。
3.2 蛋白酶用量的考察 由图2可知,胃蛋白酶用量在1×105U/g以下时,峰形有变化,加大酶量,峰形基本不变。因此,胃蛋白酶加酶量选择为1×105U/g。同理,胰蛋白酶为25 000 U/g,木瓜蛋白酶为3×105U/g,糜蛋白酶为 25 000 U/g。

注:A为胃蛋白酶酶解,B为胰蛋白酶酶解,C为木瓜蛋白酶酶解,D为糜蛋白酶酶解。S1为原酶量(胃蛋白酶的原酶量为1×105 U/g,胰蛋白酶的原酶量为5 000 U/g,木瓜蛋白酶的原酶量为1×105 U/g,糜蛋白酶的原酶量为5 000 U/g),S2为3倍原酶量,S3为5倍原酶量,S4为1/5倍原酶量,S5为7倍原酶量。
3.3 干扰因素排除 由图3~4和表1可知,辅料黄酒在9.0、13.6、14.9、17.1 min出峰,冰糖在8.9、11.8 min出峰,峰面积较大,按阿胶中含有0.5%辅料量进行计算,其峰面积均应在10 000以下,对阿胶酶解液的低肽或蛋白出峰干扰可忽略不计;而试剂水、NaOH、NaHCO3在整个过程中并没有出峰,说明辅料及试剂对阿胶特征峰没有干扰。胰蛋白酶除在19.8 min处有一小的干扰,其他峰面积均小于10 000,其干扰可以忽略不计;胃蛋白酶在12.0 min处有一干扰峰;糜蛋白酶在10.4、12.0、14.6 min处有3个干扰峰;木瓜蛋白酶效果较差,在7.1、9.1、12.3、12.8、14.2、15.0 min有6个干扰峰,因此在后续试验中,需要扣除掉这些干扰峰。

注:S1为黄酒的胰蛋白酶酶解液,S2为冰糖的胰蛋白酶酶解液,S3为黄酒+冰糖的胰蛋白酶酶解液,S4为NaOH的胰蛋白酶酶解液,S5为纯水的胰蛋白酶酶解液,S6为NaOH水溶液,S7为NaHCO3的胰蛋白酶酶解液。

注:S1为胃蛋白酶空白,S2为胰蛋白酶空白,S3为木瓜蛋白酶空白,S4为糜蛋白酶空白。
3.4 精密度试验 同一批样品连续测定,扣除酶干扰,选取时间窗0.2 min,匹配数目6。所有峰的保留时间RSD均<2%,峰面积RSD除木瓜蛋白酶8.25 min处外均在2%~10%。木瓜蛋白酶6次试验中5次相似度>0.9,胰蛋白酶和糜蛋白酶精密度及相似度均符合要求。胃蛋白酶的相似度不达标,在15~40 min处出现基线漂移,但5~12 min峰形重复较佳。
3.5 稳定性试验 在相同条件下于不同日期对阿胶样品进行检测,峰形逐渐发生变化,相似度逐渐下降,以相似度<0.9为依据,胰蛋白酶、木瓜蛋白酶、糜蛋白酶酶解物分别在2、4、3 d之后不可用,因此,样品最好当日或第2天进样。

表1 各种干扰成分对比参数
3.6 重现性试验 分别采取不同型号的色谱柱和3名试验人员分别对4种酶解物进样5次,峰形不变,所有样品相似度均>0.9,表明方法重现性良好。
3.7 验证性试验 按匹配数目3、时间窗为0.2 min,并扣除酶干扰。胃蛋白酶特征峰为6.6 min,保留时间RSD为5.33%,峰面积RSD为22.6%,相似度均<0.9,不符合要求。胰蛋白酶特征峰在6.5、11.3、11.5、12.4 min处,保留时间RSD分别为1.19%、0.42%、0.42%、0.41%,峰面积RSD分别为24.96%、4.43%、14.82%、27.54%,相似度均>0.9。木瓜蛋白酶特征峰在10.9、11.3、11.8 min处,木瓜蛋白酶空白峰分布于9~15 min,干扰较大、峰形杂乱,保留时间RSD分别为0.2%、1.44%、1.91%,峰面积RSD分别为19.45%、27.3%、18.09%,相似度均>0.9。糜蛋白酶特征峰在13.0、13.4、13.8、15.1、18.2、33.6 min处,保留时间RSD分别为0.47%、0.51%、0.47%、0.45%、0.41%、0.19%,峰面积RSD分别为9.89%、9.24%、9.84%、14.64%、23.18%、5.36%,相似度均>0.9。见表2、图5。
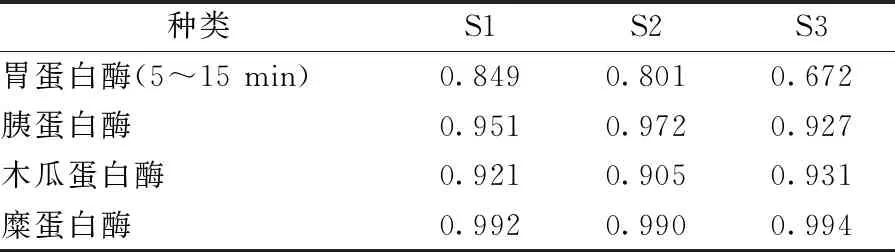
表2 验证性试验相似度结果
4 讨论
中药植物药指纹图谱的特征峰RSD小于5%[18]。蛋白类色谱图通常分离度较差[19]。在重现性试验中,由于不同色谱柱的保留时间有差异,难以调整T值一致,但采用调整时间窗为0.2,以相似度为指标,来判定峰形的一致性。本研究中流动相的酸及盐浓度均较高,对于普通C18色谱柱具有一定磨损。

图5 验证性试验东阿阿胶HPLC色谱图
尽可能获得酶解程度一致的样品,这就需要使用蛋白酶充分水解阿胶药材以获得成分较为稳定的小肽。基于此,选用蛋白酶酶解的最长时间4 h,以及最适pH值以获得蛋白酶的最大活力。
针对阿胶质量控制上样品信息不全面以及指纹图谱空缺,通过多种蛋白酶酶解物,无需质谱,仅需使用原有液相仪器即可。由于使用多酶解物样品进样,且方法为指纹图谱而非单一成分,掺假难度极大,对打击混伪品有较大的应用价值。采用不同蛋白酶的酶解产物作为样品进行特征谱带研究,其信息量更大,且由于酶切位点固定,各样品的酶解物组成相对稳定。
本研究为后续进行的酶解物-HPLC法对阿胶的特征峰及规律研究提供方法学基础,并为中药胶剂的质量评价提供一种新思路。

