糖尿病足手术中行超声联合神经刺激仪引导下前入路坐骨神经及股神经阻滞的临床应用价值
方凯凯,王国军
糖尿病(diabetes mellitus,DM)患者因周围神经病变与外周血管疾病合并过高的机械压力,常伴有诸如神经病变性骨折、血管疾病、溃疡等一系列的足部问题[1]。糖尿病足(diabetic food,DF)是DM患者最常见且较严重的并发症之一[2]。目前针对踝部手术患者一般采取下肢椎管内麻醉的方式,但由于DF患者年龄较大、凝血功能异常,且该方法存在血流动力学紊乱、神经损伤等风险,使得椎管内麻醉的临床使用受到极大限制。相比较而言,传统的神经阻滞麻醉技术具有对患者血流动力学影响小,且可提供完善的术后镇痛等优点,但其易导致组织不全或误入血管等并发症[3]。近年来,随着超声可视化技术的进步及神经刺激仪的推广使用,超声联合刺激仪引导下神经阻滞技术也逐渐被患者所接受。它使得传统盲探的神经阻滞变得可视化、动态化,极大提高了神经阻滞成功率。坐骨神经阻滞是下肢手术最常用的神经阻滞技术[4]。临床上坐骨神经阻滞一般经过后入路进行穿刺,但需要患者处于俯卧位或侧卧位,而对于DF患者,改变体位可能增大神经损伤等风险。前入路坐骨神经阻滞避免了改变体位的风险。股神经阻滞是将局部麻醉药物注射入股神经附近达到阻滞股神经控制区域感觉的目的,该方法已广泛应用于膝关节手术的镇痛[5]。目前关于DF手术中超声联合神经刺激仪引导下前入路坐骨神经及股神经阻滞的研究较少,因此笔者研究主要探讨DF手术中使用该种联合方式麻醉的临床疗效,旨在为减少患者术后疼痛提供理论基础及为麻醉医生提供麻醉新思路。
1 资料与方法
1.1 临床资料
选择2016年6月至2019年4月于东部战区空军医院行DF手术的DM患者100例,其中男性58例,女性42例;年龄55~85岁,平均年龄56.78岁(标准差6.01);身高158~174 cm;体质量指数(body mass index,BMI)18.4~26.8 kg/m2;DM病程5.80~14.53年;创面大小25.07~38.40 cm2;美国麻醉医师协会(American Standards Association,ASA)分级Ⅱ级44例,Ⅲ级56例;高血压36例,高脂血症37例,其他27例。笔者研究经医院伦理委员会批准,患者及家属对该研究知情并自愿签署知情同意书。
选择标准:①年龄55~85岁;②ASA[6]分级标准Ⅱ~Ⅲ级。
排除标准:①穿刺部位感染、血肿;②精神障碍不能合作;③药物过敏;④患血液系统疾病或凝血功能异常。
依据随机数字表法将患者分为坐骨神经及股神经阻滞组(观察组)和单次蛛网膜下腔阻滞组(对照组),每组50例。观察组男性30例,女性20例;年龄55~82岁,平均年龄56.28岁(标准差5.87岁);身高158~172 cm,平均身高167.54 cm(标准差5.69 cm);BMI 18.4~26.5 kg/m2,平均BMI 27.7 kg/m2(标准差2.1 kg/m2);DM病程6.22~13.15年,平均病程10.34年(标准差6.02年);DF病程5.39~12.46 d,平均病程8.02 d(标准差2.28 d);创面大小25.91~38.40 cm2,平均创面大小33.28 cm2(标准差7.42 cm2);ASA分级Ⅱ级23例,Ⅲ级27例;高血压18例,高脂血症20例,其他12例。
对照组男性28例,女性22例;年龄59~85岁,平均年龄57.28岁(标准差6.12岁);身高159~174 cm,平均身高168.22 cm(标准差7.41 cm);BMI 19.6~26.8 kg/m2,平均BMI 22.1 kg/m2(标准差2.3 kg/m2);DM病程5.80~14.53年,平均病程11.28年(标准差7.85年);DF病程5.51~12.97 d,平均病程8.47 d(标准差2.19 d);创面大小25.07~37.29 cm2,平均创面大小31.14 cm2(标准差8.06 cm2);ASA分级Ⅱ级21例,Ⅲ级29例;高血压18例,高脂血症17例,其他15例。
两组性别、ASA分级、合并症、年龄、身高、BMI、DM病程、DF病程、创面大小比较,差异无统计学意义(χ2=0.164、0.162、0.577,t=0.834、0.515、0.199、0.672、1.007、1.381;P>0.05)。
1.2 方法
1.2.1 麻醉方法
患者进入手术室,常规检测各项体征及做好术前准备。神经阻滞局部麻醉药物:0.375%罗哌卡因(AstraZenca)+0.5%利多卡因(上海朝晖药业有限公司,中国)30 mL。
观察组:行超声(S9。SonoScape,中国)联合神经刺激仪(HNS11。Stimuplex,德国)引导下前入路坐骨神经及股神经阻滞。使用实时超声扫描引导,并使用神经丛刺激仪辅助。将患者处于仰卧位,超声探头(探头频率为6~13 MHz)置于腹股沟尾侧7.5 cm左右,定位股神经和坐骨神经的重要标志性结构。使用80 mm神经刺激针,设置神经刺激仪电流1.0 mA,利用平面内短轴技术分别行股神经、坐骨神经阻滞,待针尖到达目标区域,再将电流调到0.3 mA,在神经周围注射麻醉药物15 mL,坐骨神经和股神经共30 mL。
对照组:行单次蛛网膜下腔阻滞,患者处于左侧卧位,于L3~4行蛛网膜下腔穿刺,于10~13 s注入2 mL 0.5%罗哌卡因,恢复平卧位。
1.2.2 观察指标
记录麻醉前(Tb)、麻醉后5 min(T5)、麻醉后10 min(T10)、麻醉后15 min(T15)、麻醉后30 min(T30)的收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)和心率(heart rate,HR);记录麻醉操作时间(anesthesia operation time,OT)(皮肤消毒开始到局部麻醉药物注射结束)、手术等待时间(surgery waiting time,SWT)(皮肤消毒开始到阻滞效果完善)、首次镇痛时间(first analgesic time,FAT)(手术开始到患者首次镇痛)、首次自主排尿时间(time of first spontaneous urination,FUT)(手术开始到患者首次自主排尿);记录术后麻醉并发症及不良反应发生情况;记录麻醉满意度[7](不满意:镇痛不全,需辅助镇痛;满意:麻醉效果好,无需辅助镇痛)。
分别于术后6、12、18、24 h时使用视觉模拟量表(visual analogue scale,VAS)评分[8]评定两组患者治疗后的疼痛程度,分值为0~10分,分数越高表示疼痛越强,0分为无痛,10分为最剧烈疼痛。
1.2.3 术后随访
术后通过门诊及电话随访1年,首次随访为术后1个月,之后于第3、6、12个月分别随访1次。随访内容包括患者全身情况、伤口愈合、溃疡复发、死亡等。
1.3 统计学方法
使用SPSS 19.0进行数据统计,计数资料和计量资料分别使用百分比和均数±标准差表示,组间比较分别使用卡方检验和Fisher精确检验及独立t检验,组内比较使用配对t检验,组间多个时间点比较使用重复测量数据的方差分析。使用Kaplan-Meier生存曲线观察随访1年预后复发率,Cox回归比例风险模型分析患者的预后复发影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 两组血流动力学比较
麻醉前(Tb),对照组患者的SBP、DBP、HR与观察组差异无统计学意义(P>0.05);在T5、T10、T15、T30,对照组SBP、DBP均明显低于观察组,差异有统计学意义(P<0.05),观察组SBP、DBP、HR与Tb差异均无统计学意义(P>0.05);对照组SBP、DBP均较Tb下降(P<0.05),HR差异无统计学意义(P>0.05)。见表1。

表1 两组血流动力学比较Tab.1 Comparison of hemodynamics between 2 groups
2.2 两组麻醉情况比较
与对照组相比,观察组OT、SWT和FAT均明显延长,FUT明显缩短,差异均有统计学意义(P<0.01)。见表2。
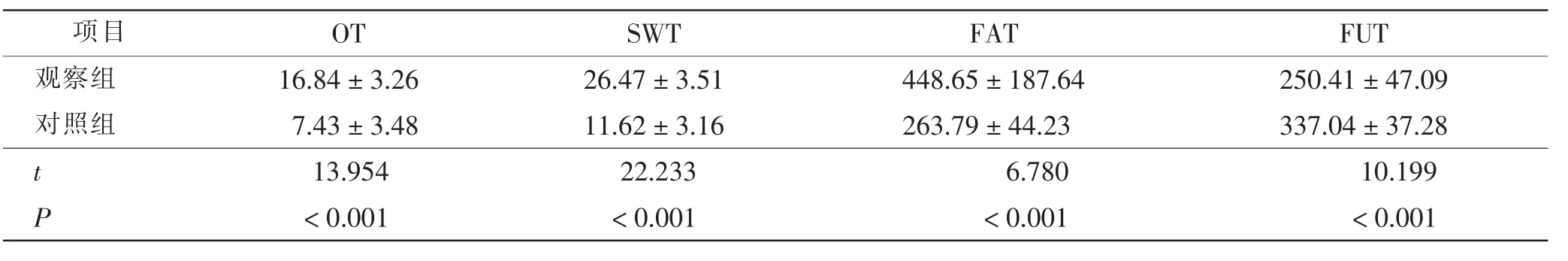
表2 两组麻醉情况比较minTab.2 Comparison of anesthesia between 2 groups min
2.3 两组术后视觉模拟量表评分比较
与对照组相比,观察组患者在术后12、18、24 h的VAS评分均明显降低,差异均有统计学意义(P<0.01)。见表3。
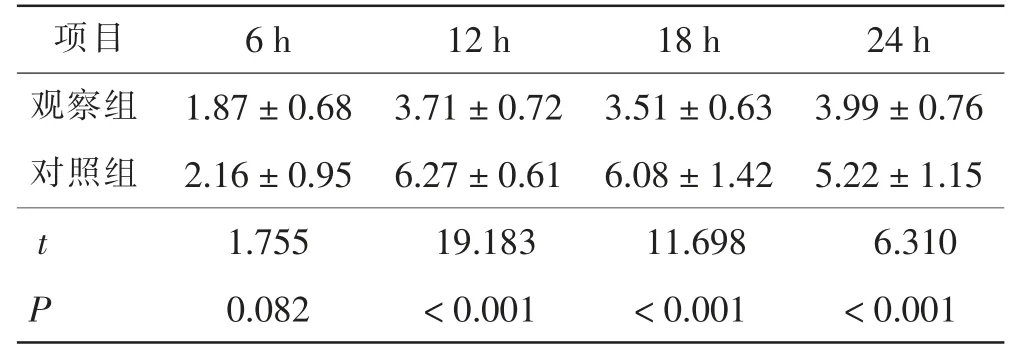
表3 两组术后VAS评分比较 分Tab.3 Comparison of VAS score after surgery between 2 groups scores
2.4 两组麻醉满意度、并发症及术后不良反应发生率比较
对照组满意48例(96%),观察组满意49例(98%),两组满意度差异无统计学意义(P>0.05);两组均无并发症发生。与对照组相比,观察组不良反应发生率明显降低,且差异具有统计学意义(P<0.05)。见表4。
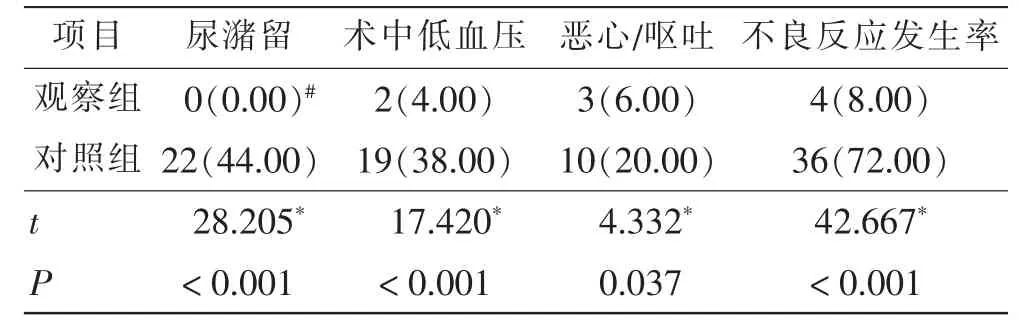
表4 两组术后不良反应发生率比较 例(%)Tab.4 Comparison of incidence of adverse reactions after surgery cases(%)
2.5 两组术后复发情况比较
随访期1年,无失访及死亡病例。观察组35例未复发,15例复发,未复发率为70.00%;对照组27例未复发,23例复发,未复发率为54.00%。观察组未复发率明显高于对照组(P<0.05)。见图1。
2.6 Cox比例风险回归模型分析术后复发影响因素
Cox比例风险模型分析临床病理因素及麻醉方式对DF患者术后复发情况的影响。结果显示,术后VAS评分和麻醉方式是影响术后复发的关键风险因素(P<0.05)。见表5。
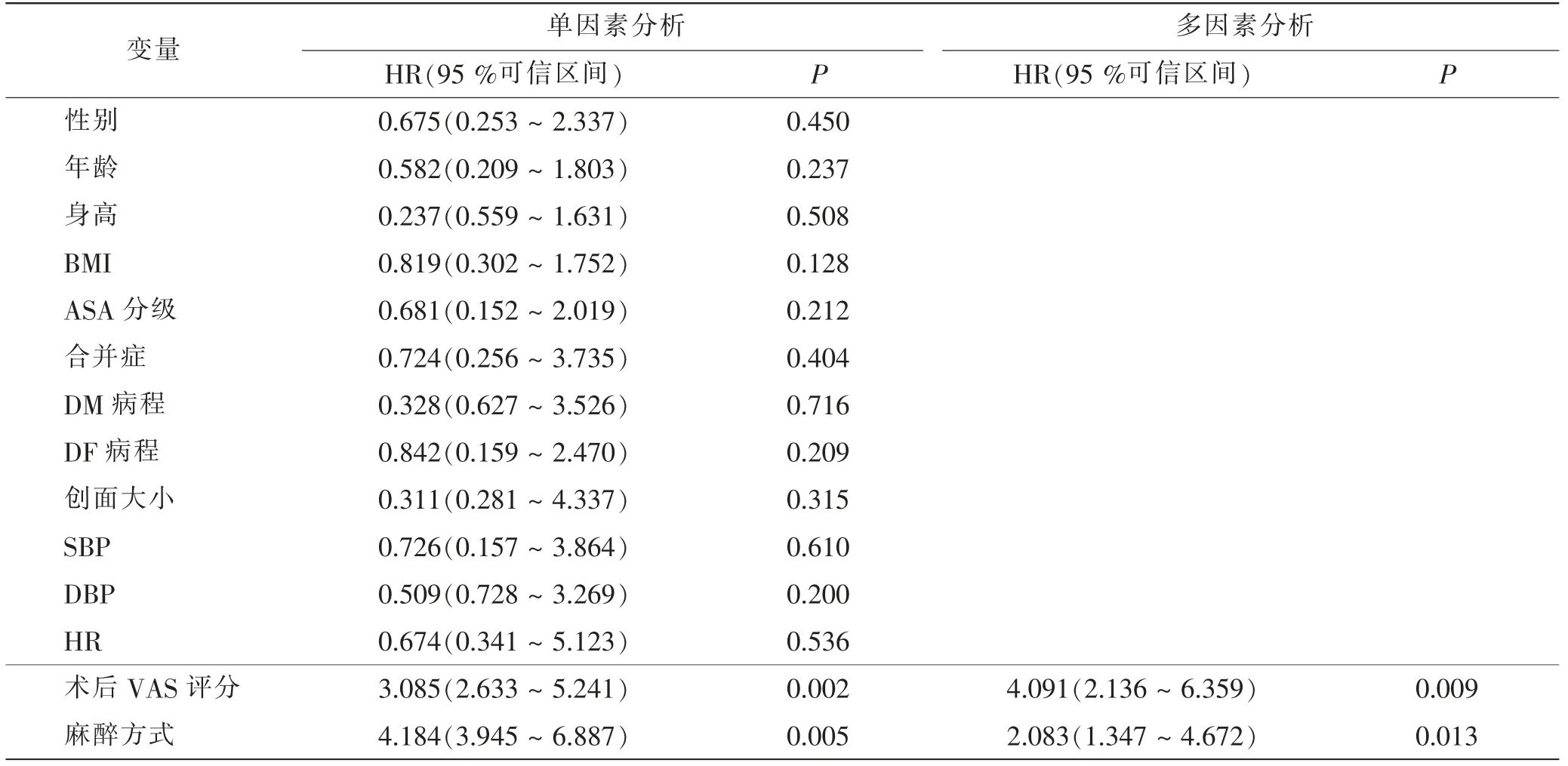
表5 Cox比例风险回归模型分析术后复发影响因素Tab.5 Analysis of recurrence influencing factors by Cox proportional hazard regression model
3 讨论
中国DM患者呈逐年递增趋势,其中有12%~25%的DM患者并发DF[9]。DF是DM较常见的并发症之一,截肢率和病死率较高[10]。其主要发病原因是DM患者体内的高糖环境干扰了末梢神经及微环境,引起远端肢体感知能力减弱,皮肤溃破,难以愈合,进而导致足部溃疡,增加患者疼痛并造成行动不便[11]。DF一旦内科保守治疗无效,便需要进行外科手术治疗。临床上高龄患者逐年递增,常合并外周神经病变,心、脑、肺部疾病等,且各重要脏器功能较差,增加了手术麻醉难度。由于全身麻醉存在较多的术后呼吸循环并发症,故临床上主要使用椎管内麻醉,但该种方式存在穿刺困难、需留置导尿管、长期服用抗凝剂、对患者生理状态影响较大等制约因素,因此也不是DF患者最优选。近年来,随着超声在麻醉科的广泛推广使用,为麻醉科医生提供了麻醉新思路。
胫神经和腓神经是坐骨神经的分支,支配着人体的足踝部感觉。隐神经是股神经的分支,支配着人体足内侧和踝关节内侧区域的感觉。因此股神经联合坐骨神经阻滞既可避免椎管内麻醉的风险,又能满足足踝部手术的麻醉需求。有研究报道[12],俯卧位下腘窝坐骨神经联合隐神经阻滞可满足DF手术麻醉要求,但在麻醉过程中需变换体位,给DF患者带来麻醉风险。前入路坐骨神经和股神经阻滞只需患者仰卧位,患侧大腿稍外旋,即可完成麻醉操作。但前入路坐骨神经阻滞位置深,操作难度大。笔者研究使用超声联合神经刺激仪引导,阻滞过程可视化,使得前入路坐骨神经和股神经阻滞更加简便安全。
笔者研究从麻醉时间、血流动力学、术后疼痛等方面对该种麻醉方式进行评价发现,行联合神经阻滞的操作时间要比行单次蛛网膜下腔阻滞麻醉的操作时间长。王靖宇等[13]在探讨联合神经阻滞在下肢手术中的临床疗效中发现,排除转换患者体位及识别超声图像的耗时,联合神经阻滞操作时间仍要比脊髓麻醉操作时间长,可能原因是联合神经阻滞技术需阻滞多支神经,因此比较耗时。单次蛛网膜下腔阻滞通常会发生不同程度的血压下降且HR减慢,这主要与去交感的皮区水平和程度成正相关[14]。笔者研究发现,与行单次蛛网膜下腔阻滞患者相比,行联合神经阻滞患者的SBP、DBP和HR在术中麻醉过程中均较稳定。疼痛是一种具有保护性的可被感知的反射,但若不能在术后早期控制疼痛,则可能发展为术后慢性疼痛或持续性疼痛[15]。有研究报道[16],在术后4、6、24 h,术中行联合神经阻滞麻醉患者的VAS评分明显小于行脊髓麻醉的患者。笔者研究发现,在术后12、18、24 h,行超声联合神经刺激仪引导下前入路坐骨神经及股神经阻滞患者的VAS评分明显低于行单次蛛网膜下腔阻滞患者。
术后约40%医院感染发生在泌尿系统,其中80%与留置导尿管有关[17]。单次蛛网膜下腔阻滞麻醉是一种腰骶部的椎管内麻醉方式,其可阻滞控制膀胱功能的交感神经和副交感神经,导致膀胱自主控制功能丧失,造成尿潴留,并一直持续到阻滞消退[18]。笔者研究发现,相比于行单次蛛网膜下腔阻滞患者,行联合神经阻滞患者的FUT明显缩短,无尿潴留现象发生,且一般不会发生术中低血压、恶心、呕吐等不良反应。此外,感觉神经阻滞时间明显延长。笔者研究进一步通过绘制Kaplan-Meier生存曲线发现,随访期1年内,行联合神经阻滞的未复发率明显高于行单次蛛网膜下腔阻滞麻醉方式,且术后VAS评分和麻醉方式是影响术后复发的关键风险因素。
综上,超声联合神经刺激仪引导下前入路坐骨神经及股神经阻滞,应用于高龄患者DF手术中,具有安全性高、不良反应少、麻醉效果确切、神经阻滞时间长的优势,可有效提升DF患者舒适度,更有利于患者术后恢复,缩短住院时间。

