一种离体心房肌细胞压应力超负荷模型的建立方法
郭秋哲,潘湘斌,杨为民
心房颤动(简称房颤)常见而高危[1]。2020年《中国心血管健康与疾病报告》统计中国房颤患病人数约487万人,60岁以上人群房颤患病率接近2%[2],引发心力衰竭、卒中是其主要危害[3]。多种病因、诱因长期交互作用导致心房电-解剖重构是房颤发生和持续的重要基础[4]。在生理情况下左心房压≤8 mmHg(1 mmHg=0.133 kPa),病理情况下可>25 mmHg[5,6]。左心房压升高和容积增大的程度与房颤发生、持续、治疗成功率、复发率等密切相关,但力学因素导致房颤的分子机制远未阐明[7,8]。目前房颤治疗主要依赖腔肺静脉电隔离及抗心律失常药物,对导致心房电-解剖重构的上游因素缺乏有效干预手段,研究房颤的力学机制对于改善房颤治疗现状意义重大[9]。既往在体研究通过构建二尖瓣反流或主动脉缩窄升高心房压,但应力不可控且受到神经体液干扰[10,11]。离体实验可排除神经体液干扰,研究单一应力对细胞的影响,是探索心房机械-电反馈过程和房颤力学机制的有效手段。
心房近似一球形压力容器,心房肌细胞承受的主要应力包括垂直于心房壁(心房径向)的压应力和与心房壁相切(心房环向)的牵张应力[12],除此之外还有切应力和扭转。病理情况下由于瓣膜病变或左心室顺应性下降,左心房压升高,心房壁内各应力相应增大[13]。牵张应力在房壁内分布较均匀,其内外表面间的应力差较小,而压应力则呈现明显的由内到外递减趋势,内外表面的压应力分别接近于腔内压和腔外压[14]。不均匀的压应力可能导致其力学效应也呈不均匀分布,而心房肌细胞电生理特性是否均匀及其离散程度与心律失常发生关系密切[15],因此与牵张应力、切应力相比,压应力对房颤力学机制更为重要。
已有研究通过牵拉接种于弹性膜的心肌细胞实现离体细胞的的牵张刺激[16]。但国内外尚无对压应力精细刻画的心肌细胞模型。在视网膜神经节细胞、黄韧带成纤维细胞的力学研究中,已通过离心培养方式对细胞施加压应力刺激,并可通过离心机转速估算所施加压应力的大小[17,18]。笔者设计培养箱内离心装置,对原代培养的乳鼠心房肌细胞施加不同强度压应力刺激,构建离体心房肌细胞压应力超负荷模型,检测压应力刺激后细胞的活性及形态,为研究压应力相关的房颤分子机制提供方法学基础。
1 材料与方法
1.1 实验材料与试剂
1.1.1 实验动物
选择出生0~3 d、常规饲养的无特定病原体(specific pathogen free,SPF)级Sprague-Dawley(SD)大鼠乳鼠30只,体质量5~10 g,雌雄不限。由昆明医科大学动物中心提供,动物使用许可证号SCXK(滇)K2020-0004。
1.1.2 主要试剂、仪器
达尔伯克改良伊格尔培养液(Dulbecco modified Eagle’s medium,DMEM)高糖培养液(Corning,美国);胎牛血清(fetal bovine serum,FBS)(Sigma-Aldrich,美国);胰蛋白酶(Gibco,美国);Ⅱ型胶原酶(Life,美国);新生牛血清(newborn bovine serum,NBS)(Hyclone,美国);青霉素(Hyclone,美国);5-溴脱氧尿嘧啶核苷(5-Bromo-2-deoxyuridine,Brdu)(Sigma-Aldrich,美国);牛血清白蛋白(bovine serum albumin,BSA)(Amresco,美国);3-(4,5-二甲基噻唑-2-基)-5-(3-羧甲酯基)-2-(4-磺苯基)-2H-四唑(金翁)(内盐)[3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium,inner salt,MTS]细胞活性检测试剂(Promega,美国);鬼笔环肽(Cytoskeleton,美国);小鼠抗大鼠α横纹肌辅肌动蛋白单克隆抗体(Abcam,美国)。
压应力离心机(长沙湘仪仪器有限公司,中国);电子温度计(成都环安仪表有限公司,中国);细胞培养箱(SANYO,日本);激光共聚焦显微镜(Olympus,日本);全波长多功能荧光比色仪(Thermo Fisher Scientific,美国)。
1.2 方法
1.2.1 构建压应力刺激装置
实验设计的离体心房肌细胞压应力刺激装置由以下部分组成。①离心机选用中国产水平转子离心机,机身大小适合被整体放入细胞培养箱内(图1A),离心转子体悬挂4枚可容纳50 mL离心管的水平转子。②特制离心用细胞培养瓶,为圆柱形平底螺纹盖玻璃瓶,底面积约3.7 cm2,高10 cm,可安置于转子内(图1B);培养瓶底面与12孔板细胞爬片兼容,用于细胞接种及培养。③细胞培养箱为常规二氧化碳(CO2)孵箱,可保证离心过程中氧气(O2)浓度、CO2浓度、pH值、湿度等满足细胞培养所需条件。④电子温度计探头贴附于离心机内腔;通过监测离心机腔内温度实时调整培养箱温度,保证离心过程中细胞的环境温度处于生理范围。
1.2.2 SD大鼠乳鼠原代心房肌细胞获取、培养
取SD乳鼠,用75%乙醇溶液清洗乳鼠后呈仰卧位固定,消毒躯干皮肤,沿左侧腋中线剪开并去除前胸壁(图2),迅速离断升主动脉及气管,一并取出心肺置于冷磷酸盐缓冲溶液(phosphate buffered solution,PBS)中。更换另外一套无菌器械,逐叶剔除肺叶,用PBS反复清洗并去除血凝块,修剪并去除厚壁、圆润、搏动有力的心室组织,保留薄壁松软的心房组织。
将心房组织剪成最大直径约0.5 mm碎块,向其中加入5 mL 0.05%胰酶+0.05%Ⅱ型胶原酶消化液,于37℃条件下水浴5 min;随后吹打,自然沉淀,反复消化5~10次,弃去第一次消化上清液,其余上清液加入含10%NBS的DMEM高糖培养液终止消化,将细胞悬液用100μm无菌细胞滤网过滤后移入离心管,于1 000 r/min室温离心5 min。弃上清液,加入含有10%FBS的DMEM高糖培养液,将细胞团打散为单细胞悬液。
通过差速贴壁的方法纯化心房肌细胞:将单细胞悬液接种于培养瓶,然后将细胞培养瓶放置于37.0℃、体积分数5%CO2培养箱中培养1 h;平稳取出细胞培养瓶,吸取出细胞悬液,将成纤维细胞及上皮细胞等大部分贴壁较快的细胞去除。
调整细胞数为5×105/mL,加入Brdu使其终浓度为0.1 mmol/L,将细胞接种入培养瓶。培养瓶经清洁、泡酸处理,使用前分别置入一片直径2 cm细胞爬片于玻璃瓶底部,一并行高温、高压蒸汽灭菌,接种前24 h用0.2%明胶对培养瓶进行打底。接种细胞后,将培养瓶逐个松口放置于孵箱,继续培养至24 h,换不含Brdu的DMEM高糖培养液。于倒置显微镜下观察细胞形态、大小、贴壁情况、搏动情况并拍照记录。
1.2.3 心肌细胞鉴定
培养48 h后取出细胞爬片,置入12孔培养板中,预温的PBS洗涤3次;用4%多聚甲醛溶液固定细胞30 min,洗涤3次。用0.1%Triton X-100打孔,再用0.1%BSA封闭非特异性反应。将小鼠α横纹肌辅肌动蛋白抗体(一抗)用1%BSA按1∶200稀释,于4℃条件下孵育过夜。洗涤后用异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记二抗室温下避光孵育2 h。用4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)染色细胞核。在共聚焦显微镜下观察并摄片。于60倍显微镜下任选10个视野,计数阴性细胞数和细胞总数,重复3次求平均值,阳性细胞率(%)=(细胞总数-阴性细胞数)/细胞总数×100%。
1.2.4 实施压应力刺激
将原代培养的心房肌细胞分低压应力组、高压应力组、对照组3组,每组细胞n=4,体外培养周期均96 h。两个实验组细胞在培养48 h后分别按转速375 r/min、735 r/min离心培养48 h,对照组细胞不施加离心刺激,其余过程同实验组。
细胞培养42 h后,更换含4%NBS的DMEM高糖培养液对所培养细胞进行饥饿处理,同时对离心机行紫外线照射消毒,用0.1%苯扎溴铵溶液消毒离心机内腔,并将离心机整体放入37.0℃、体积分数5%CO2孵箱内预热。饥饿培养6 h后,再次更换含10%FBS的DMEM高糖培养液,将细胞培养瓶松口置入预先经高温高压蒸汽灭菌的离心机转子中,并将转子安置于离心机内。离心机腔内贴附电子温度计以监测腔内温度。按既定转速及时间对所培养细胞实施离心刺激,期间每2 h记录离心机腔内温度,并通过设置孵箱温度调整腔内温度于37.0℃~37.5℃。
低转速与高转速分别对应压应力为0.931 kPa(7 mmHg、9.5 g/cm2)及3.591 kPa(27 mmHg、36.7 g/cm2),分别模拟生理及病理情况下左心房内压力(表1)。
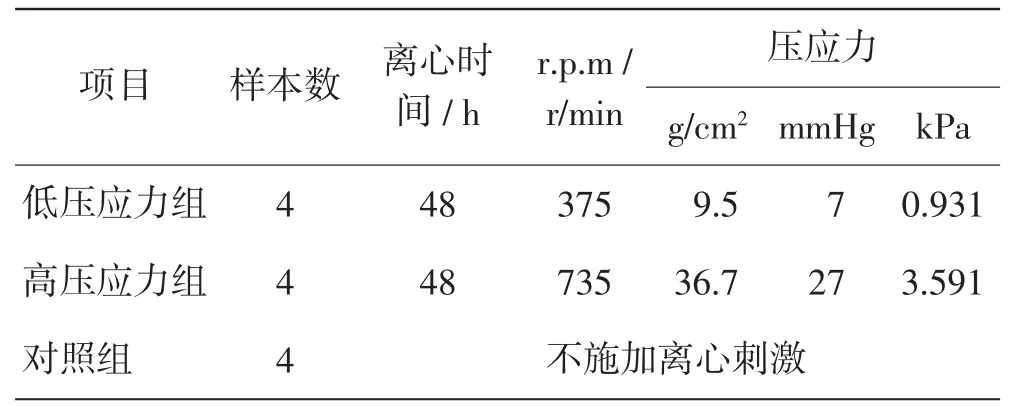
表1 实验分组及压应力实施Tab.1 Comparison of experiment grouping and compressive stress implementation in 3 groups
压应力依据相关文献提供的公式计算[17,18]:P=(m×r×r.p.m.2×π2)/(A×9.8×900),其中:P为细胞所受压应力(kg/cm2);m为培养液质量;r为离心半径;r.p.m.为离心转速;A为培养液与细胞接触面积。
1.2.5 MTS法检测细胞活性
选用直径为1 cm的细胞爬片供细胞贴附,其余细胞培养及压应力刺激流程同上述。完成心房肌细胞培养及压应力刺激48 h后分别将各组细胞爬片逐个置入48孔培养板内,细胞面朝上,每孔内分别加200μL含10%FBS的DMEM高糖培养液及40μL MTS检测试剂,另在3个空白孔内加上述培养液及试剂,用于荧光比色仪校零。将培养板再次放回细胞孵箱内孵育2 h,取出培养板上机,使用荧光比色仪读取各样本490 nm波长处的光密度(optical density,OD)值,通过比较各组间OD值,可比较各组间活细胞相对数量。
1.2.6 细胞骨架染色和细胞面积计算
完成48 h离心刺激后,将实验组及对照组细胞爬片取出,置入12孔培养板内;细胞面朝上,用PBS洗涤3次,4%多聚甲醛溶液固定细胞30 min,洗涤3次后加入0.1%Triton X-100对细胞进行打孔;用浓度100 nmol/L鬼笔环肽室温下避光孵育30 min,用DAPI染色细胞核,于荧光显微镜下观察并摄片。摄片后每组选取50个细胞轮廓清晰、不重叠、单个核且非分裂相的细胞。使用Image JX2软件对所选取细胞轮廓进行描计,对细胞面积进行计算。比较各组间细胞面积。
1.3 统计学方法
采用SPSS 25.0统计软件(SPSS Inc,Chicago,IL,USA)分析数据。数据以均数±标准差表示,采用方差分析行多组间比较,采用独立样本t检验行两组间比较。P<0.05为差异有统计学意义。
2 结果
2.1 压应力刺激装置的建立和运行
实验组建立的细胞压应力刺激装置整体运行良好,可同时离心4个细胞样品,在0~4 000 r/min转速范围内对细胞施加应力刺激,所选用转子体为水平转子体,细胞所受应力方向与离心-重力综合方向,即细胞沉降方向一致,近似垂直于接种底面。离心机运行过程中保持半开盖状态,有利于培养箱内气体向离心机腔内有效弥散,确保培养瓶区域的湿度、O2、CO2浓度与培养箱整体环境保持一致。
由于机械产热,在离心过程中,离心机腔内温度有升高趋势,呈现离心机腔内温度和培养箱温度不一致。实验观察到各组培养箱及腔内温度差值△t随离心过程逐渐升高,在6 h后趋于恒定。高压应力组最高△t约2℃,通过实时调控培养箱温度,可稳定维持离心机腔内温度于37.0℃~37.5℃,各时间点的培养箱温度设置及腔内温度记录见图3,完成离心后即刻测量各组细胞培养液温度分别为37.2℃±0.2℃、37.3℃±0.1℃和37.2℃±0.1℃(P=0.46)。
2.2 SD大鼠乳鼠心房肌细胞的分离、纯化、培养及鉴定
2.2.1 心房肌细胞的分离、培养结果
采用He J等[19]报道的成熟方法完成SD大鼠乳鼠心房肌细胞提取、消化、分离、纯化和体外原代培养。分离心房组织时,选择先将心肺一并取出胸腔,再逐叶剔除肺叶,较直接在胸腔内剪取心脏可保留更完整的心房组织。心房组织经适当修剪后,加酶吹打5~8次可基本完成心肌组织消化,残留部分血管组织。分离后的细胞经差速贴壁接种于培养瓶,12~24 h后细胞完全贴壁,细胞密度70%~80%,细胞多呈长梭形或三角形,48 h后细胞贴壁更充分,部分细胞呈不规则多边形,可见单个细胞搏动(图4)。心房肌细胞与相同方法分离的心室肌细胞比较,搏动频率较慢,收缩力较弱;与心房成纤维细胞比较,心房肌细胞胞质更饱满,胞核明显。
2.2.2 心房肌细胞鉴定结果
用免疫荧光染色法检测心肌细胞中特异性α-横纹肌辅肌动蛋白,对培养细胞进行鉴定。可见心肌细胞特异性的横纹,激光共聚焦显微镜下观察并采集图像(图5),胞质经绿色荧光染色呈阳性的为心肌细胞;心肌细胞纯度约达90%~95%。
2.3 压应力刺激对心房肌细胞形态的影响
通过鬼笔环肽分别对对照组、低压应力组及高压应力组心房肌细胞骨架染色,荧光显微镜下观察并摄片(图6),以对照组细胞面积的均值为基准,计算实验组每个细胞的相对面积。通过方差齐同性检验后(Levene=2.38,P=0.10),经单因素方差分析,3组细胞相对面积比较,差异有统计学意义(1.00±0.23 vs 1.20±0.16 vs 1.59±0.20。F=108.88,P<0.05;图7);组间两两比较,低压应力组细胞面积大于对照组(P<0.05),高压应力组细胞面积大于低压应力组及对照组(P<0.05)。由此可见,体外培养心房肌细胞施加离心所致的压应力可改变心房肌细胞面积,心房肌细胞面积随压应力刺激强度增加而增加。
2.4 压应力刺激对心房肌细胞活性的影响
采用MTS法检测3组细胞活性。荧光比色仪测得3组细胞的OD值分别为0.50±0.02、0.57±0.03、0.50±0.01,经方差齐同性检验(Levene=0.59,P=0.58),单因素方差分析,3组间OD值差异有统计学意义(F=16.76,P<0.05)。组间两两比较,低压应力组细胞活性高于对照组和高压应力组(P<0.05),高压应力组细胞活性与对照组差异无统计学意义(P=0.69)。提示体外培养的心房肌细胞暴露于压应力环境仍可存活且细胞活性发生变化,低强度压应力刺激引发的心房肌细胞活性增加在高强度压应力刺激时消失。见图6、7。
3 讨论
心房力学(机械)环境改变常见于易发房颤的疾病,如瓣膜病、高血压等,表现为心房内压力升高和心房扩大。力学因素对于房颤发生、发展格外重要,大量研究显示心房扩大程度与房颤发生、维持、根治性治疗成功率及房颤复发密切相关。半个世纪以来,随着欧美发达国家疾病谱变化,瓣膜病尤其是二尖瓣狭窄已经不再是房颤的首要病因,有人认为力学机制对于房颤已不再重要,但这种观点混淆了病因机制在疾病中的权重和与疾病的关联性,力学因素与房颤之间的强关联不应由于瓣膜病发病率下降而受到忽视。
如将左右心房分别视为规则、均匀、连续、由单一材料构建的球形薄壁压力容器,则其中任意点所受应力包括径向压应力和环向牵张应力(σ)(图8),球壁内表面压应力的大小约等于腔内压(P),并向外表面逐层递减至腔外压力(P’),由于左右心房并非规则球形;心房壁因梳状肌而厚薄不均;三腔/肺静脉及房室瓣使心房壁不连续;心肌细胞和细胞外基质存在截然不同的力学特性;在心房壁不同结构之间及心内膜面还存在切应力的影响……心房整体应力分布比理想模型复杂得多,准确计算心房内应力的大小和方向非常困难,但各应力的大小与腔内压力呈正相关。病理生理情况下,由于瓣膜病变或左心室顺应性下降,导致左心房内压力升高,心房壁内牵张应力、压应力及切应力相应增加。研究证实心房电生理特性的均一性对于正常电活动至关重要,不均一性增加,例如传导各向异性增加和复极离散度增加,往往是折返形成和房颤发生的基础[15]。因此笔者所在团队认为,天然分布不均匀的压应力比牵张应力对于房颤意义更为重大。
既往生物力学研究存在的一个突出问题是将心房内压的升高简单理解为心肌细胞所受牵张应力的增加,而忽视了心房力学构成的复杂性。现有的离体研究均通过将心肌细胞接种于商品化或自制的弹性膜牵拉装置实现,至今仍无一款成熟系统能对离体心房肌细胞施加压应力刺激。
用离心方式对心房肌细胞施加压应力的设想来自于其他器官、系统的研究[17,18],不难发现,眼球与心房同为球形压力容器,在病理情况下均可发生腔内压力升高。该方法的原理是:细胞在离心环境下受到离心力作用,有向外移动并远离中心的趋势,而细胞培养瓶的底面则对细胞施加反作用力,维持细胞在空间中相对位置不变,该反作用力就是底面对细胞的单轴单向压应力。该方法的优点是应力施加稳定、持续、可控并且在一定程度上可量化。但目前没有商品化的细胞离心培养装置,须自主构建。
构建该装置面临的首要问题是如何确保细胞同时处于离心状态和良好的培养环境。在笔者研究中将离心机置于培养箱环境下,有效控制了离心期间细胞生长所需的湿度、O2和CO2浓度,但实验发现在离心过程中必须对培养箱温度进行实时调整,否则离心机腔内温度可能在离心过程中伴随器械产热逐渐升高并超过细胞生理范围。该装置面临的另一个问题是如何让细胞培养容器与商品化的离心机兼容。笔者采取的方法是设计并定制适配的玻璃材质培养瓶,每次重复使用前经过泡酸、清洗、消毒过程,置入细胞爬片并用明胶打底预处理。该方法可以确保细胞贴壁良好,完成离心后玻片易取出,便于对细胞进一步研究。细胞培养环境中大多数材料如细胞爬片、培养瓶及离心机挂杯转子均可行高温、高压消毒,实验过程中未发生细胞污染。
验证细胞所受应力的类型和强度比较困难,在实验中笔者借助鬼笔环肽对细胞骨架进行染色。由于细胞与接触面的贴附程度越佳,细胞面积通常越大,而作用方向垂直于接种底面的压应力可能有助于心肌细胞贴壁,促进其在所贴附材料表面的延展。在实验中笔者观察到心房肌细胞面积随离心强度逐渐增加,与预期一致,提示压应力刺激有效。
通过MTS法检测心房肌细胞活性,笔者发现低压应力组细胞活性高于对照组和高压应力组,高压应力组与对照组差异无统计学意义。首先,该结果显示离心培养没有导致大量心肌细胞死亡和活性下降,证明该方法安全、可行;此外,低压应力下细胞活性升高,提示生理性的压应力环境可能有助于心房肌细胞贴壁、存活,而超生理范围的压应力刺激,则开始呈现损伤效应,不利于心肌细胞存活。
4 结论
笔者构建的离体细胞压应力超负荷模型具有良好的安全性、有效性和可重复性,通过离心向培养环境中的心房肌细胞施加定量、定时的压应力刺激后,SD大鼠乳鼠心房肌细胞可以存活,细胞形态和活性随压应力强度发生变化。该模型可为进一步探索压应力相关的心房机械-电反馈机制提供方法学基础。

