外伤性视网膜增殖膜转录组分析
靳 瑛,徐晓健,陈慧瑾,马志中
1 解放军总医院第三医学中心 眼科医学部,北京 100143;2 北京市神经外科研究所,北京 100070;3 北京大学第三医院 眼科,北京 100191
视力不良预后的眼外伤青壮年及士兵的主要损伤类型是开放性眼外伤,目前无有效治疗手段。在开放性眼外伤中,40% ~ 60%的病例发生外伤性增殖性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR),其引起的牵拉性视网膜脱离(traction retinal detachment,TRD)最终将导致眼球萎缩[1-2]。伤后视网膜形成的增殖膜是眼内继发损害的主要因素。由于受到研究手段的限制,以往PVR基因研究效率较低。近年来,高通量测序技术的发展使得这种研究成为可能。另外,针对术中PVR增殖膜,由于其样品组织小的特点,其基因分析是传统的高通量测序无法完成的。转录组测序(RNA-sequencing,RNA-seq)基于高通量测序平台如Illumina,通过研究某个物种在特定状态或特定时期下少量组织细胞的mRNA,针对实际样品信息采用灵活的差异分析策略可以找到生物体不同状态细胞差异表达的mRNA,再通过软件进行功能注释,最终可以得到单细胞在生物体中参与生命活动的清晰生物信息图谱。这一技术手段为解析细胞的行为、机制及其与机体的关系等提供了新方法[3-4]。本研究通过对4例眼球开放伤后玻璃体切除术中获取的PVR增殖膜标本进行转录组测序分析,探讨早期与晚期增殖膜的基因表达。
材料与方法
1标本来源 收集北京大学第三医院眼科2015年1 - 12月4例12 ~ 45岁男性开放性眼外伤住院患者的视网膜增殖膜标本。玻璃体切除术中术者使用眼内镊将视网膜增殖膜取出,置液氮中冷冻1 min后,放入-80℃冻存。4例视网膜前膜和(或)视网膜下膜病例临床特征见表1。本研究已通过北京大学第三医院医学科学研究伦理委员会审批(reference no.IRB00006761-2 015 190)。所有参加研究的患者均在手术前签署知情同意书。
2标本分组 4个标本根据伤术时间分为早期组和晚期组;标本均为视网膜前膜或(和)视网膜下膜,PVR分级均为C级。早期膜组(EM组,n=2,M1,M2,伤-术时间≤30 d);晚期膜组(LM组,n=2,M3,M4,伤-术时间>30 d);比较早期与晚期增殖膜的基因表达。

表 1 4例开放性眼外伤增殖性玻璃体视网膜病变患者特征Tab. 1 Characteristics of patients with proliferative vitreoretinopathy after open globe injury of the 4 obtained specimens
3转录组测序 提取增殖膜总RNA。单细胞采集液包含细胞裂解成分和RNase抑制剂,采用带有OligodT的核酸序列进行逆转录,形成1st cDNA。对1st cDNA进行PCR扩增富集核酸,纯化扩增产物后进行文库构建,构建好的文库用Illumina HiSeq 2500进行测序。测序策略为PE125。Illumina高通量测序结果采用TopHat v2.0.12软件与人类参考基因组(GRCh38)比对。
4统计学方法 根据计算每个条目的基因数目,应用超几何检验,找出与整个基因组背景相比在差异表达基因中显著富集的GO条目,计算得到的P值通过校正之后,以Q<0.05为阈值,满足此条件的GO条目定义为在差异表达基因中显著富集。采用DEseq2对EM与LM进行基因差异表达分析,以|log2LM/EM| ≥1和Q<0.05作为基因差异表达标准。
结 果
1PVR增殖膜转录组测序数据量 共获得135 586 954条读长,其中可比对到参考基因组的读长数为130 304 457(96.1%),唯一比对到基因组的读长数为119 999 185(88.5%)。
2差异表达基因 相对于EM组,LM组共有397个基因发生了差异性表达,其中254个基因显著上调,152个基因显著下调。见图1。

图 1 不同时期外伤性增殖膜的DEGs基因火山图。橘黄色点代表上调,绿色点代表下调。灰色点代表非显著DEGs。FC:倍数变化;DEGs:差异表达基因Fig.1 Volcano plots of DEGs of traumatic proliferative membrane at different stages. FC: fold change; DEGs: differentially expressed genes. Orange dots indicate up-regulation. Green dots indicate down-regulation. Grey dots indicate nonsignificant DEGs
3差异表达基因聚类分析 利用R软件对LM与EM组的差异表达基因进行分层聚类分析,结果显示差异表达基因M1和M2聚为一类,而M3和M4聚为一类。提示差异基因可将LM与EM组进行区分。见图2。
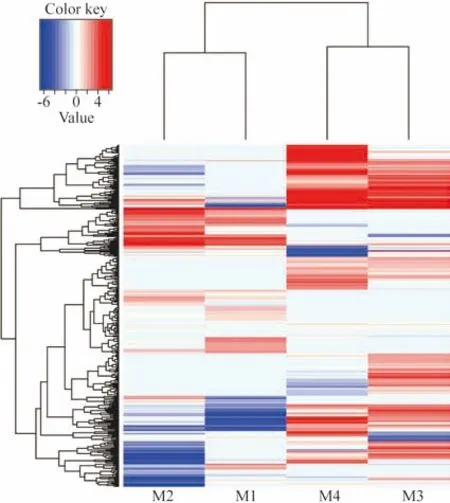
图 2 不同时期外伤性增殖膜的DEGs差异基因聚类热图。每列代表1个样品,每行代表1个转录本,颜色越红则表达量越高,颜色越蓝则表达量越低,LM与EM在整体基因表达方面存在明显差异Fig.2 Hierarchical clustering of DEGs of traumatic proliferative membrane at different stages. Each column represents a sample, and each row represents a transcript. Deeper red represents higher expression level, and deeper blue means lower expression level. There are significant differences in overall gene expression between the two groups

图 3 不同时期外伤性增殖膜的DEGs差异表达基因的GO统计柱状图。红色代表上调,绿色代表下调Fig.3 Histogram presentation of GO functional annotations for the DEGs of traumatic proliferative membrane at different stages. Red indicates up-regulation. Green indicates down-regulation
4差异表达基因GO分析 GO注释分为三个分支,分别为生物学过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF),上述三个分支的三级条目的数量分别为24个、22个和22个。本研究中的差异基因注释到BP、CC和MF三级条目中的个数分别为22个、15个和15个。在生物学过程中,差异基因主要注释到单一生物体过程、细胞过程和生物调控等条目。在细胞组分中,差异基因主要注释到细胞组分、膜部分、细胞和膜等条目。在分子功能中,差异基因主要注释到结合和催化等条目(图3)。结果显示,与整个基因组背景相比,生物学过程中的细胞通讯(P=9.4 × 10-18,FDR=8.18 × 10-14) 、信 号 (P=1.9 × 10-17,FDR=8.18 × 10-14)等GO条目发生显著富集。细胞组分中,细胞外间隙(P=1.2 × 10-16,FDR=1.78 × 10-13)、细胞外空间蛋白质性细胞外基质(P=6.3 × 10-10,FDR=2.34 × 10-10)和 细 胞外 基 质(P=3.4 × 10-12;FDR=8.43 × 10-10)等GO条目发生显著富集。分子功能中,共有9个GO条目发生了显著富集,分别为抗原结合(P=2.4 × 10-7;FDR=8.02 × 10-4)、细胞外基质结构成分 (P=4.1 × 10-7;FDR=8.02 ×10-4)、血小板衍生生长因子结合(P=8.7 × 10-6;FDR=9.4 × 10-3)、糖 胺 聚 糖 结 合(P=1.0 × 10-5;FDR=9.4 × 10-3)、受体活性(P=1.2 × 10-5;FDR=9.4 × 10-3)、配体门控通道活性(P=3.8 × 10-5;FDR=0.02)、配体门控离子通道活性(P=3.8 × 10-5;FDR=0.02)、信号受体活性(P=6.1 × 10-5;FDR=0.03)、细胞因子活性(P=6.5 × 10-5;FDR=0.03)。
5KEGG通路分析 结果显示有5条通路发生了显著富集,分别为细胞黏附分子(P=8.65 × 10-6;FDR=2.8 × 10-3)、蛋白质消化吸收(P=3.84 × 10-5;FDR=4.5 × 10-3)、细胞因子-细胞因子受体相互作 用 (P=4.83 × 10-5;FDR=4.5 × 10-3)、核 糖体(P=5.58 × 10-5;FDR=4.5 × 10-3)和细胞外基质受体相互作用 (P=7.74 × 10-5;FDR=5.0 × 10-3)。见图4、表2。
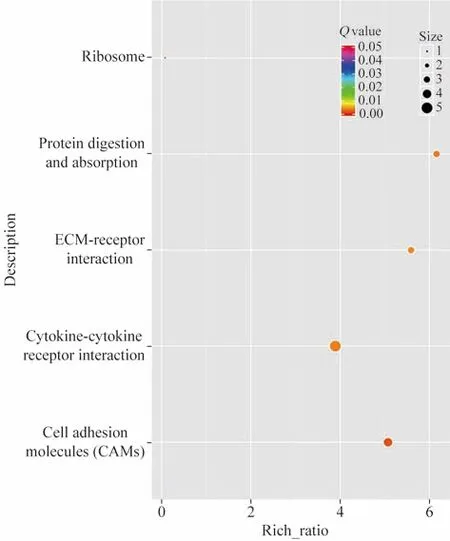
图 4 不同时期外伤性视网膜增殖膜的DEGs通路富集散点图。每个点表示该通路的富集程度,颜色越趋近于红色表示富集程度越高。每个点的大小表示富集到该通路的基因的个数,点越大表示富集到该通路的基因越多,反之则越少Fig.4 Bubble chart of KEGG for the DEGs of traumatic proliferative membrane at different stages. Running horizontally along the graph is the enrichment factor. Each dot indicates the enrichment degree of the pathway, and deeper red indicates higher enrichment degree. The size of each dot indicates the number of genes enriched in this pathway. The larger the dot, the more genes enriched in this pathway, and vice versa
讨 论
对外伤性PVR与特发性PVR的认识是PVR预后分析的基础。特发性PVR指由于孔源性视网膜脱离所导致的增殖性玻璃体视网膜病变。特发性PVR发生的视网膜下膜的收缩力主要来自具有肌成纤维细胞特性的RPE细胞[5]。而外伤性PVR因为伤道组织修复的参与,成纤维细胞增殖在外伤后的增殖反应过程中起到了至关重要的作用,其中成纤维细胞主要由胶质细胞和RPE细胞转化而来[6]。
不同开放性眼外伤后PVR的发生率:贯通伤15%,破裂伤27%,穿通伤23%,眼内异物存留35%[7]。外伤性PVR是严重开放性眼外伤后导致眼球不良预后的主要危险因素。对外伤性PVR的深入研究将有助于我们提高对严重开放性眼外伤的救治成功率。
以往的研究表明,从分期的角度认识眼外伤后的损伤修复过程十分重要[8-10]。即早期以细胞反应为主,其中包括炎症细胞、肌成纤维细胞和RPE细胞等。晚期则表现为细胞含量下降,以慢性反应细胞为主,同时代之以细胞外基质成份,如胶原。通过发现不同时期参与损伤修复过程中的基因变化,寻找外伤性增殖膜生物标记物,是外伤性PVR早期治疗的关键。
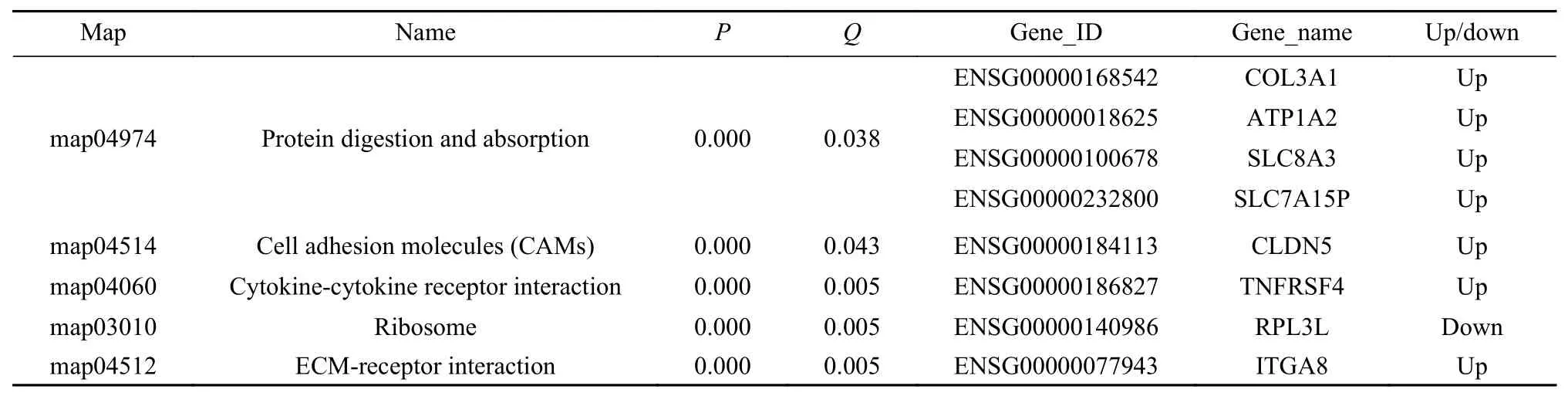
表 2 不同时期外伤性增殖膜的RNA-seq富集KEGG的差异表达基因Tab. 2 Differential expression genes of enriched KEGG of traumatic proliferative membrane at different stages
细胞黏附分子信号通路(cell adhesion molecules,CAMs),细胞黏附分子是表达在细胞膜表面的一种糖蛋白,在很多生物过程中都起到了重要作用,如止血、免疫反应、炎症、胚胎发生、神经组织的生长发育等。其中主要包括4个家族:整合素家族、免疫球蛋白超家族、选择素类、钙黏蛋白(Cadherin)。其主要作用是抗原识别,共同刺激和细胞黏附。以往的研究表明,细胞黏附分子分别在PVR增殖膜中的肌成纤维细胞活化过程和视网膜表面膜的免疫及炎症反应中起重要作用[11-12]。
在本研究的实验结果中,CAMs通路在晚期PVR膜组织中显著富集,其中整合素亚单位8基因呈上调差异表达。整合素家族最初是因此类黏附分子主要介导细胞与细胞外基质的黏附,使细胞得以附着形成整体而得名。整合素是一种介导细胞与其外环境(如细胞外基质)之间连接的跨膜受体。在信号转导中,整合素将ECM的化学成分与力学状态等有关信息传入细胞。因此,整合素除了穿过膜的机械作用,也参与了细胞讯息、细胞周期的调节、细胞形态以及细胞的运动。整合素是由α(120 ~ 185 kU)和β(90 ~ 110 kU)两个亚单位形成的异二聚体。迄今已发现18种α亚单位和9种β亚单位。以含有β亚单位的不同可将整合素家族分为8个组(β1组 ~ β8组)。整合素β8的功能目前不清楚。Morales等[13]应用体外PVR模型中培养的RPE细胞证实,整合素通过影响RPE细胞去分化参与PVR的组织损伤修复过程。由此提示了整合素β8亚单位有可能在PVR增殖膜RPE细胞的转分化过程中起到重要作用。
钙黏蛋白也是CAMs通路的一员。钙黏蛋白是一种同亲型结合、Ca依赖的细胞黏着糖蛋白,对胚胎发育的细胞识别、迁移、组织分化和成体组织器官构成具有重要作用。
本研究结果显示钙黏蛋白5基因呈上调差异表达。Cadherin 5基因编码钙黏蛋白家族中的一个经典钙黏蛋白。编码的前蛋白原经过蛋白水解过程而形成成熟的糖蛋白。这种钙依赖的细胞和细胞间的黏附分子是由5个细胞外的钙黏蛋白重复、1个跨膜区域和1个高度保守的细胞质尾组成。作为一种细胞共有的经典黏附蛋白,其在细胞连接的装配和维持方面起重要作用。Cadherin 5基因定位于16号染色体长臂的一个基因簇内,参与乳腺癌和前列腺癌的杂合子丢失。Chen等[14]通过研究体外培养的ARPE-19细胞,在EMT过程中发现RPE的表型转化过程中N-cadherin发生改变。近年来,在斑马鱼视网膜神经元祖细胞的研究中发现,Müller细胞通过N-cadherin参与视网膜神经元的再生[15]。以上研究提示,钙黏蛋白可能以经典作用方式参与PVR的多个病理过程。
蛋白消化与吸收分子信号通路,人类基因组中已确定了两大转运载体超家族——溶质载体家族和ATP结合盒超家族(ATP—binding cassette,ABC),均属于蛋白消化与吸收分子信号通路系统。在以往的研究中,溶质载体家族和ATP结合盒超家族,如ABCB、ABCC、ABCG、SLC7、SLC16、SLC19、SLCO/SLC21A、SLC22A和SLC29转运蛋白都是血-眼屏障的转运蛋白[16]。近年来研究表明,溶质载体家族和ATP结合盒超家族在多种疾病和药物的递送中起重要作用[17-19]。在此相关领域的研究将打开代谢、营养和微环境等相关疾病的大门。
本课题结果显示ATP1A2,SLC8A3和SLC7 A15P基因呈上调差异表达。由此提示SLC和ABC相关转运蛋白在PVR发展过程中,即血-眼屏障修复过程中起到了积极的作用。
综上所述,本课题结果显示,在外伤性PVR晚期,CAMs和蛋白消化与吸收信号通路显著富集。其中,Integrin β8、Cadherin 5、ATP1A2、SLC8A3和SLC7A15P基因呈上调差异表达。结果提示,整合素β8亚单位有可能在PVR增殖膜RPE细胞的转分化过程中起到重要的作用。另外,在血-眼屏障修复过程中,ATP1A2、SLC8A3和SLC7A15P基因起到了重要作用。
本研究为相对小样本量的探索性研究,对于广泛的临床指导尚需更大样本量、更多时间段分组才能实现。另外,本研究结果中表达的差异基因提示了下一步研究可能与外伤性PVR的相关环节有关,但尚需功能验证。

