全视网膜光凝治疗后糖尿病视网膜病变进展的危险因素分析
李景兰,王培红,陈文倩,高 艺,马天驹,叶 子,李朝辉
解放军总医院第三医学中心 眼科医学部,北京 100853
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最常见的微血管并发症之一,是世界范围内工作年龄(20 ~ 65岁)视力损害的主要原因[1-2]。根据是否存在视网膜新生血管,DR可分为增殖性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)和非增殖性糖尿病视网膜病变(nonproliferative diabetic retinopathy,NPDR)。PDR可导致玻璃体出血、牵拉性视网膜脱离、新生血管性青光眼等严重并发症[3-4]。全视网膜光凝(panretinal photocoagulation,PRP)是目前PDR和重度NPDR的标准治疗方法,如果规范治疗,PDR患者5年内失明风险可降低90%[5]。然而,PRP并不是一种“一劳永逸”的治疗方法。有文献表明,在PRP治疗后2年,45%的眼需要补充PRP,或抗血管内皮生长因子(vascular endothelial growth factor,VEGF)玻璃体腔注射,甚至玻璃体切除[6-7]。这些患者通常视力预后较差,甚至失明[8-9]。因此,有必要对PRP后DR进展的相关危险因素进行识别和分析。在本研究中,我们利用临床数据和实验室检测结果分析PRP后DR进展与潜在危险因素之间的关系,为临床更好更早地预防DR进展提供参考。
资料与方法
1研究对象 本研究纳入2017年1月1日-2021年6月1日在解放军总医院第一医学中心眼科会诊并诊断为PDR或重度NPDR并接受PRP治疗的全部患者临床资料。排除标准:1)PRP治疗后3年内DR结局缺失;2)曾接受抗VEGF治疗;3)PRP前有视网膜局部激光史;4)有白内障手术以外的眼内手术史;5)有其他视网膜疾病,如年龄相关性黄斑变性、视网膜动脉/静脉阻塞、缺血性视神经病变、后葡萄膜炎、青光眼或其他影响眼底检查的眼科疾病;6)临床信息缺失。本研究为回顾性研究,所有数据均匿名,符合《赫尔辛基宣言》。
2临床资料的获取 通过病历记录中基线最佳矫正视力、眼压、裂隙灯检查、眼底视网膜检查和眼底照片评估眼部参数。基线最佳矫正视力由国际标准视力表测量以小数记录,并换算成LogMAR视力进行分析。黄斑OCT可判断黄斑水肿或其他黄斑病变,B超可判断视网膜脱离、玻璃体积血和纤维膜增殖。空腹取静脉血检测生化和血常规。根据血肌酐检测结果,采用校正版MDRD公式推测研究对象的估算肾小球滤过率,根据肾小球滤过率将CKD分为0 ~ 5期。
3结局判断及分组 若患者在PRP治疗后3年内发生以下情况:玻璃体出血、牵拉性视网膜脱离、新生血管性青光眼、需要进一步的PRP、玻璃体腔抗VEGF注射或玻璃体切割术,则被认为DR进展,归入DR进展组。若3年内未出现上述情况,视力保持稳定(下降不超过2行),则被认为DR平稳,归入DR平稳组。PRP后DR维持的时间定义为自PRP至发生DR进展的时间,若3年后失访,则为自PRP至失访的时间。
4DR进展的危险因素分析 本研究有多个预测的潜在危险因素/指标。1)眼部参数:糖尿病视网膜病变分期(PDR或重度NPDR);基线最佳矫正视力。2)人口学特征及全身情况:年龄、性别、糖尿病持续时间、糖尿病神经病变、冠心病、脑卒中、高脂血症、高血压、慢性肾疾病(chronic kidney disease,CKD)、体质量指数(body mass index,BMI)。3)实验室参数:同型半胱氨酸、空腹血糖、血肌酐、血尿素、血尿酸、总胆固醇、三酰甘油、糖化血红蛋白、血清胱抑素C、血红蛋白、红细胞比容、外周血中性粒细胞/淋巴细胞比值、尿微量白蛋白/肌酐比值(urinary albumin-tocreatinine ratio,UACR)。
5统计学方法 采用SPSS 25.0软件。服从正态分布的计量资料以x¯ ±s表示,采用t检验比较组间差异;不服从正态分布定量资料以Md(IQR)表示,采用Mann-WhitneyU检验;计数资料采用χ2检验比较组间差异;采用单因素logistic回归筛选潜在危险因素,再进一步将潜在危险因素纳入多因素logistic回归。采用ROC分析部分危险因素指标对DR进展的预测效能。所有统计检验均为双侧检验,P<0.05为差异有统计学意义。
结 果
1患者的基线特征 共纳入289例患者,平均年龄(51.1 ± 11.4)岁,其中59.5%为男性,96.2%为2型糖尿病患者。全身合并症以高血压为主(74.4%),其次为CKD(38.1%)、高脂血症(30.8%)、冠心病(12.1%)、糖尿病神经病变(9.3%)和脑卒中(8.0%)。
2DR进展情况及两组一般及临床特征比较DR进展组163例,DR进展率为56.4%。结果显示,与DR平稳组相比,DR进展的患者年龄更小,基线视力更差,CKD、糖尿病神经病变、高脂血症和贫血的发生率更高,与肾功能相关的实验室参数(血肌酐、血尿素、血尿酸、血清胱抑素C、UACR等)差异也有统计学意义(P均<0.05)。见表1。
3DR进展危险因素的单因素logistic回归筛选以单因素logistic回归筛选DR进展的危险因素,结果列于表2。由其可见共有16个因素可能是DR进展的潜在影响因素,主要体现在年龄、基线视力、肾功能、脂质代谢、贫血等方面(年龄:OR=0.976,95%CI:0.956 ~ 0.997;基线视力:OR=9.560,95%CI:3.753 ~ 24.356;CKD:OR=2.209,95%CI:1.702 ~ 2.868;血尿素:OR=1.256,95%CI:1.123 ~ 1.404;血清胱抑素C:OR=8.359,95%CI:3.260 ~ 21.431;UACR:OR=1.008,95%CI:1.004 ~ 1.012;高脂血症:OR=4.239,95%CI:2.378 ~ 7.557;总胆固醇:OR=1.274,95%CI:1.036 ~ 1.567)。
4DR进展危险因素的多因素logistic回归分析根据上述单因素分析结果,将16个P<0.10的指标/因素纳入多因素logistic回归(向前LR法,α进=0.05,α出=0.10),结果表明CKD(OR=3.257,95%CI:1.671 ~ 6.351)、基线 视 力(OR=6.149,95%CI:1.770 ~ 21.358)、年 龄 (OR=1.034,95%CI:1.003 ~ 1.067)为DR进展的危险因素,即CKD分期越高、基线视力越差、年龄越小则DR进展的风险越高。回归分析详细结果见表3。

表 1 患者PRP后DR进展组与平稳组的一般及临床特征比较Tab. 1 Comparison of general and clinical characteristics of patients in the DR-progressive group and the DR-stable group

表 2 单因素logistic回归筛选DR进展的危险因素Tab. 2 Univariate logistic regression analysis of characteristics for predicting DR-progression

表 3 患者PRP后DR进展的logistic回归分析Tab. 3 Logistic regression analysis of patients’ characteristics for predicting DR-progression
5各危险因素预测DR进展的ROC曲线 进一步探讨年龄、视力及CKD分期对PRP后DR进展的预测价值:以DR进展组为阳性样本(n=163),以DR平稳组为阴性样本(n=126),建立ROC风险预测模型。各指标均参考临床实践划分为若干个组段,再以软件拟合ROC曲线读取约登指数最大值点,对应计算理论阈值和各项参数。并按实测样本计算敏感度、特异性、准确度。
结果显示,CKD分期的曲线下面积为0.784(95%CI:0.559~0.990),截断界值点为CKD分期为1期,敏感度为71.2%,特异性为82.5%;基线视力的曲线下面积为0.692(95%CI:0.470~0.915),截断值为0.3,敏感度为68.1%,特异性为70.6%;年龄的曲线下面积为0.593(95%CI:0.226~0.941),截断界值点为年龄为50岁,敏感度为54.0%,特异性为61.1%。由其可知,当患者CKD分期高于1期,基线视力<0.3,年龄<50岁时,DR进展的风险较高。三者相比,CKD分期ROC曲线下面积最高,敏感度和特异性较好,更适合用于预测DR进展。见表4和图1。
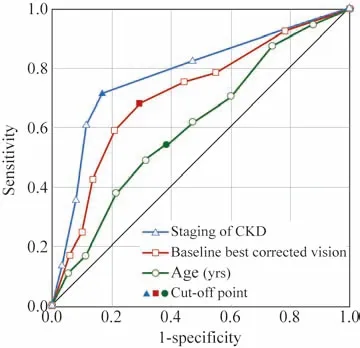
图 1 各危险因素预测DR进展的ROC曲线Fig.1 ROC curves of each factor for predicting DR-progression

表 4 患者PRP后DR进展的各危险因素的风险预测能力评价Tab. 4 Risk prediction performance of each risk factor for DR-progression
讨 论
本研究分析了PRP后DR进展的危险因素。在调整各种混杂因素后发现,肾功能较差、基线视力较低和年龄<50岁是PRP后DR进展的危险因素。其中,CKD与PRP后DR进展的关系最为密切,其预测性能最好。此外,与肾功能相关的实验室参数包括血肌酐、血尿素、血清胱抑素C和UACR,在单因素分析中与DR进展有显著相关性,提示随着肾功能恶化,DR进展的发生率随之增加。有文献表明,肾功能与DR的发生有关,在PDR或重度NPDR中其关联更加紧密[10-13]。同样,本研究发现CKD是PRP后DR进展的独立危险因素。DR和肾功能的恶化相互影响和促进,提示眼科医生在DR的治疗中需要重视患者的全身情况,尤其是肾功能不全,需要加强各学科间的交流合作,共同调控肾功能以期较好的视力预后。
本研究表明,当基线视力较差时,PRP后DR进展的可能性较大。由于视力下降的程度与DR的严重程度有关,因此视力差也意味着视网膜缺血程度较严重,即使予以PRP治疗,也不能完全缓解黄斑区的缺血,甚至有些情况下会加重黄斑水肿,视力预后较差[14-15]。一旦DR进展到晚期,积极治疗(如PRP或玻璃体腔内抗VEGF注射)将成为减少DR相关盲的最佳途径[15-16]。因此,预防DR进展也是减少DR相关盲的重要策略。
研究表明,糖尿病发病年龄是PDR发生发展的关键因素,年轻PDR患者相比老年患者有更高的视力丧失风险[17];而对于2型糖尿病,发病年龄<45岁是PDR发展的独立危险因素[18]。年轻PDR患者在玻璃体切割术时往往表现为增殖更严重,视网膜新生血管进展更迅速[19-20]。同样,本研究中年龄也是PRP后DR进展的独立危险因素,表现为年龄<50岁时DR进展可能性更大。
除了以上因素,多项研究表明糖尿病控制不良、贫血、脂质代谢异常、高尿酸血症、中性粒细胞/淋巴细胞比值偏高等因素均与DR进展有关[21-25]。本研究中由于有一部分患者在内分泌科住院调控血糖,纳入的患者可能血糖控制不佳,DR进展组和DR平稳组平均糖化血红蛋白均在8%以上,因此两组间血糖控制情况未见明显差异。本研究中单因素logistic回归分析同样显示贫血、脂质代谢异常、高尿酸血症等因素与DR进展相关,但在多因素logistic回归分析中这些因素的影响并不显著,这可能是不同研究间的纳入标准、人群特点的差异所致。
本研究存在以下局限性:纳入患者群体本身可能存在全身情况较差、预后较差等情况,需多学科共同干预治疗,并且DR稳定的患者往往更易失访,因此PRP后DR进展的发生率为56.4%,高于其他文献报道[6,21]。此外,本研究为回顾性分析,预测DR进展的危险因素并未得到临床验证,后续进一步需扩大样本量的多中心研究。
本研究通过对289例患者的临床数据分析,筛选出3个预测PRP后DR进展的危险因素,可指导临床医生重点关注DR进展风险高的患者,并对患者进行更多宣教和更全面治疗。综上,肾功能较差、基线视力较低和年龄<50岁是PRP后DR进展的独立危险因素,能够很好地预测PRP后DR进展。

