多层螺旋CT在鉴别诊断肺部良恶性磨玻璃样密度影中的应用
熊文亮
(南京市高淳人民医院放射科 江苏 南京 211302)
肺癌是实性恶性肿瘤中最为常见的类型之一。在恶性肿瘤中,其发病率和病死率最高,与肺癌相关死亡的病例占各种癌症死亡总数的30%[1]。来自国际和国内许多的研究数据表明,肺部磨玻璃样密度影(GGO)同早期肺癌之间存在显著的相关性[2]。通过肺段或叶部分切除或部分楔形切除术治疗早期肺癌,而无需清扫或取样纵隔内的淋巴结,因此,GGO中的早期癌症有着良好的预后。随着CT的广泛应用和检查技术的发展,低剂量大规模筛查技术和高分辨率薄层CT(high resolution CT,HRCT)检查的应用和改进,CT机性能的提高(如多层螺旋CT的应用),已经能检测到越来越多的GGO病例[3]。本文旨在研究肺部GGO患者的影像学资料,并与病理结果进行对照,探讨多层螺旋CT在鉴别肺磨玻璃影良恶性的价值。
1 资料与方法
1.1 一般资料
选取南京市高淳人民医院2016年1月—2018年12月经胸部多层螺旋CT诊断为GGO并接受手术治疗的患者68例,其中男性28例,女性40例,年龄28~78岁,平均年龄(59.2±11.8)岁;68例患者中良性GGO 22例(良性组),恶性GGO 46例(恶性组)。分析患者临床数据、影像征象及病理资料。
纳入标准:①胸部多层螺旋CT检查首次被诊断为GGO,接受手术治疗并取得术后病理者;②术后病理确诊为肺腺癌而影像学检查未发现远处转移者。排除标准:①胸部CT图像呼吸伪影较重,不能进行影像分析;②CT图像中结节直径≥3 cm;③肺部多发GGO且伴有肺部其他病变,根据病理结果判断为肺癌肺内转移者。
1.2 方法
使用64排多层螺旋CT(GE LightSpeed VCT)进行扫描。所有患者均采用仰卧位进行检查,双臂朝上举起,头先进。在64排MSCT中行吸气后屏气扫描。扫描范围包括肺尖至两侧肺底部的整个区域。扫描参数:管电压120 kV,管电流使用自动毫安技术,螺距15(0.98);矩阵512×512,层厚0.625 mm,重建层厚5 mm。图像重组使用高空间分辨率算法及标准软组织算法,将所有原始图像发送到AW4.6工作站进行后处理。横截面薄层重建参数:层厚0.625 mm,层间距0.3~0.5 mm;显示视野18 cm×18 cm~20 cm×20 cm;采用高空间频率算法(如骨重建算法)。肺窗窗宽1 800~2 000 HU,窗位-700~-800 HU。多平面重建:除常规肺窗和纵隔窗外,通过MPR(冠状面、矢状面及多角度斜面)显示病变的形态学特征和毗邻气管的关系的显示,明确了病变和周围血管的关系。
1.3 图像分析
由2名影像科高年资医师对原始及重建图像进行综合评价,分析GGO的影像学特征:病灶位置、直径、最大CT值、平均CT值。经讨论达成一致时记录结果,以上特征在避开钙化、空泡的情况下在病灶最大面积层面上勾画类圆形感兴趣区测量获取。
1.4 统计学方法
采用SPSS 20.0统计软件分析数据,计量资料以均数±标准差(± s)表示,组间比较行独立样本t检验;计数资料以频数(n)、百分率(%)表示,行χ2检验,P<0.05则差异具有统计学意义。
2 结果
2.1 患者一般资料比较
良性组中8例男性,14例女性,平均年龄为(49.2±9.8)岁;其中9例吸烟者;11例右肺GGO,11例左肺GGO。恶性组中20例男性,26例女性,平均年龄为(61.3±12.1)岁;其中30例吸烟者;26例右肺GGO,20例左肺GGO。良性组和恶性组之间男女比例、吸烟者与非吸烟者比例、GGO位置的差异无统计学意义(P>0.05);恶性组患者的年龄显著大于良性组(P<0.05),说明GGO发生恶性的风险也随着年龄增长而显著增加,见表1。

表1 两组患者的一般资料比较
2.2 良性和恶性组之间的磨玻璃样密度影相关CT扫描参数的比较
良性组GGO的平均直径、最大CT值和平均CT值均小于恶性组,差异有统计学意义(P<0.05),见表2。
表2 良性和恶性组中磨玻璃样密度影相关计算机断层扫描参数的比较( ± s)
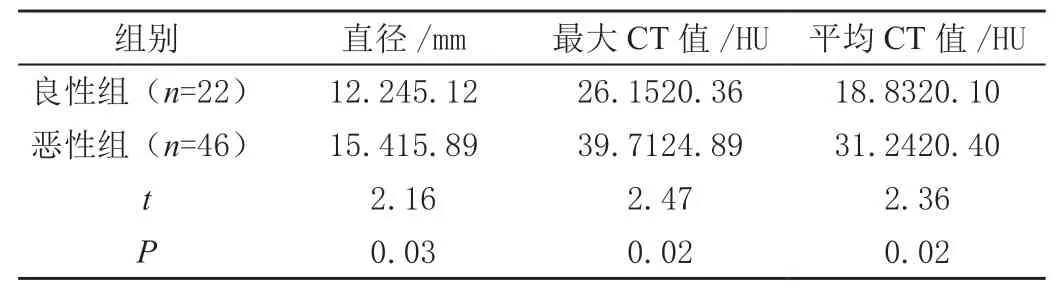
表2 良性和恶性组中磨玻璃样密度影相关计算机断层扫描参数的比较( ± s)
组别 直径/mm 最大CT值/HU平均CT值/HU良性组(n=22) 12.245.12 26.1520.36 18.8320.10恶性组(n=46) 15.415.89 39.7124.89 31.2420.40 t 2.16 2.47 2.36 P 0.03 0.02 0.02
2.3 受试者操作特征曲线(ROC)下的诊断灵敏度、特异度和面积比较
GGO直径、最大CT值和平均CT值对鉴别GGO良恶性的灵敏度分别为60.87%、69.57%和63.04%。相应地,特异度为63.64%、63.64%和81.82%。鉴别诊断的临界值分别为13.89 mm、26.18 HU和24.61 HU,见表3。受试者工作曲线下面积分别为0.66、0.71和0.69。
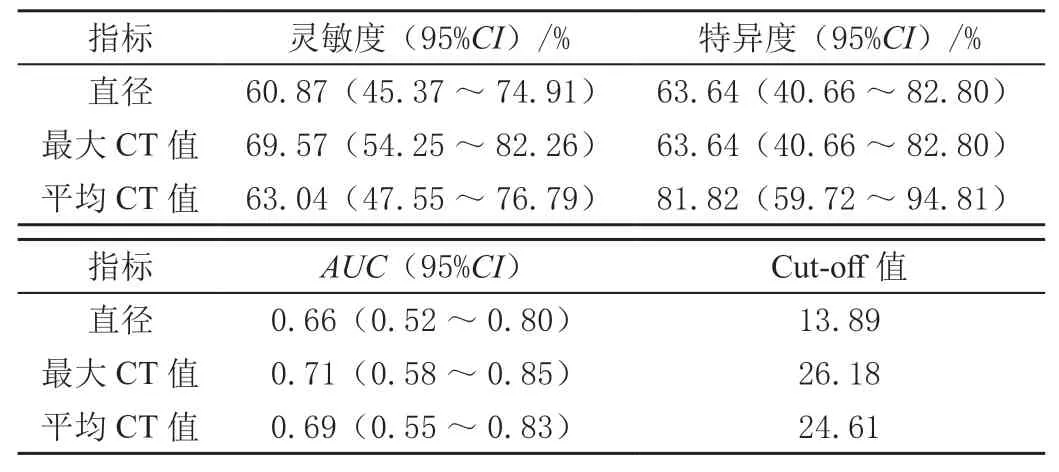
表3 CT扫描参数ROC的诊断灵敏度、特异度和面积
3 讨论
GGO在HRCT肺窗图像上表现为边界清楚或不清楚的肺内密度增高阴影,但是病变的密度又不足以掩盖其中走行的支气管和血管结构[4]。肺部磨玻璃样密度阴影是肺癌常见征象,但并非是特异性的征象,而GGO多见于局灶性炎症、肉芽肿、局灶性纤维化、水肿、出血、不典型增生和肿瘤样增生等。GGO的病理学特征是由肺泡壁及肺泡间质增厚,导致肺泡和终末气道含气减少甚至萎陷,还有毛细血管的血容量增加引起的肺间质和/或肺泡损伤的早期表现[5-6]。
影像学中根据GGO内部有无实性组织成分,将磨玻璃样密度影分成混杂性磨玻璃样密度影(mixed groundglass opacity,mGGO)和纯磨玻璃样密度影(pure ground-glass opacity,pGGO)[8]。根据GGO的实性成分的比例分为:①pGGO;②半实性结节;③中间是实体,周围有GGO(晕征);④mGGO在实体部位有支气管膨胀征;⑤mGGO,但GGO的比例<50%;⑥完全实性的结节。目前的GGO检查方法包括CT造影剂增强检查(直径大于10 mm的结节,特异率仅为60%);18F-氟脱氧葡萄糖(FDG)正电子发射断层扫描(PET)(18FDGPET)检查(由于病灶小、代谢率不高、无异常摄取),定性价值有限[9-10];对于直径较大的结节经皮肺穿刺活检或支气管镜活检有较高的临床价值,而对直径≤10 mm GGO的病变的诊断价值较低,故穿刺活检不宜作为常规检查[11-12]。
近年来,随着CT技术的不断发展,特别是多层螺旋CT的临床广泛应用和后图像处理技术的不断提高,多层螺旋CT在GGO的检出率和性质鉴定中发挥了越来越重要的作用[13-14]。本研究回顾性分析了2016年1 月—2018年12月在南京市高淳人民医院接受手术治疗的68 例肺部GGO患者。术后病理诊断结果显示22例良性GGO和46例恶性GGO(腺癌)。术前多层螺旋CT病灶大小及密度值的比较显示,良性组的平均GGO直径、最大CT值和平均CT值均显著低于恶性GGO组。应用GGO的直径、最大CT值和平均CT值来识别良性或恶性GGO的灵敏度分别为60.87%、69.57%和63.04%。相应地,特异度分别为63.64%、63.64%和81.82%;临界值分别为13.89 mm、26.18 HU和24.61 HU;ROC曲线下面积分别为0.66、0.71和0.69。因此,本研究表明,患者年龄、具有大直径、平均CT值和最大CT值高的的GGO恶性程度的可能性显著增加。吴汉然等在m-CT值在预测临床Ⅰa期肺癌和癌前病变恶性程度中的应用研究中,发现上述指标的Cut-off值分别为:15.3 mm、-35.0 HU和-469.0 HU,对应的AUC分别为:0.89、0.79、0.82,平均CT值的曲线下面积最大,对判断GGO恶性程度的效果最佳。单因素和多因素分析发现,肿瘤大小、C/T比值、平均CT值和最大CT值均与GGO恶性程度有较强的相关性,与本次实验结果基本一致[15]。须民欣等研究显示,随着肺磨玻璃结节的恶性程度越大,其病灶越大、平扫CT值也越高。病灶越大,恶性程度可能越大,病灶越小良性可能越大。同时,平扫CT值可作为鉴别良性病变、非侵袭性病变与侵袭性病变的重要参数,平扫CT值逐渐增高,其原因在于病灶恶性程度越高生长速度越快,肿瘤细胞及肿瘤组织越多,实性成分越高,病灶血供越丰富,与以往报道相符[16]。而其他相关因素,如吸烟数量和病变的位置不是恶性GGO的主要危险因素。在国内外,关于吸烟与肺癌之间联系的流行病学研究有很多,并且普遍认为两者之间存在显著的相关性[17]。而本研究表明,判断恶性GGO,吸烟并不是一个重要因素,可能是样本不足的原因导致的,需要扩大样本进行分析研究。由于关于GGO诊断和鉴定方法仍有许多争议,尤其是GGO的性质[18]。
综上所述,肺部磨玻璃结节最大直径、平均CT值和最大CT值能够提高GGO鉴别诊断能力,肺部磨玻璃结节直径越大,平均CT值和最大CT值越高,侵袭性的可能性越大,需高度警惕。随着医疗技术的不断发展,以及影像诊断和治疗技术的改进,GGO的性质将被准确识别,并且可以设计有效的临床GGO治疗方案。

