白藜芦醇对内质网应激介导的原代神经元细胞作用机制
刘芸如,赵范范,叶慧敏,商迎辉,李梦洁,黄汉昌,劳凤学
(北京联合大学功能因子与脑科学研究院,北京市生物活性物质和功能食品重点实验室,北京 100191)
阿尔茨海默病(alzheimer disease,AD)是与衰老相关的最普遍的神经退行性疾病,对全球超过4 000万 人造成影响[1-2],已成为一个重大的公共卫生问题,给个人、社会和经济带来巨大负担[2-3]。AD是一种中枢神经系统(central nervous system,CNS)退行性疾病,其特征为病理性脑标志,例如淀粉样蛋白β(amyloid-β,Aβ)斑块、神经原纤维缠结和微管相关Tau蛋白磷酸化变化[4]。内质网在细胞中具有重要功能,包括翻译后修饰、折叠和新合成的分泌蛋白组装,对细胞的生存至关重要。因此,任何影响内质网结构和功能的外部或内部因素最终都会导致蛋白质合成、翻译和折叠的中断,从而导致蛋白质未折叠或错误折叠,引发内质网应激(endoplasmic reticulum stress,ERS)。
白藜芦醇(resveratrol,Res)是一类有益于人类健康的非黄酮类多酚化合物,存在于红葡萄、红酒和其他植物性食品中,常用作肿瘤和神经退行性疾病的化学预防剂[5]。天然的Res存在两种异构体:顺式和反式(图1),在自然界中Res大多以反式构象存在。由于具有多种生物学特性,包括抗氧化、抗炎和神经保护活性,已引起研究人员广泛关注[6]。Res可以间接激活沉默信息调节因子-1(silent information regulator-1,SIRT1)的表达[7]并对AD病例产生神经保护[8]。SIRT1可调节多种底物活性,包括p53和过氧化物酶体增殖物激活受体-γ共激活物1α[9],从而减少Aβ积累和改善线粒体功能障碍。
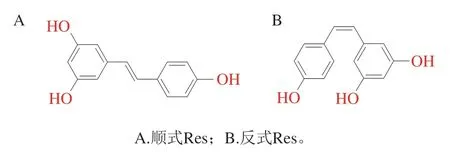
图1 Res化学结构式Fig. 1 Chemical formula of resveratrol
本实验用衣霉素(tunicamycin,TM)处理原代神经元细胞,建立ERS模型,用Res对其进行干预,测定细胞存活率、细胞周期、自噬和凋亡相关蛋白表达水平,研究Res对TM引起的细胞自噬、凋亡、周期的调节作用,为Res的功能性作用研究及AD的预防和治疗提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
清洁级昆明系性成熟小鼠购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2019-0008。雌鼠:9~12 周龄,体质量(25±5)g;雄鼠:11~12 周龄,体质量(30±5)g。雌性鼠每笼5 只群养,雄性鼠每笼1 只单独饲养。环境温度保持在20~22 ℃,12 h/12 h光照黑暗交替环境,按常规饲养。
DMEM/F12营养培养基、B-27无血清添加剂50X、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、表皮生长因子(epidermal growth factor,EGF)、StemPro accutase细胞解离试剂 美国Gibco公司;Res 北京索莱宝科技有限公司;TM(用二甲基亚砜溶解配制成质量浓度10 μg/μL的储存液,-20 ℃保存,使用时以培养基稀释至所需质量浓度) 北京华越洋生物科技有限公司;抗Neu N单克隆抗体、抗鼠IgG辣根过氧化酶标记抗体北京中杉金桥生物技术有限公司;Annexin V-FITC细胞凋亡检测试剂盒 上海碧云天生物科技有限公司;细胞周期检测试剂盒 北京四正柏生物科技有限公司。
1.2 仪器与设备
E191IR CO2细胞培养箱 美国金西盟公司;CKX41倒置显微镜 日本Olympus公司;Varioskan Flash多功能酶标仪、ND-1000型紫外-可见分光光度计 美国赛默飞世尔科技公司;流式细胞仪 美国BD公司;凝胶成像分析仪 日本Image Quant Rtecl公司;5840R低温高速离心机 德国Eppendorf公司;043BR57802转膜装置、EN027015电泳装置 美国Bio-Rad公司;TCS SP5激光共聚焦显微镜 德国徕卡公司。
1.3 方法
1.3.1 原代神经元细胞的分离提取
取孕期18 d小鼠,脱颈处死后浸泡于体积分数75%乙醇溶液中。在超净台内解剖子宫,将胎盘包裹的胎鼠置于预冷的pH 7.6、0.01 mol/L磷酸盐缓冲液(phosphate buffer saline,PBS)中,逐个取出胎鼠的大脑皮质,迅速用无菌镊子剥离脑膜,剥离干净的脑组织转移至含有500 μL DMEM/F12营养培养基(V(DMEM)∶V(F12)=1∶1)的2 mL离心管中,用1 mL移液管轻柔吹打,随后将离心管置于冰上静置10 min左右,使未被打散的组织块沉淀于离心管底部;取上清液转移到另一离心管中,向组织块中加入细胞解离试剂,置于37 ℃培养箱酶解15 min,适当吹打后加入至之前的上清液中,800 r/min离心5 min,弃上清液,加入神经干细胞(neural stem cell,NSC)无血清培养基重悬,调整细胞浓度为1.0×109个/L,接种于用多聚赖氨酸包被的培养皿内,置于37 ℃、5% CO2细胞培养箱中培养。
1.3.2 原代神经元的免疫荧光鉴定
从培养箱中取出培养8 d的原代神经元,吸去培养液,用PBS轻轻漂洗细胞2 遍,加入质量分数4%多聚甲醛固定15 min。固定结束后,用PBS轻轻漂洗3 遍,每次漂洗10 min,以弃去多余的多聚甲醛。封闭1 h,弃上清液,加入一抗(抗鼠Neu N单克隆抗体),在37 ℃培养箱中培养2 h。弃一抗,用PBS轻轻漂洗3 次,结束后加入二抗(山羊抗兔FITC-IgG),37 ℃孵育1 h。弃二抗,再用PBS洗涤,加入4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)复染细胞核,室温下作用3 min后吸去DAPI染液,用PBS洗涤,随后加入抗荧光猝灭剂;共聚焦显微镜下进行观察、拍照并做记录。
1.3.3 ERS原代神经元细胞模型的建立
将1.3.1节培养的神经元细胞直接分离提取成单细胞悬液,每孔100 μL接种于96 孔板,培养24 h,加入不同质量浓度梯度的TM溶液(0(对照)、0.625、1.25、2.5、5、7.5、10 µg/mL)处理24 h(37 ℃、5% CO2条件下,下同),每个质量浓度设置6 个复孔;确定最佳TM损伤处理质量浓度(2.5 µg/mL)后,利用2.5 µg/mL TM分别处理神经元细胞0(对照)、8、12、18、24、36 h,每个时间设置6 个复孔。利用酶标仪测定450 nm波长处OD值,并确定TM最佳损伤处理质量浓度和处理时间。用2.5 µg/mL的TM处理原代神经元细胞24 h,进行后续实验操作。用下式计算细胞存活率。
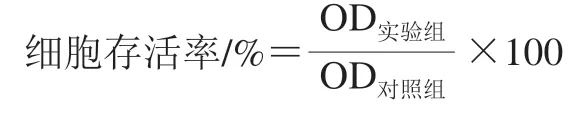
1.3.4 Res干预条件的筛选以及细胞分组与给药
根据细胞存活率筛选Res的最佳干预条件,神经元细胞经不同浓度(0(对照)、0.625、1.25、2.5、5、10、15、20、25 μmol/L)Res预处理10 h后再加入质量浓度2.5 µg/mL TM处理24 h,结果显示5 μmol/L Res处理保护效果最好;利用5 μmol/L Res分别处理神经元细胞0、2、6、10、14、24 h,再加入质量浓度2.5 µg/mL TM处理24 h,结果显示Res处理10 h保护效果最好。用TM最佳损伤质量浓度建立ERS原代神经元细胞模型,实验分组设置为对照组、TM组、Res组和Res+TM组。其中对照组不做处理,TM组仅使用质量浓度2.5 μg/mL TM处理,Res组仅使用5 μmol/L Res处理,R10T组先用5 μmol/L Res预处理10 h后,再加入质量浓度2.5 µg/mL TM后处理24 h;R0T组用5 μmol/L Res和2.5 µg/mL TM同时处理24 h。为了探究Res保护神经元的作用机制,R10T组细胞在加入TM处理之前以及R0T组同时加入Res和TM处理之后分别先用ERS抑制剂4-苯基丁酸(4-phenylbutyric acid,4-PBA)预处理4 h或GSK-3β抑制剂SB216763预处理2 h,然后再加TM处理。
1.3.5 原代神经元细胞周期检测
将药物处理后的神经元细胞消化并再次收集,洗涤后加入预冷的体积分数95%乙醇溶液,4 ℃下固定,再加入碘化丙啶(propidium iodide,PI)染色液染色30 min。染色后24 h内用流式细胞仪检测红色荧光(激发波长488 nm)。使用Cellquestpro软件收集数据,使用Flow Jo软件分析细胞周期。
1.3.6 细胞凋亡率检测
神经元细胞经药物处理并消化后,用PBS洗涤2 次,按Annexin V-FITC/PI检测试剂盒说明书步骤制备所需染色液并进行流式细胞仪分析。分析前用200 目滤网过滤细胞。检测完成后,运行计算机软件分析并记录数据。
1.3.7 Western blot检测
细胞培养与药物处理同1.3.1节和1.3.4节。收集神经元细胞用于蛋白的提取,用预冷的PBS洗涤细胞2~3 次后,将培养皿置于冰上,在皿内加入150 µL细胞裂解液并与细胞混匀,使用细胞刮收集细胞于培养皿中,冰上裂解30 min,4 ℃、12 000×g离心15 min后收集上清液,收集的蛋白样品中加入5×十二烷基硫酸钠Loading Buffer(V(样品)∶V(5×十二烷基硫酸钠Loading Buffer)=4∶1),放入热水中煮沸变性,BCA法测定上清液中蛋白质量浓度。等浓缩胶完全凝固以后,用微量移液枪吸取相应蛋白样品,将蛋白样品缓慢注入到上样孔内,设定电压为80 V,时间100 min。将目标蛋白转移到聚偏氟乙烯膜上,利用5%脱脂奶粉室温封闭2 h,一抗4 ℃条件下振荡过夜孵育。TBST缓冲液10 min洗涤3 次,二抗37 ℃孵育2 h,用TBST缓冲液洗涤3 次。将ECL A液和ECL B液等体积混合后在化学发光成像系统上曝光膜上条带。用β-actin为内参,使用Image J软件分析条带的灰度。
1.4 数据处理与分析
数据以平均值±标准偏差表示,每组进行3 次重复。采用SPSS 19.0软件进行数据分析,并用Origin 9.1软件作图。数据比较采用单因素方差分析(One-Way ANOVA),多因素比较采用Bonferroni法。P<0.05为显著性差异,P<0.01为极显著性差异。
2 结果与分析
2.1 原代神经元细胞及鉴定
培养24 h后,原代神经元分化为轴突。分化后观察神经元形态,胞体呈椭圆形或圆形,有清晰晕圈。神经元按状态分为3 种类型:1)双极神经元,其胞体两侧有一个突起;2)多级神经元,其胞体有一个长突起和多个短突起;3)假单胞菌级神经元,其胞体只出现一个长突起,但迅速分散成T形(图1)。

图1 神经元形态学观察Fig. 1 Morphological observation of neurons
对神经元进行荧光鉴定,利用DAPI染核来标记细胞核,结果如图2A所示;Neu N仅在分化神经元细胞中表达,用山羊抗兔FITC-IgG进行标记,呈红色荧光(图2B);二者图像叠加如图2C所示,图2D是正常状态下的神经元细胞,通过图2C中呈现荧光的细胞可确定该细胞为神经元。
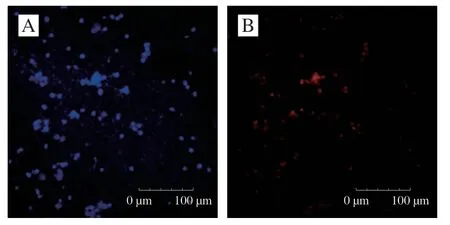

图2 神经元细胞鉴定Fig. 2 Identification of neuronal cells
2.2 TM和Res对海马神经元细胞增殖的影响
2.2.1 TM作用质量浓度的筛选
ERS是由于内质网稳态失衡,大量未折叠或异常折叠蛋白质聚集在内质网腔内,造成内质网蛋白质过负荷。TM是一种N-糖链抑制剂,可以阻碍新合成的蛋白质在内质网内的糖基化修饰,使糖链加工受阻,从而形成脱糖蛋白,诱导ERS。根据细胞存活率筛选TM的最佳作用质量浓度,通常当细胞存活率下降至60%左右时(即下降40%)为最有效的损伤处理质量浓度。如图3所示,与对照组相比,TM质量浓度为1.25 µg/mL时开始出现显著抑制作用(P<0.05),当TM质量浓度为2.5 µg/mL和5 µg/mL时,原代神经元细胞的存活率分别为64.22%和55.27%。由于原代培养的神经元敏感性较强且本身存在一定的ERS[10],本实验选择质量浓度2.5 µg/mL的TM建立ERS神经元细胞模型。

图3 不同质量浓度的TM对原代神经元细胞活性的影响Fig. 3 Dose-dependent effect of TM on the viability of primary neurons
2.2.2 TM作用时间的筛选
如图4所示,与对照组相比,TM处理12 h后细胞存活率为79.74%,显著下降(P<0.05),TM处理24 h后细胞存活率为64.72%,极显著下降(P<0.01),TM处理36 h后细胞存活率为50.85%,高度显著下降(P<0.001),说明TM处理时间过长,导致神经元死亡,不利于后续实验进行。因此建立ERS神经元细胞模型时,TM处理时间设置为24 h。

图4 不同TM处理时间对原代神经元细胞活性的影响Fig. 4 Effect of TM treatment time on the viability of primary neurons
2.2.3 Res作用浓度的筛选
如图5所示,随着Res浓度的升高,神经元的细胞存活率在升高到一定程度后不断降低。与TM组相比,5 μmol/L Res组的细胞存活率为80%左右(P<0.05);当Res浓度为0.625、1.25 μmol/L和2.5 μmol/L时,与TM组相比无显著性差异(P>0.05),说明Res预处理浓度较低时不能发挥作用;当Res浓度为15 μmol/L时,细胞存活率为64.73%,与TM组存活率几乎持平。当Res浓度为25 μmol/L时,细胞存活率为43.73%,与TM组相比存在极显著差异(P<0.01),表明当Res浓度超过15 μmol/L时,失去保护神经细胞的功能。综上,预处理10 h浓度为5 μmol/L的Res能减弱TM引起神经元细胞的ERS作用,提高神经元存活率,延缓神经元的凋亡。因此,本实验后续选择Res处理浓度为5 μmol/L。

图5 不同浓度Res预处理对TM引起的原代神经元细胞损伤的影响Fig. 5 Dose-dependent effect of Res on cell viability of primary neurons damaged by TM
2.2.4 Res作用时间的筛选
由图6可知,与TM组相比,Res预处理14 h后细胞存活率显著升高(P<0.05),但细胞存活率低于Res预处理10 h组。这一结果说明Res保护神经元的作用受到预处理时间的影响,预处理时间太短发挥不了保护作用,时间过长会失去保护作用,可能是由于Res的生物活性发生了改变,其原因需要进一步探究。因此,选择Res预处理时间为10 h。

图6 Res预处理时间对TM引起的原代神经元细胞损伤的影响Fig. 6 Effect of Res preconditioning time on cell viability of primary neurons damaged by TM
2.3 TM诱导原代神经元内ERS信号通路的激活
热休克蛋白(heat shock protein,Hsp)是一类应激蛋白,该蛋白可以短时间结合其他蛋白,并协助其进行正确折叠。葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)属于热休克蛋白Hsp70亚家族,主要位于内质网。GRP78对保证蛋白质进行正常的糖基化和折叠、膜蛋白和分泌蛋白的正确定位以及阻止异常的蛋白是必不可少的。氧化应激、化学毒性、糖基化抑制剂(如TM)和缺氧等条件可以诱导GRP78表达从而引发ERS。因此,GRP78水平是ERS的重要检测指标。
如图7所示,与对照组相比,质量浓度2.5 μg/mL TM处理24 h后,GRP78相对表达量高度显著升高(P<0.001),进一步验证了ERS原代神经元细胞模型建立成功。与TM组相比,R10T组GRP78相对表达量极显著降低(P<0.01),而R0T组GRP78相对表达量差异不显著。结果表明,Res预处理神经元可以下调GRP78表达,缓解TM所引起的原代神经元ERS。
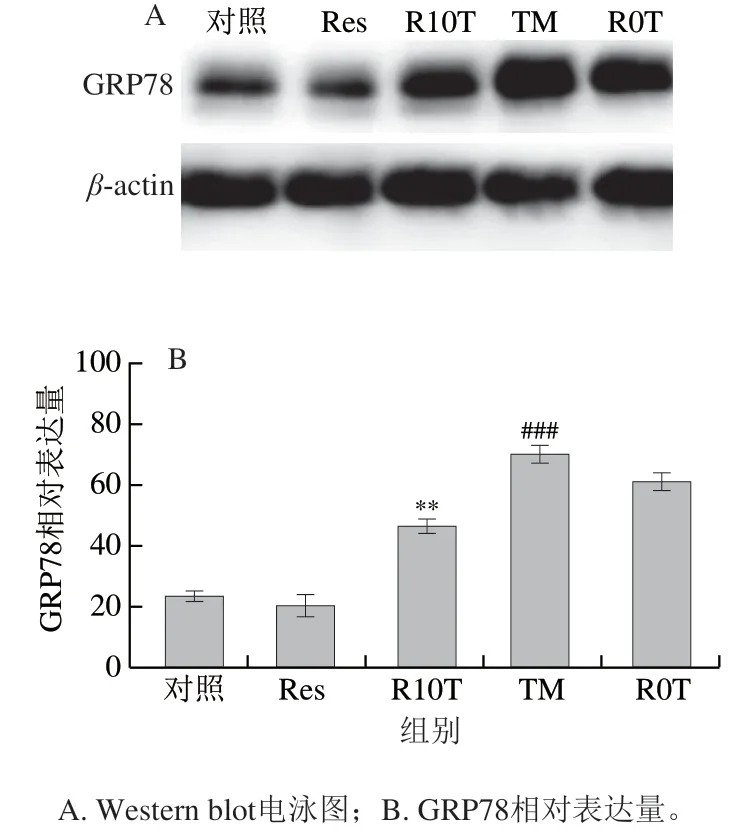
图7 Res对ERS原代神经元模型中GRP78表达水平的影响Fig. 7 Effect of Res on GRP78 expression level in ERS primary neurons
2.4 Res作用于ERS原代神经元细胞模型后对原代神经元细胞的影响
如图8所示,与对照组相比,TM组细胞凋亡率高度显著升高(P<0.001)。与TM组相比,R10T组细胞凋亡率极显著降低(P<0.01),为(12.30±0.64)%。结果表明,5 μmol/L Res能抑制TM引起的原代神经元细胞凋亡。
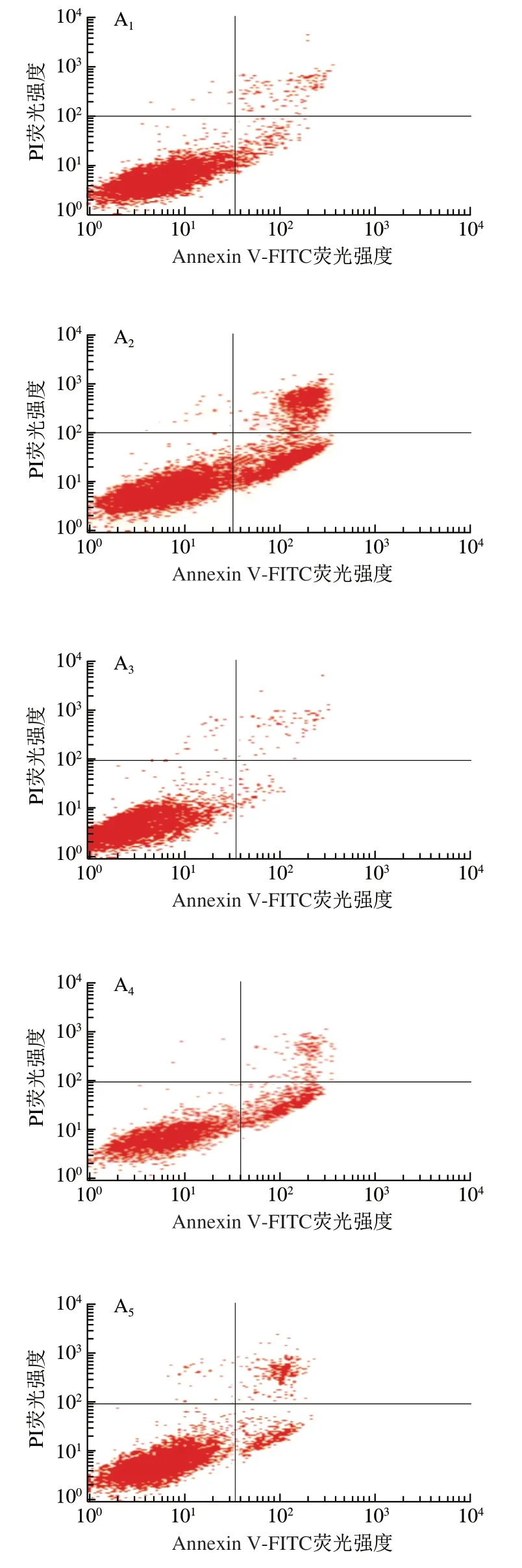

图8 Res对TM诱导后的原代神经元细胞凋亡率的影响Fig. 8 Effect of Res on the apoptosis rate of primary neurons damaged by TM
2.5 Res对ERS神经元细胞模型ERS的影响
2.5.1 Res对ERS神经元细胞模型中Caspase 3表达水平的影响
ERS激活后,可以通过肌醇依赖性激酶1α(inositol requiring enzyme 1α,IRE1α)下游的信号通路引起Caspase级联反应,激活Caspase 3,引起细胞凋亡。为探究Res作用于ERS原代神经元细胞模型后对细胞凋亡的影响,用Western blot法检测了Caspase 3蛋白的表达情况。如图9所示,用TM处理后,相较于对照组,细胞中Caspase 3相对表达量高度显著上调(P<0.001)。相较于TM组细胞,R10T组细胞中Caspase 3的表达显著下调(P<0.05)。

图9 Res对ERS原代神经元模型中Capase 3表达水平的影响Fig. 9 Effect of Res on caspase 3 expression in ERS primary neurons
2.5.2 Res对ERS原代神经元细胞模型中GRP78、GSK3β和p-GSK3β表达水平的影响
用Western blot法同时检测了GRP78、糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)、磷酸化糖原合成酶激酶3β(phosphorylated glycogen synthase kinase 3β,p-GSK3β)蛋白的表达情况。如图10所示,与TM组相比,R10T组GRP78相对表达量显著下降(P<0.05),GSK3β相对表达量下降(P>0.05),p-GSK3β相对表达量高度显著升高(P<0.001)。4-PBA是一种化学分子伴侣,可促进蛋白在内质网中的运输和折叠,可作为缓解ERS的抑制剂[11]。SB216763是有效的GSK-3β抑制剂,可抑制GSK3β活性[12]。加入4-PBA后,4P TM组和TM组相比GRP78、p-GSK3β相对表达量均极显著下降(P<0.01),GSK3β相对表达量显著下降(P<0.05)。加入SB216763后,不论是预先加SB216763还是后加SB216763的TM组,与单独TM组相比,p-GSK3β相对表达量极显著或高度显著性下降(P<0.01、P<0.001),GRP78相对表达量无显著性差异(P>0.05),即GSK3β不影响GRP78表达。

图10 Res对ERS原代神经元细胞模型中GRP78、GSK3β和p-GSK3β表达水平的影响Fig. 10 Effect of Res on GRP78, GSK3β and p-GSK3β expression in ERS primary neurons
2.6 Res对ERS原代神经元细胞模型中自噬和凋亡相关蛋白的影响
2.6.1 Res对TM处理引起Beclin1蛋白表达量的影响
Res能缓解由TM引起的原代神经元细胞ERS,此阶段会引起自噬的变化。用Western blot同时检测了Beclin-1、LC3B蛋白的表达情况。如图11所示,与对照组相比,TM组Beclin-1相对表达量极显著上调(P<0.01),LC3B相对表达量无显著变化(P>0.05)。与TM组相比,R10T组Beclin-1、LC3B相对表达量显著上调(P<0.05)。
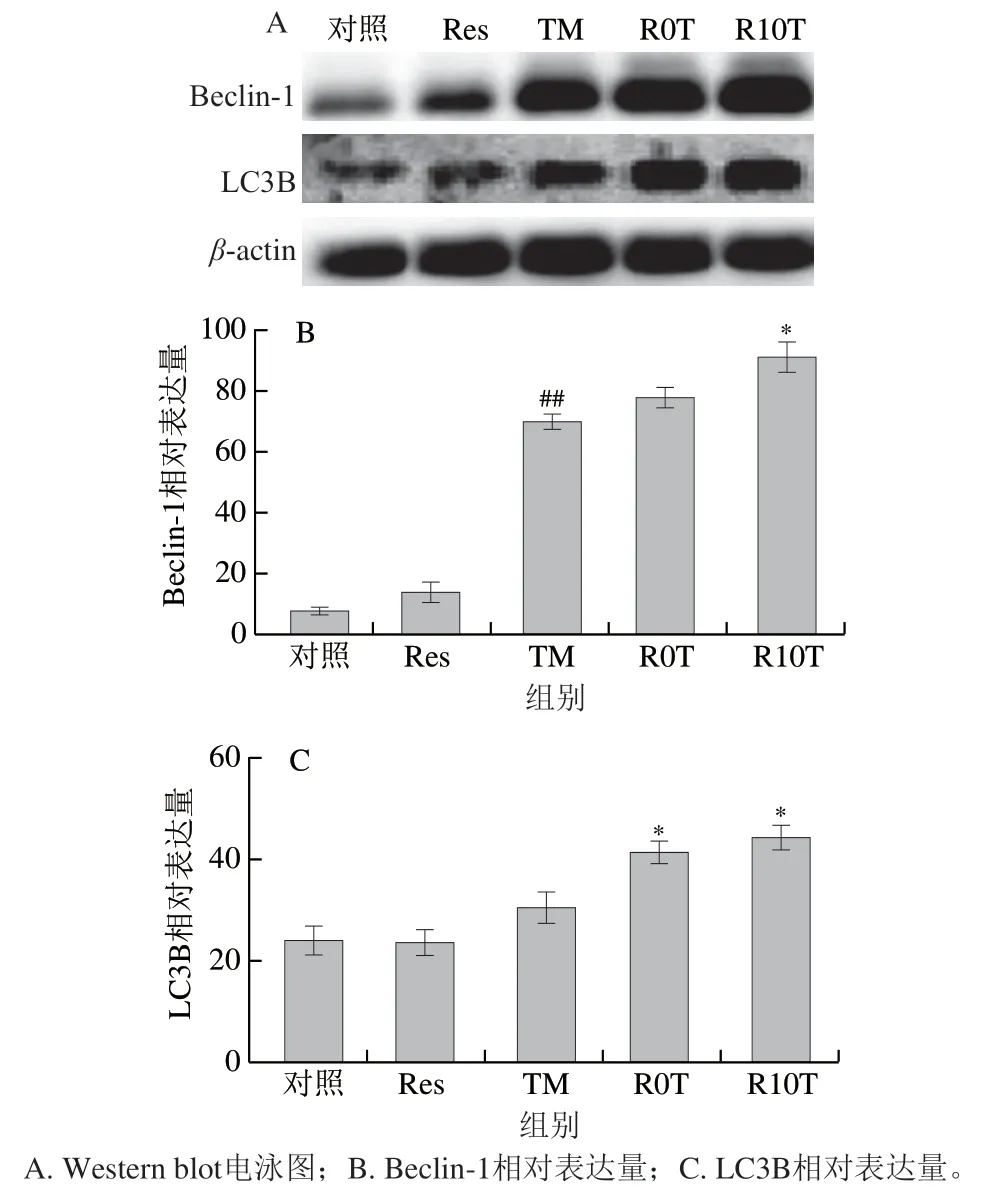
图11 Res对ERS原代神经元细胞模型自噬的影响Fig. 11 Effect of Res on autophagy in ERS primary neurons
2.6.2 Res对ERS细胞模型的保护作用与自噬之间的关系
如图12所示,为了阐明Res作用于ERS细胞模型后的保护作用与自噬之间的关系,4-PBA抑制ERS,与TM组相比,加入4-PBA的各分组LC3B相对表达量高度显著下降(P<0.001),加入4-PBA的TM组Bcl2相对表达量极显著下降(P<0.01),加入4-PBA的R0T组和R10T组Bcl2相对表达量均高度显著下降(P<0.001),说明在初期阶段ERS被抑制,导致自噬下调,会造成神经元的死亡。加入SB216763处理组中,后加入SB216763的R10T组Bcl2相对表达量与TM组相比显著上调(P<0.05),预先加入SB216763的R10T组与TM组相比极显著下调(P<0.01)。Bcl2是一种抗凋亡蛋白,根据其在不同的细胞所利用的模型系统不同,Bcl2对细胞自噬与凋亡的调控也不同。当Bcl2位于内质网时,Bcl2与Beclin-1结合在一起,此时抑制Beclin-1促进自噬的功能。当Bcl2被磷酸化后,与Beclin-1分离,释放Beclin-1,促进自噬。研究表明[13],一般情况下Beclin-1与Bcl2结合,使Beclin-1免于切割,Bcl2表达量较少时,不会抑制Beclin-1促进自噬的功能,从而增强自噬,促进细胞存活[13]。但当二者分离时,Beclin-1会被切割,并从内质网移位到线粒体,失去诱导自噬的功能,此时Bcl2相对表达量上调,发挥其抗凋亡特性。因此Beclin-1可能在增强自噬方面起主导作用,而Bcl2起维持自噬的作用。Beclin-1可能不仅是调节自噬的重要蛋白,而且也是调节自噬和凋亡两条途径之间转换的蛋白。

图12 Res对ERS原代神经元细胞模型中Beclin-1、LC3B和Bcl2表达水平的影响Fig. 12 Effect of Res on Beclin-1, LC3B and Bcl2 in ERS primary neurons
2.6.3 Res对ERS原代神经元模型中Beclin1-C和Caspase 3表达水平的影响
C-末端片段易位至线粒体并使细胞对凋亡信号敏感,而N-末端Beclin-1片段不能诱导自噬。为进一步探究自噬与凋亡之间的转换关系,用Western blot检测了Beclin1-C、Caspase 3蛋白的表达情况。如图13所示,与TM组相比,R10T组Beclin1-C、Caspase 3相对表达量均显著或极显著下调(P<0.05、P<0.01)。与TM组相比,加入4-PBA的TM组Caspase 3相对表达量极显著升高(P<0.01)。

图13 Res对ERS原代神经元模型中Beclin1-C和Caspase 3表达水平的影响Fig. 13 Effect of Res on Beclin 1-C and caspase 3 expression in ERS primary neurons
2.6.4 Res对ERS原代神经元细胞周期的影响
成熟神经元是终末分化的细胞,不具备增殖能力。在细胞周期中始终处于G1期。在某些病理情况下,成熟神经元的细胞周期可以被激活,重新进入细胞周期。本实验所提取的神经元源自胎鼠,胎鼠脑内存在大量未分化的神经干细胞。因此,在体外培养神经元成熟之前,存在细胞周期的变化。
如图14所示,与对照组相比,Res单独作用于原代神经元时,G1/G0期细胞百分比下降,而S期细胞百分比上升,同时4N期细胞百分比极显著上升(P<0.01)。与TM组相比,Res单独作用于原代神经元时,S期细胞百分比极显著上升(P<0.01),R10T组S期细胞的百分比增加,且出现了4N期细胞。可以初步判断,Res能使神经元细胞周期重激活,促使神经元细胞周期由G1/G0期向S期转移。

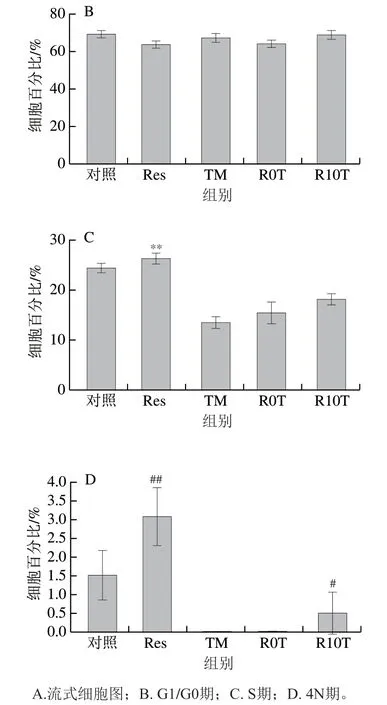
图14 Res对TM诱导后的原代神经元细胞周期的影响Fig. 14 Effect of Res on cell cycle of primary neurons damaged by TM
3 讨 论
AD是老年痴呆的最常见类型之一[14]。绝大多数AD发病年龄较晚,尚无明确的特异性指标对其进行检测,容易错过最佳治疗时期。AD的标志性病理特征主要分为两大类:一是老年斑;二是神经原纤维缠结。这些变化最终伴随着神经元的逐渐损伤和死亡[15-16]。NSC是多能干细胞,可以分化为神经元、少突胶质细胞、小胶质细胞和星形胶质细胞[17]。近年来,研究人员对利用干细胞技术在药物研发、疾病建模和细胞治疗方面的研究越来越感兴趣,这些技术已被用于研究包括AD在内的一系列人类疾病[18]。
在AD患者脑中,尚未发生病变的正常神经元能检测出ERS标志性蛋白增多的现象,即ERS发生于病理特征出现之前,是一种早期的应激性反应[19]。若ERS持续进行会导致神经细胞内过氧化物增多,凋亡信号通路被激活等一系列反应,造成神经细胞的损伤甚至死亡。因此,AD早期ERS的干预是预防此类疾病的一个新的切入点。
越来越多的研究表明,ERS一定程度上可以激活自噬,并调控自噬对细胞的作用效果,也可以作为应答ERS从而缓解细胞损伤的一种机制[20]。神经元中出现ERS时,异常折叠蛋白大量滞留在内质网腔内,导致未折叠蛋白反应(unfolded protein response,UPR),当UPR信号不能缓解ERS状态时则会启动细胞凋亡程序[21]。GSK3β参与ERS诱导的细胞凋亡,是多种信号通路的调节者[22]。但是关于GSK3β与ERS之间的上下游关系目前尚不清楚,有学者认为GSK3β可以调控ERS[23],而有学者认为ERS可以影响GSK3β[24]。本研究通过构建ERS神经元细胞模型,分别加入4-PBA、SB216763两种抑制剂,以探讨ERS与GSK3β之间的关系。通过Western blot分析发现,TM作用于原代神经元,可以激活ERS信号通路,上调相关蛋白GRP78、Caspase 3表达,使神经元死亡。而Res能显著降低神经元的ERS,抑制神经元死亡。加入4-PBA后,GRP78、P-GSK3β表达量下降,加入SB216763后,P-GSK3β表达量下降,GRP78无显著变化,这说明GSK3β可能是ERS的下游信号分子,即TM引起ERS后,会抑制下游GSK3β的磷酸化,进而造成神经元死亡。加入Res后,其可以通过促进GSK3β的磷酸化减少神经元死亡。神经元细胞发生ERS时会引起细胞自噬,当ERS被抑制时,自噬也会被抑制,Res作用于神经元细胞时,可通过上调Beclin-1、LC3B蛋白的表达,保护Beclin-1不被Caspase切割,进一步增强或维持自噬水平。当Beclin-1发生切割时,意味着自噬功能逐渐减弱,此时Beclin1-C发挥促凋亡功能,这也意味着细胞由保护性自噬转向凋亡。
酚类主要分为黄酮类和非黄酮类。黄酮类多酚原花青素能通过降低磷酸化tau蛋白水平、核因子κB(nuclear factor kappa-B,NF-κB)的活性及激活蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)/真核细胞起始因子2α(eukaryotic initiation factor 2α,eIF2α)和肌醇依赖性激酶1α(inositol-requiring enzyme 1α, IRE1α)/凋亡信号调节激酶1(apoptosis signal-regulating kinase 1,ASK1)/C-Jun氨基末端激酶(C-Jun N-terminal kinase,JNK)通路来抑制脑中产生的ERS和炎症反应[25]。其他黄酮类多酚有相似特点,并且能提高神经元分化标志物(GAP-43、神经纤维丝、突触素等)的表达水平,如葛根、姜黄素、槲皮素、黄酮醇和阿魏酸等[26]。对于非黄酮类多酚,研究发现没食子酸能够通过激活丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)/细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)通路中关键蛋白ERK1/2的磷酸化来发挥NSC增殖作用,诱导其分化[27]。Res是一类非黄酮类多酚,具有抗氧化、抗炎和神经保护等特性,可降低AD患者海马Aβ肽的毒性和聚集[28],促进神经生长,防止海马神经元细胞损伤[29]。其抗氧化活性通过激活SIRT1在神经元分化中发挥重要作用[30],并通过去乙酰化和抑制p53活性来防止神经元凋亡[31],下调C/EBP同源蛋白(C/EBP homologous protein,CHOP)和凋亡蛋白Caspase 3的表达抑制CHOP信号通路,通过调控Beclin-1、LC3B表达量进一步增强自噬或维持自噬。然而,目前确切的机制仍不清楚。基质金属蛋白酶-9(matrix metalloprotein,MMP-9)是一种与AD相关的炎症标志物。Moussa等[32]研究报道,与安慰剂组相比,Res(1 g/d)治疗52 周的患者MMP-9表达水平降低。此外,使用Res治疗的AD患者脑脊液几乎没有减少,较少的患者脑中Aβ积累也较低[33]。Res可能增强了CNS,阻碍了MMP-9渗透,降低了炎性因子活性[34]。动物实验证明,Res能通过线粒体通路对D-半乳糖致衰老小鼠脑神经细胞产生保护作用[35],也能通过SIRT1-UCP2通路对氧糖剥夺模型大鼠NSC损伤具有保护作用[36]。综上,Res对原代神经元有保护作用,具有抗AD的潜力。
4 结 论
本实验意在探究Res在神经细胞内对ERS的调控及对自噬、凋亡、周期的之间的交互关系。将原代神经元细胞用TM进行处理,以诱导细胞内ERS的产生,从而建立ERS细胞模型。结果表明,Res浓度为5 μmol/L时,能减弱TM引起的神经元细胞的ERS作用,提高神经元细胞存活率,延缓神经元细胞凋亡。对原代神经元细胞分组进行细胞周期检测与分析,发现TM可以明显阻滞G1/G0期细胞向S期转变,而Res处理可以减轻TM诱导的G1期细胞阻滞。Western blot结果表明,TM可以诱导细胞自噬蛋白Beclin1-C、LC3B、Bcl2的表达,而Res均能起到逆转作用。
综上,利用TM在原代神经元中诱导ERS,引起细胞自噬,而Res可通过调控Beclin-1、LC3B相对表达量进一步增强自噬或维持自噬,其可通过下调CHOP蛋白表达抑制CHOP信号通路,下调凋亡蛋白Caspase 3表达。Res抑制CHOP后,会进一步促进其下游细胞周期蛋白D1的表达,推动细胞周期由G1/G0期进入到S期,从而使细胞周期重激活,提高神经元细胞存活率,以延长神经元的存活时间。本实验结果可为研究Res作用于ERS模型后自噬、凋亡和周期之间所发生的变化提供一定的理论参考。然而,ERS、凋亡、自噬和周期涉及了细胞多种不同途径,各自的信号通路之间也存在错综复杂的关系,且两者或者多者之间的具体调控机制需进一步深入探索。

