基于蛋白质组学探究西兰花抗氧化系统对高氧胁迫的响应机制
张玉笑,陈 颖,郭衍银,马阳历,杨 梅,付瑞青,孙玉芃
(山东理工大学农业工程与食品科学学院,山东 淄博 255049)
西兰花含有丰富的抗氧化物质,如硫代葡萄糖苷(glucosinolate,GLS)、抗坏血酸(ascorbic acid,AsA)、谷胱甘肽(glutathione,GSH)等[1]。GLS是目前发现抗癌能力最强的异硫氰酸酯类[2]。AsA、GSH形成的AsA-GSH循环在机体抵御外界胁迫、平衡氧化还原环境、延缓衰老等方面均发挥重要作用[3]。同时,西兰花中还含有大量的酚类物质、类黄酮和花色苷等,对于清除机体自由基、抑制细胞癌变和肿瘤发生均具有重要作用[1]。
西兰花采后极易衰老,常温下贮藏2~3 d便会因严重黄化而丧失商品价值。研究表明,西兰花黄化衰老与抗氧化物质代谢有直接关系[4]。因此,维持抗氧化系统的稳定对延缓西兰花采后衰老至关重要[5]。但西兰花保鲜研究大多局限于个别抗氧化酶及抗氧化物质的分析,很少通过蛋白质组学技术整体分析西兰花抗氧化系统应对逆境的响应机制。
目前,针对CO2处理的保鲜研究较为广泛[6],而关于高氧胁迫与抗氧化代谢之间的关系少有研究。前期研究发现,40% O2处理加速了西兰花黄化衰老[6],但具体机制需要进一步研究。
蛋白质组学是一种在分子水平上检测生物体全部蛋白质结构、功能和含量的高效分析技术,已成功应用于多种果蔬贮藏期间品质变化机制的研究。本实验以西兰花为材料,通过同位素相对与绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)蛋白质组学技术结合相应生理生化指标,系统揭示高氧胁迫下西兰花抗氧化物质和抗氧化酶在蛋白水平上的代谢变化及其响应机制,为高氧胁迫调控措施的制定提供参考。
1 材料与方法
1.1 材料与试剂
‘优秀’(Brassica oleraceaL. var.italica)西兰花采自山东省潍坊市刘家茅坨村,选取花球直径12~14 cm、色泽一致、无机械伤和病虫害的西兰花作为实验样品。
8-plex试剂盒 美国Applied Biosystems公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、二硫苏糖醇(dithiothreitol,DTT)、二甲基亚砜、三氯乙酸、三羟甲基氨基甲烷、尿素、碘乙酰胺 美国Sigma公司;胰蛋白酶(2 500 U/mg) 上海普洛麦格生物产品有限公司;乙腈 美国Thermo Fisher公司;还原型GSH试剂盒、偏磷酸、醋酸、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、2,6-二氯酚靛酚、福林-酚 北京索莱宝科技有限公司;其他试剂为国产分析纯。
1.2 仪器与设备
UV-1750型紫外-可见分光光度计 日本岛津有限公司;FA1204B型分析天平 上海赛多利斯科学仪器有限公司;5810/5810R冷冻离心机 德国Eppendorf公司;DDS-307A电导率仪 上海精密科学仪器有限公司;DW-HL218超低温冰箱 合肥中科美菱低温科技有限公司;CR-400全自动测色色差计 日本Konica Minolta公司;1260半制备型液相色谱仪 美国Agilent公司;Triple TOF 5600 plus串联四极杆飞行时间液相色谱-质谱联用仪 美国Sciex公司;Nano LC-Ultra 1Dplus液相色谱仪 美国Eksigent公司;气调箱(80 cm×40 cm×30 cm) 山东大有泡塑股份有限公司。
1.3 方法
1.3.1 采后西兰花预处理
采收后的西兰花在4 ℃下预冷3 h后随机分成3 个处理组,每组24 个。将3 组西兰花分别置于气调箱内,并转移到(20.0±0.5)℃的冷库内,分别持续充入5%(体积分数,下同)O2+5% CO2、20% O2+5% CO2和40% O2+5% CO2的混合气体,以N2为平衡气体。贮藏期间每天取样,进行相关指标测定,并将0 d和4 d时的西兰花样品用液氮冷冻后存放在-80 ℃冰箱内,用于蛋白质组学分析。
1.3.2 生理指标测定
1.3.2.1 色度测定
色度值(a*、b*和H值)使用CR-400全自动测色色差计测定,每组选取3 个西兰花,在花球边缘位置选取5 个等距位置进行测定,记录a*和b*值。当a*>0且b*>0时,H值计算如公式(1)所示;当a*<0且b*>0时,H值计算如公式(2)所示。

1.3.2.2 AsA含量测定
AsA含量采用DNPH比色法[6]测定。结果以鲜样品质量计,单位为g/kg。
1.3.2.3 GSH含量测定
GSH含量通过还原型GSH试剂盒测定。取1 g西兰花样品,加入5 mL 0.1 mol/L磷酸盐缓冲液(pH 7.0)研磨成浆,随后在4 ℃、10 000 r/min条件下离心15 min,取上清液后按照还原型GSH试剂盒说明书测定GSH含量。
1.3.2.4 GLS含量测定
GLS含量测定参考Miao Huiying等[2]的方法并略作修改。取0.5 g西兰花样品,用5 mL体积分数90%甲醇溶液提取后,室温静置1 h。随后在12 000 r/min条件下离心20 min,收集上清液用于GLS含量测定。采用苯酚硫酸法测定葡萄糖含量,并通过葡萄糖含量计算样品中GLS含量,单位为mmol/kg。
1.3.2.5 多酚和类黄酮含量测定
多酚含量采用福林-酚法[7]测定;类黄酮含量参照Li Shiping等[8]方法测定。
1.3.3 蛋白质组学分析
1.3.3.1 蛋白质提取
将西兰花样品冷冻干燥后,取3 g样品加入5 mL裂解缓冲液(pH 7.6,内含1 mmol DTT和质量浓度0.04 mg/mL SDS)裂解蛋白,120 W超声处理15 min后,15 000 r/min离心20 min。向上清液中加入5 倍体积的10%(体积分数,下同)三氯乙酸溶液,再次离心后收集沉淀。使用预冷丙酮洗涤两次沉淀后,向蛋白质沉淀中加入0.5 mL Tris-HCl缓冲液(pH 8.0,内含8 mol/L尿素),振荡至完全溶解。再加入0.2 mL DTT溶液(内含50 mmol/L DTT和8 mol/L尿素),37 ℃水浴1 h。随后加入0.1 mL 50 mmol/L碘乙酰胺溶液,静置1 h后15 000 r/min离心20 min,上清液即为蛋白提取液。按照Bradford[9]的方法测定蛋白质量浓度。
1.3.3.2 iTRAQ标记和多肽分离
在蛋白溶液中按照蛋白质与酶质量比30∶1加入胰蛋白酶,37 ℃酶解4 h,立即加入2 μL 0.2%三氟乙酸来终止酶解。通过固相萃取柱Sep-Pak C18进行脱盐后,将多肽经离心浓缩仪脱水干燥。通过8-plex试剂盒对酶解后的肽段进行iTRAQ标记。标记后的多肽使用1260半制备型高效液相色谱仪进行分离,最终合并成20 个组分。色谱柱为Tech Mate C18柱(150 mm×4.6 mm,5 µm)。流动相A为20 mmol/L甲氨酸溶液(氨水调pH值至10),流动相B为20 mmol/L甲氨酸-乙腈溶液;进样量为100 μL;流速为0.2 mL/min;柱温为25 ℃;运行时间为60 min;检测波长为216 nm。
1.3.3.3 液相色谱-串联质谱分析
通过四极杆飞行时间液相色谱-串联质谱联用仪对样品进行液相色谱-二级质谱分析。色谱柱为Eksigent C18(75 μm×150 mm,3 μm)。流动相A为含0.1%(体积分数)甲酸和3%(体积分数)二甲基亚砜的水溶液,流动相B为含0.1%甲酸和3%二甲基亚砜的乙腈溶液。洗脱梯度为0 min,5% B;0~65 min,5%~23% B;65~85 min,23%~52% B;85~86 min,52%~80% B;86~90 min,80% B;90~90.1 min,80%~5% B;90.1~100 min,5% B,流速为300 nL/min。
按照质谱数据依赖型扫描模式扫描,每个扫描循环中包含1 个MS全扫描(质量扫描范围为m/z350~1 500,离子累积时间为250 ms)和40 个MS/MS扫描(质量扫描范围为m/z100~1 500,离子累积时间为50 ms)。
1.3.3.4 生物信息学分析
差异表达蛋白的筛选以表达差异倍数≥1.20或≤0.83为标准。鉴定后的差异表达蛋白通过Genome蛋白数据库(http://www.rosaceae.org/node/355)进行基因本体论(gene ontology,GO)注释。通过同源蛋白簇(clusters of orthologous groups,COG)数据库(http://www.ncbi.nlm.nih.gov/COG/)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库(http://www.genome.jp/kegg/)对差异表达蛋白进行注释和分类。
1.4 数据处理与分析
生理指标或蛋白质组学分析中所有样品的测定均重复3 次,实验结果以平均值±标准差表示。数据统计分析采用SPSS Statistics 26软件,通过单因素方差分析进行Duncan多重检验(以P<0.05表示差异显著)。
2 结果与分析
2.1 高氧胁迫对西兰花的生理指标的影响
2.1.1 高氧胁迫对西兰花色度的影响
黄化是西兰花品质劣变的重要表观评价指标,而色度值能直接反映出西兰花的颜色变化。b*值代表黄蓝度,其越高颜色越黄。H值代表色相,其与成熟度成反比。如图1A、B所示,西兰花的b*值和H值在整体上分别呈上升和先上升后下降的趋势,且40% O2+5% CO2处理维持了更高的b*值和更低的H值。贮藏4 d时,40% O2+5% CO2处理西兰花的b*值比5% O2+5% CO2和20% O2+5% CO2处理分别增加70.86%和15.14%,这说明高氧胁迫显著加剧了西兰花黄化。
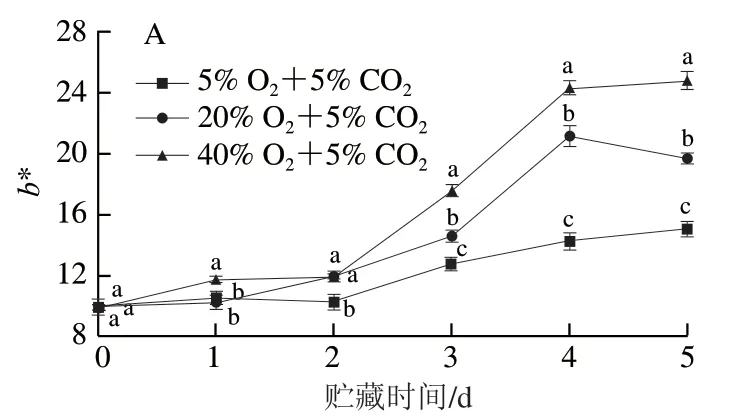
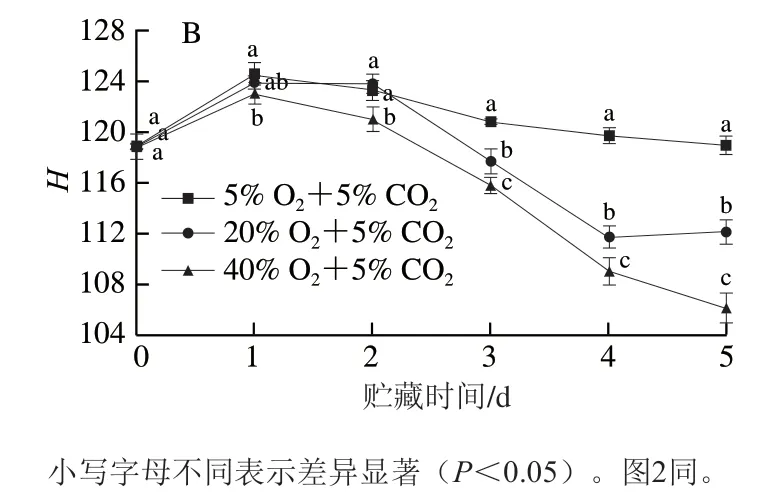
图1 不同氧气体积分数对西兰花b*值(A)和H值(B)的影响Fig. 1 Effects of different O2 concentrations on b* (A) and H (B) values of broccoli heads
2.1.2 高氧胁迫对西兰花抗氧化物质含量的影响
西兰花抗氧化物质的降解,既反映了自身自由基清除能力的降低,又反映了其营养品质的损失。贮藏期间,西兰花GLS、AsA含量和GSH含量均呈下降趋势,且40% O2+5% CO2处理组的GLS、AsA含量和GSH含量明显低于5% O2+5% CO2处理组和20% O2+5% CO2处理组(图2A~C)。40% O2+5% CO2处理组西兰花GLS、AsA和GSH含量在4 d时仅分别为5% O2+5% CO2处理组的62.20%、60.32%和79.91%,这表明高氧胁迫严重加剧了西兰花抗氧化物质的降解,并降低了西兰花对胁迫的抵御能力。
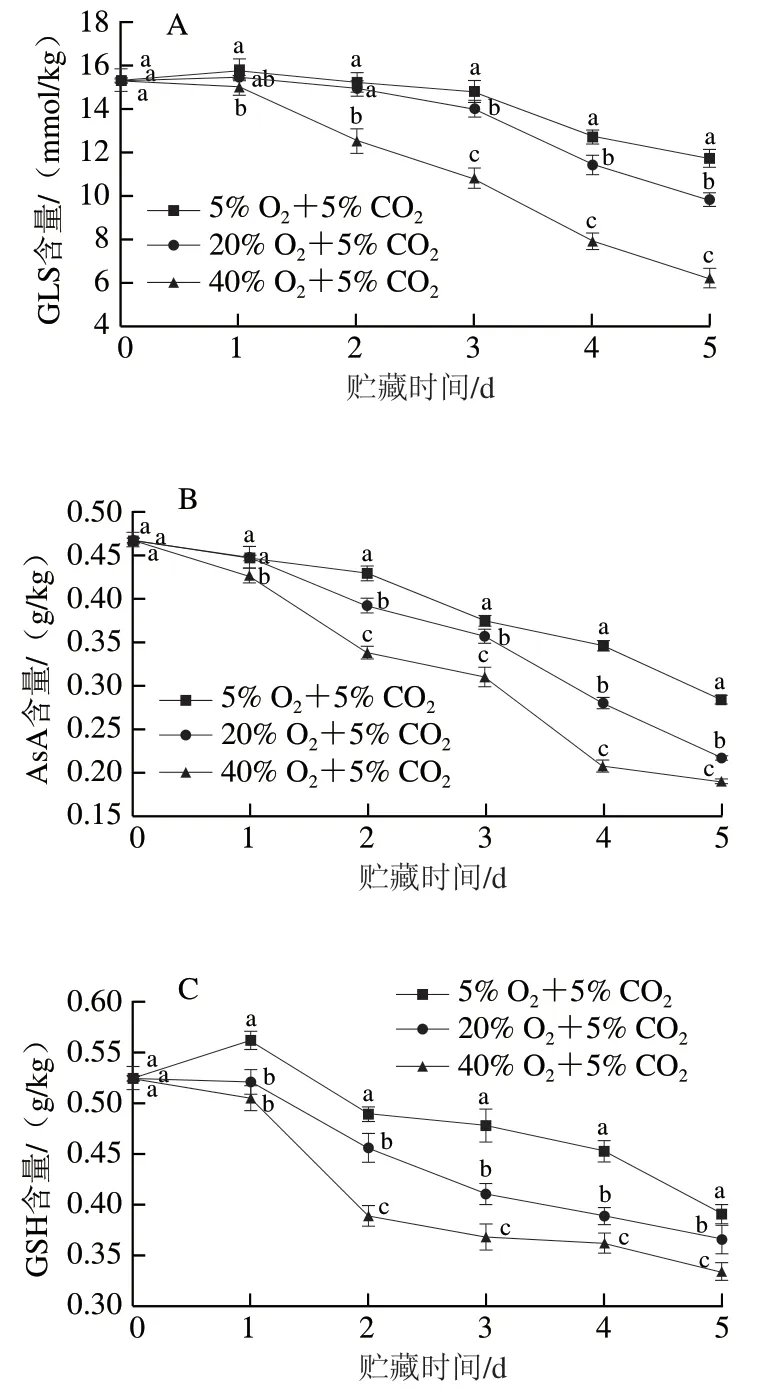

图2 不同氧气体积分数对西兰花GLS(A)、AsA(B)、GSH(C)、多酚(D)和类黄酮(E)含量的影响Fig. 2 Effects of different O2 concentrations on the contents of GLS (A),AsA (B), GSH (C), polyphenols (D) and flavonoids (E) in broccoli heads
各组西兰花的多酚含量和类黄酮含量均呈先升高后降低的趋势(图2D、E)。在贮藏1 d时,40% O2+5% CO2处理的西兰花多酚含量和类黄酮含量显著高于低O2处理组(P<0.05),2 d后迅速降低,贮藏结束时则显著低于5% O2+5% CO2处理组(P<0.05),这可能与高氧胁迫在贮藏前期激活了西兰花中多酚和类黄酮的生物合成途径有关。
综上所述,高氧胁迫加速了西兰花的黄化和抗氧化物质的整体降解,严重降低了西兰花的抗氧化能力。另外研究发现,在贮藏4 d时西兰花的色度值与抗氧化物质含量均发生了较为明显的变化,尤其是40% O2+5% CO2处理组。因此,选择贮藏0 d与4 d时各处理的西兰花样品进行蛋白质组学分析,进一步探究高氧胁迫下西兰花抗氧化系统变化及其响应机制。
2.2 蛋白质组学分析结果
通过西兰花iTRAQ蛋白质组学分析共鉴定了7 000 个可信蛋白质(至少含有一个特异性肽段,且在99%置信区间上的蛋白评分≥20),以贮藏0 d时的西兰花为相对定量参照标准,对贮藏4 d后各组西兰花中的蛋白质以表达差异倍数≥1.2(或≤0.83)为标准筛选(P<0.05),共获得1 523 个差异表达蛋白。为了有针对性分析高氧胁迫下西兰花抗氧化系统变化,通过已有文献结果结合KEGG通路分析,对与抗氧化系统相关的差异表达蛋白进行进一步筛选,共筛选出76 个差异表达蛋白,涉及到AsA-GSH循环、GLS、多酚及类黄酮、抗氧化酶代谢、其他抗氧化物质(包括叶酸、核黄素、类胡萝卜素等)等通路(表1)。
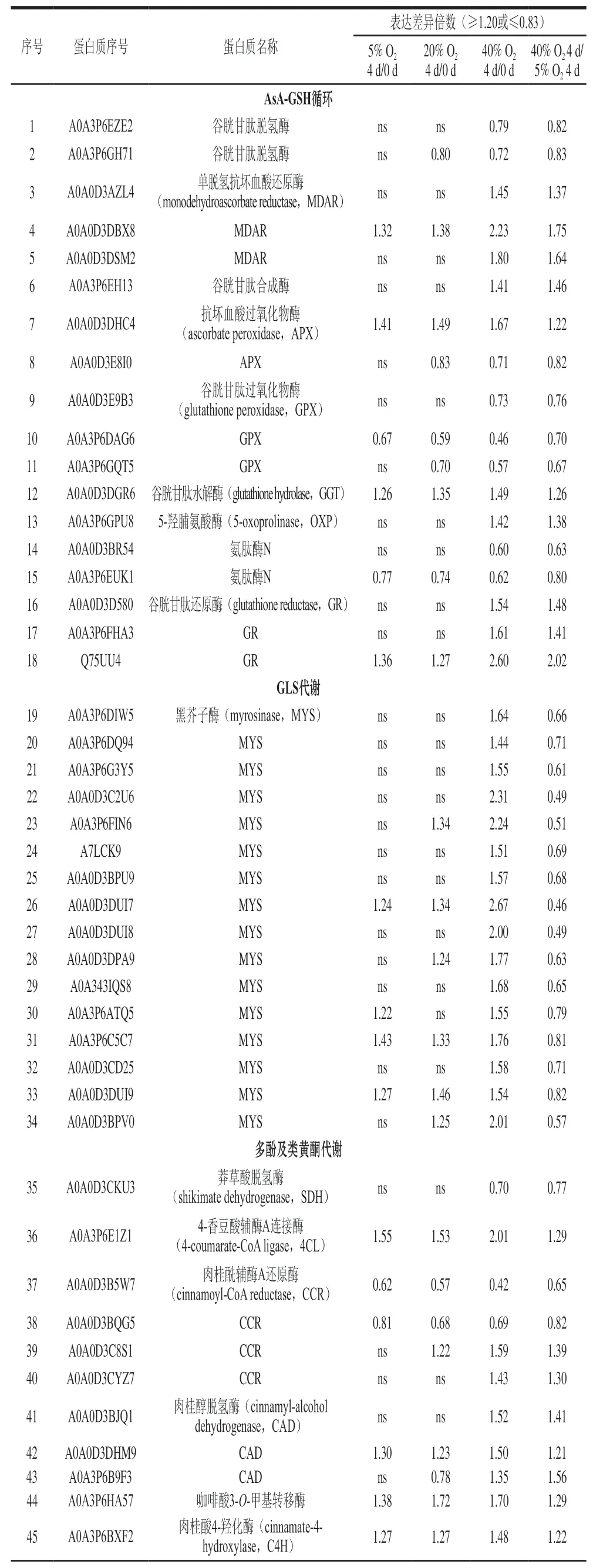
表1 不同处理组间抗氧化系统中差异表达蛋白的详细信息Table 1 Detailed information of differentially expressed proteins related to antioxidant system between different treatments

续表1
如图3A所示,各比较组中上调差异表达蛋白数量远多于下调差异表达蛋白数量,且40% O2+5% CO2处理4 d/0 d的差异表达蛋白数量远多于其他两个处理组,表明在高氧胁迫下西兰花内更多差异表达蛋白的表达被激活。维恩图分析结果表明,31 个蛋白仅在40% O2+5% CO2处理组中存在差异表达,而在5% O2+5% CO2处理组和20% O2+5% CO2处理组中未出现差异表达(图3B),这说明高氧处理可能通过调控这些抗氧化蛋白的表达,进而加速西兰花黄化衰老。

图3 差异表达蛋白质上调/下调情况(A)与维恩图(B)Fig. 3 Numbers of up-regulated and down-regulated differentially expressed proteins (A) and Veen plot (B)
2.3 生物信息学分析
2.3.1 GO注释分析
为了进一步了解西兰花在高氧胁迫下差异表达蛋白的生物学功能,对差异表达蛋白进行了GO注释分析,从分子功能、细胞成分和生物学过程方面进行富集分析,结果如图4所示。在分子功能方面,不同O2处理下的西兰花差异表达蛋白主要体现在催化活性、结合以及抗氧化活性等;细胞成分方面主要定位在细胞、细胞组分、细胞器和膜等;参与调控的生物学过程主要包括代谢过程、细胞过程以及应激反应等。另外,在几乎所有GO分析类别中,40% O2+5% CO2处理下西兰花的差异表达蛋白数量都远多于5% O2+5% CO2处理组和20% O2+5% CO2处理组,这也证明高氧胁迫对这些抗氧化系统相关蛋白的调控很可能与西兰花黄化与衰老有关。各类别中,5% O2+5% CO2处理组的差异表达蛋白同样略少于20% O2+5% CO2处理组,表明西兰花贮藏期间的抗氧化系统差异表达蛋白的表达水平随着O2体积分数的增加而增加。

图4 西兰花响应O2胁迫差异表达蛋白GO分析Fig. 4 GO analysis of differentially expressed proteins of broccoli in response to O2 stress
2.3.2 COG分析
COG富集分析结果表明,西兰花响应O2胁迫的差异表达蛋白涉及了15 类COG功能(图5)。其主要参与了碳水化合物转运和代谢、次生代谢产物生物合成、运输和分解代谢、翻译后修饰、蛋白转换和分子伴侣、一般功能预测和无机离子转运与代谢。在这些COG功能类别中,40% O2+5% CO2处理组的西兰花差异表达蛋白数量远超过低O2处理组,这说明西兰花响应高氧胁迫下抗氧化代谢的差异表达蛋白参与了更多的生理代谢途径,同时也证明这些主要的功能途径与西兰花抗氧化系统的调控具有互作关系。
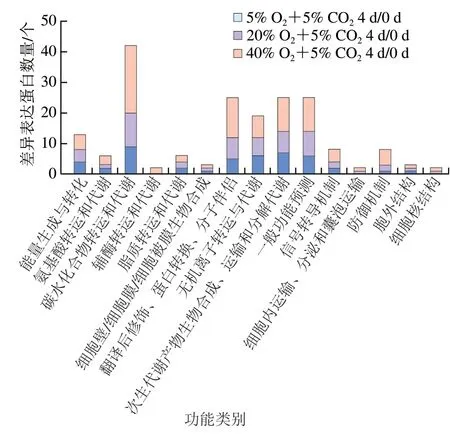
图5 西兰花响应O2胁迫差异表达蛋白的COG分析Fig. 5 COG analysis of differentially expressed proteins of broccoli in response to O2 stress
3 讨 论
有研究发现,高氧胁迫可影响西兰花抗氧化酶、抗氧化物质代谢等相关生物学过程[6,10-11]。本研究通过生理生化指标分析结合iTRAQ蛋白质组学,综合分析了高氧胁迫下西兰花抗氧化物质含量并量化了响应高氧胁迫的蛋白质,通过KEGG通路分析筛选出76 个与抗氧化代谢相关的差异表达蛋白。在KEGG通路分析的基础上,进一步分析与AsA-GSH循环、GLS代谢、多酚和类黄酮代谢、抗氧化酶代谢及其他抗氧化物质代谢等代谢通路相关的差异表达蛋白(表1),旨在揭示高氧胁迫破坏西兰花抗氧化系统机理,为进一步研究高O2胁迫的调控措施提供理论依据。
3.1 与AsA-GSH循环相关的差异表达蛋白
AsA-GSH循环是植物体清除自由基、缓解氧化损伤的重要代谢途径[12]。GR、MDAR、APX和GPX是维持AsA-GSH循环的主要酶[13]。APX和GPX不仅是植物体内重要的抗氧化酶,同时在AsA-GSH循环中重新合成脱氢抗坏血酸和氧化型GSH起到不可替代的作用[14]。蛋白质组学数据分析结果表明,相比于5% O2+5% CO2处理组和20% O2+5% CO2处理组,40% O2+5% CO2处理组上调了GR和MDAR的表达,同时下调了APX和GPX的表达,表明脱氢抗坏血酸和氧化型GSH的合成能力降低,进而影响到AsA-GSH循环的顺利进行(表1)。GGT、OXP会导致植物体GSH降解,40% O2+5% CO2处理同时上调了GGT和OXP的表达,表明高氧胁迫促进了西兰花GSH的降解,这与图2C中GSH含量降低的结果相印证。因此,高氧胁迫下APX和GPX下调与GGT和OXP上调影响了西兰花的AsA-GSH循环,进而加速了西兰花抗氧化能力的下降。有研究发现,外源AsA和GSH处理能改善西兰花的抗氧化能力,并延缓西兰花的黄化衰老[15-16],因此外源添加AsA和GSH可以作为缓解高O2胁迫破坏西兰花AsAGSH循环的有效措施。
3.2 与GLS代谢相关的差异表达蛋白
在西兰花中含有极其丰富的GLS,尤其是萝卜硫素,是西兰花重要的抗氧化物质。MYS是已发现的一类最重要的GLS降解酶,在GLS降解中发挥着不可替代的作用[17]。高氧胁迫下,本研究共鉴定出16 种差异表达MYS,且40% O2+5% CO2处理组中16 种MYS的表达均被上调,进而促进了西兰花GLS降解,图2A的结果也证实了这一点,而MYS表达上调可能是促进西兰花黄化衰老的重要原因。
3.3 多酚和类黄酮代谢相关的差异表达蛋白
莽草酸途径及苯丙烷类代谢途径是调节植物体碳流量的重要途径,也是多酚、类黄酮、类胡萝卜素、叶酸等次级代谢产物合成的关键途径[18]。4CL、CCR和CAD是多酚和木质素合成的关键酶,而C4H和CHS是类黄酮合成的限速酶[19-20]。在40% O2+5% CO2处理组中,以上蛋白质的表达几乎均被上调,这可能是贮藏初期40%O2+5% CO2处理组的多酚和类黄酮含量高于其他处理组的原因(图2D、E)。
SDH是莽草酸途径唯一的双功能酶,负责催化莽草酸和没食子酸合成;而FLS是黄酮醇合成的关键酶[21-22]。蛋白组学结果表明,40% O2+5% CO2处理组与5% O2+5% CO2处理组SDH和FLS的表达差异倍数分别是0.77 倍和0.83 倍,表明高氧胁迫下调了西兰花的莽草酸合成。莽草酸是多酚和类黄酮合成的关键前体物质,莽草酸和黄酮醇合成减少可能是高氧胁迫下西兰花贮藏后期多酚和类黄酮含量过低的主要原因(图2D、E)。
3.4 与抗氧化酶代谢相关的差异表达蛋白
SOD、CAT、TrxR、APX和GPX等是植物体内重要的抗氧化酶,负责体内超氧阴离子、自由基、H2O2等活性氧的清除,以保护细胞器不受氧化损伤。蛋白质组学结果显示,相比于5% O2+5% CO2处理组,40% O2+5% CO2处理组SOD、TrxR、APX和GPX表达下调,同时上调了CAT的表达,这说明高氧胁迫在整体上削弱了西兰花体内的抗氧化酶系统。前期研究发现,适宜浓度的高H2O2反而可以通过下调叶绿素降解酶的基因表达而延缓西兰花黄化[6,23]。因此,SOD活力降低以及CAT活力增加减少了西兰花H2O2的积累,反而可能是造成西兰花黄化和品质降低的一个重要原因[24-25]。
3.5 与其他抗氧化物质代谢相关的差异表达蛋白
类胡萝卜素是西兰花内主要的抗氧化物质,在叶绿体中起到保护叶绿素不被降解的作用,但同时也是一类导致西兰花黄化的主要呈色色素[26]。PIM、LUT5和玉米黄质环氧化酶(zeaxanthin epoxidase,ZEP)参与了类胡萝卜素合成途径的调控[27-28]。蛋白质组学分析结果表明,40% O2+5% CO2处理明显提高了PIM、LUT5和ZEP的表达水平,从而促进了类胡萝卜素合成,这可能是高氧胁迫下加速西兰花黄化的原因之一。HID是异黄酮合成的关键酶,异黄酮是重要的黄色呈色物质[29]。40% O2+5% CO2处理增加了HID的表达,这可能是高氧胁迫促进西兰花黄化的另一原因。
4 结 论
本研究通过生理生化指标结合iTRAQ蛋白质组学技术,研究了高氧胁迫下西兰花贮藏期间的蛋白质表达变化情况,在蛋白质水平上探讨了西兰花的抗氧化响应机制。结果表明,不同O2水平下共有76 个与抗氧化代谢相关的蛋白质出现差异表达。高氧胁迫通过下调西兰花APX、GPX、GGT和OXP表达抑制了AsA-GSH循环,通过下调16 种MYS表达促进GLS降解,通过抑制SOD、TrxR、APX和GPX等抗氧化酶活力降低西兰花的抗氧化能力和贮藏品质,通过上调类胡萝卜素及异黄酮的合成促进西兰花黄化。本研究综合分析了高氧胁迫下西兰花抗氧化代谢系统的变化情况和应对机制,可为高氧胁迫缓解措施的制定提供理论依据。

