果蔬汁饮料中花色苷与VC相互作用研究进展
黄金萍,吴继红,3,廖小军,劳 菲,3,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.国家果蔬加工工程技术研究中心,农业农村部果蔬加工重点实验室,北京市食品非热加工重点实验室,北京 100083;3.中国农业大学(兴化)健康食品产业研究院,江苏 兴化 225700)
果蔬汁颜色鲜艳,富含糖类、膳食纤维、维生素、无机盐等多种营养成分,加之口味众多、食用方便,是广受人们喜欢的饮品。2019年果蔬汁的市场规模占全球软饮市场的16%,市值高达1 391.36亿 美元[1]。随着“健康中国”工作的全面推进,对人体功能起改善作用的果蔬汁饮料将成为未来行业发展的热点之一。花色苷(anthocyanin,ACN)和VC是果蔬汁中重要的抗氧化活性物质,也是健康功能果蔬汁饮料研发的核心关注成分。
ACN是一种广泛存在于红、蓝、紫色果蔬的细胞液中的水溶性色素[2-3]。ACN通常由以2-苯基苯并吡喃为母核的花青素苷元和一个或多个糖通过糖苷键连接构成,部分糖苷还能够被脂肪酸或芳香酸酰化[4-5]。ACN还具有多种生理功能,如抗氧化[6-8]、抗癌[9-10]、抗菌[11]、预防心血管疾病[12-13]、调节糖代谢[14]、改善视力[15-16]及预防肥胖导致的慢性疾病[17-18]等。
VC是果蔬汁的重要营养物质之一,又称抗坏血酸,其化学名称为苏糖型-2,3,4,5,6-五羟基-2-己烯酸-4-内酯,由一个五元内酯环及其侧链组成[19]。VC具有抗氧化性、可增强机体免疫功能并参与胶原蛋白、细胞间质和神经递质合成反应以及氨基酸和铁代谢反应等[20],是多细胞生物必不可少的营养素。
但是,在果蔬汁中ACN和VC会发生相互作用,使得ACN和VC的降解速率均明显快于两者单独存在时的降解速率,导致果蔬汁的颜色、风味、营养价值大幅损失[21-23]。研究两者相互作用机制,实现果蔬汁ACN和VC相互作用的有效调控,对提高果蔬汁中ACN和VC的稳定性、提升果蔬汁的外观与营养品质具有重要意义。
针对果蔬汁饮料中ACN和VC的稳定性研究,本文在Web of Science以“anthocyanin”和“ascorbic acid”为主题词,共查找筛选了相关文献3 845 篇,其中中文文献211 篇,英文文献3 674 篇;出版年份主要集中在2012—2021年;在中国知网以“花色苷”和“抗坏血酸”为主题词,共筛选了文献253 篇,其中中文文献188 篇,英文文献65 篇。本文对上述文献进行系统梳理,旨在从机制假说、影响因素和研究方法3 个方面为果蔬汁ACN和VC相互作用后续相关研究提供理论指导与参考。
1 ACN降解机理
ACN的稳定性受到其自身结构和外在环境两方面影响。结构方面,一般来说,花色苷元羟基数目越多,稳定性越低;羟基的甲基化程度提高、游离羟基的糖苷化、脂肪酸或芳香酸的酰基化则有利于提高ACN的稳定性[4]。环境方面,pH值、温度、光、氧、酶、金属离子等都可以不同程度地影响ACN的稳定性[4]。不同的环境条件使ACN通过不同途径降解。孙建霞等[4]总结了ACN可能存在的几种降解途径和降解机制,包括热降解途径、酶降解途径、氧化降解途径、糖降解途径和光降解途径。ACN的存在形式取决于溶液的pH值[24],在中酸性果蔬汁中存在黄烊盐正离子、糖基化甲醇假碱、糖基化查耳酮、中性醌式碱4 种形式(图1),黄烊盐正离子和醌式碱通过分子内部的质子转移相互转化,黄烊盐正离子通过水合作用转化为糖基化甲醇假碱,糖基化甲醇假碱和糖基化查耳酮通过互变异构反应相互转化[25]。热降解途径是糖基化甲醇假碱通过脱糖开环反应生成查耳酮,查耳酮再裂解为酚酸和醛类物质[26]。酶降解途径是ACN在花色苷酶、多酚氧化酶、过氧化物酶和果胶酶的作用下发生的降解[27-28]。花色苷酶和果胶酶作用于ACN的糖苷键,使得ACN脱糖生成不稳定的花色苷元,花色苷元通过水合、开环、裂解等一系列反应降解为酚酸和醛类物质。多酚氧化酶和过氧化物酶几乎不直接作用于ACN,而是通过将其他酚类氧化为邻位醌类,邻位醌再将ACN氧化为ACN邻位醌、自身被还原为酚,邻位醌与ACN醌间或ACN醌相互间发生非酶促自发聚合、形成黑色素[29-31]。氧化降解途径[32]是臭氧或过氧化氢与ACN结合生成复合物,随后ACN的C环2和3位碳碳键发生裂解,最终降解为酚酸和醛类。糖降解途径[33]是糖经美拉德反应生成的糠醛类化合物通过亲电作用与ACN结合,导致ACN降解。光降解途径[4]可能是ACN先降解生成C环4位羟基的中间产物,而后生成查耳酮,快速降解成酚酸和醛类物质。宋会歌等[34]在此基础上提出了肠道微生物降解途径,即ACN在体内被肠道菌群代谢,其糖基首先被脱去,苷元在中性pH值条件下形成α-二酮后迅速降解生成酚酸和醛类。由以上几种降解途径可以发现,除多酚氧化酶和过氧化物酶降解途径生成了黑色素,其他降解途径最终降解产物均是酚酸和醛类物质。
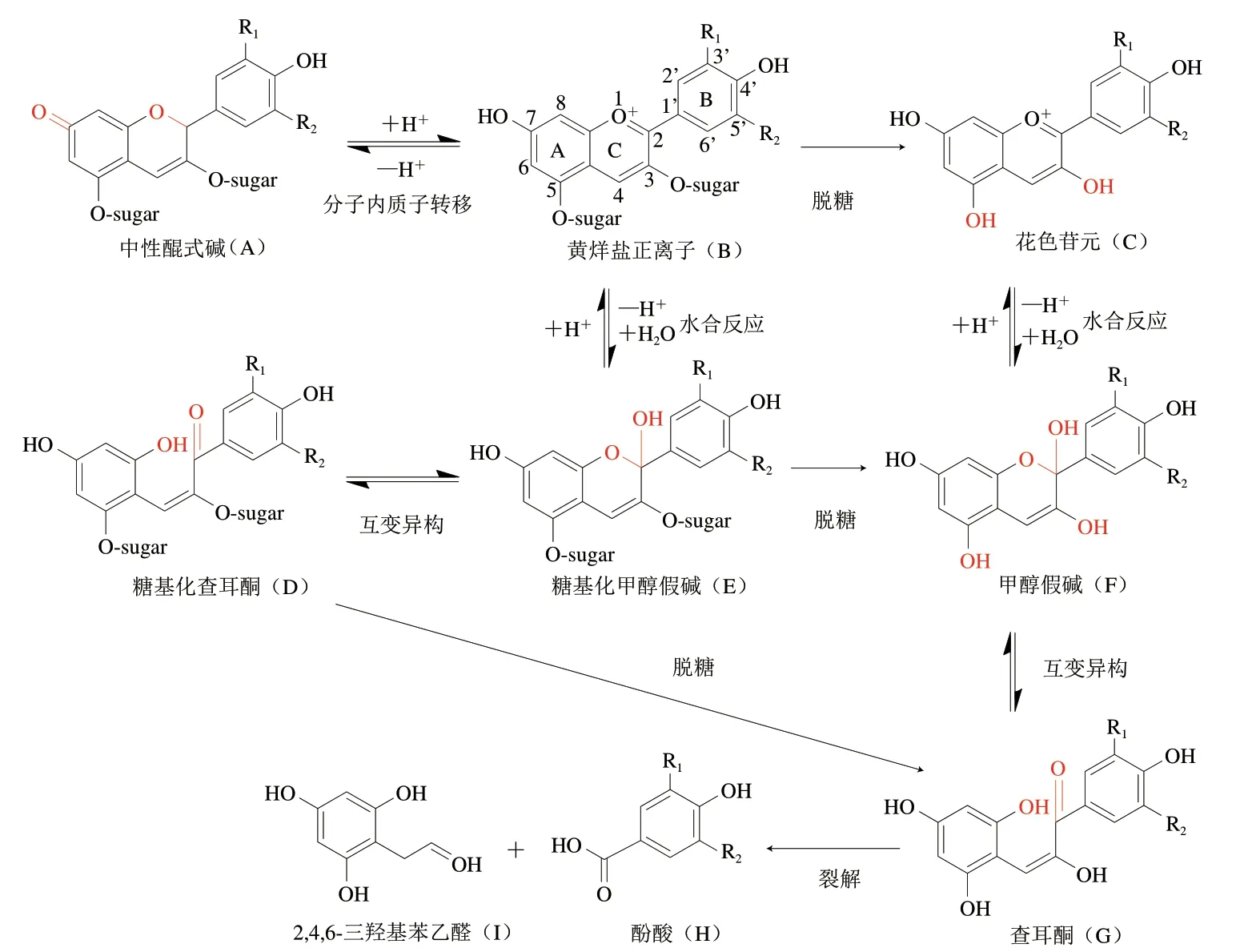
图1 ACN在酸性水溶液体系的结构与降解反应途径[24,35]Fig. 1 Structure and degradation pathway of anthocyanins under acidic aqueous condition[24,35]
2 VC降解机理
在果蔬汁体系中,VC存在还原型抗坏血酸(还原型VC)和氧化型脱氢抗坏血酸(氧化型VC)两种形态,这两种形态在不同品种的果蔬中所占的比例不相同。熊卫东等[36]测定了12 种常见水果中还原型和氧化型VC的含量,其中香蕉中还原型VC占比最低,为56.54%,大枣、桃、杏、李子中还原型VC占比最高,为100%。龙娇妍等[37]测定了11 种常见蔬菜中还原型和氧化型VC的含量,其中青椒的还原型VC占比最低,为58.29%,黄瓜的还原型VC占比最高,为93.03%。在果蔬汁贮藏过程中,还原型VC和氧化型VC之间存在可逆转化反应,处于抗坏血酸、单脱氢抗坏血酸、脱氢抗坏血酸的动态平衡,VC在分子氧存在的情况下通过失去电子和质子被可逆地氧化成单脱氢抗坏血酸和脱氢抗坏血酸(图2)[38-40]。脱氢抗坏血酸内酯环内3 个相邻羰基的存在增加了C1位亲核攻击的敏感性,使脱氢抗坏血酸内酯环极易开环,开环后将开启不可逆氧化降解,同时失去生物活性,脱氢抗坏血酸先被水解成2,3-二酮古洛糖酸,再进一步被氧化降解为草酸和L-苏阿糖酸[20,41]。
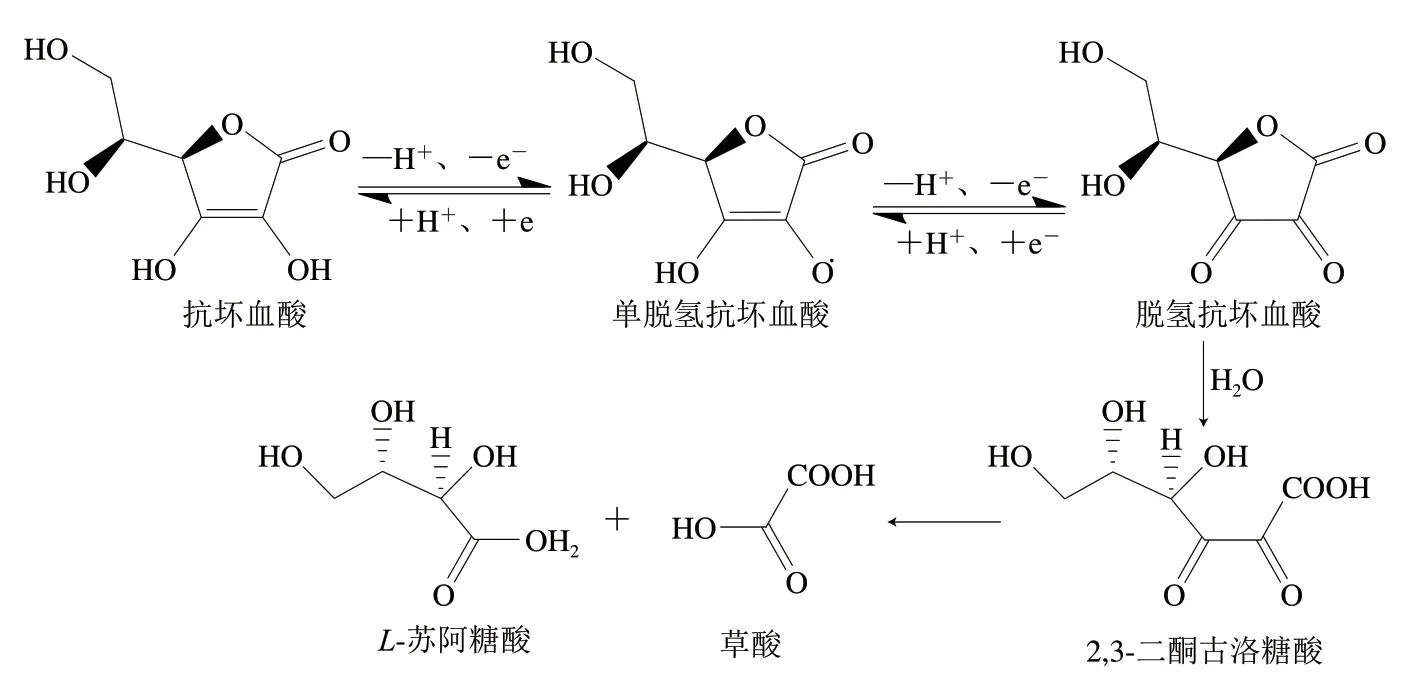
图2 VC的动态平衡及其降解反应[20,41]Fig. 2 Dynamic equilibrium and degradation pathway of VC[20,41]
3 ACN与VC相互作用机制假说
早在1943年,Beattie等[41]研究草莓汁、覆盆子汁和黑醋栗汁在贮藏过程中的理化特性变化时发现,有氧避光条件下,VC水平显著降低,同时伴随着产品颜色的变化,颜色变化速度与VC的降解速度大致相同,可能由于VC是可氧化的,而ACN是可还原的,两者可能会相互反应;该推论也通过VC或其异构体浓度增加会导致果汁变色率增加和VC损失率上升的实验得到了验证。
随后的一系列研究表明,ACN和VC共存时,两者的降解速度明显大于其单独存在时的降解速率,即存在协同降解现象[21-23]。例如,De Rosso等[21]在研究针叶樱桃VC提取物对巴西莓ACN提取物稳定性的影响时发现,在不排空顶隙空气的条件下,巴西莓中ACN的降解速率在添加VC提取物(质量浓度276 mg/mL)后增加了116 倍;即使经过顶隙氮吹处理,同样条件下,ACN的降解速率亦增加了109 倍,说明ACN和VC的相互作用是色素降解的主要驱动力,ACN本身的氧化降解相比ACN-VC互作对颜色损失的贡献相对有限。
为了解释ACN和VC的协同降解现象,学界提出了多种假说,目前被广泛接受的主流假说主要有两种:一是1952年由Sondheimer等[42]提出的“氧化假说”,即VC的氧化产物促进ACN降解;二是1972年由Jurd[43]提出的“缩合假说”,即VC直接与ACN发生缩合反应。
3.1 氧化假说
Sondheimer等[42]在研究过氧化氢降解草莓ACN的机制时发现,当ACN体系中的过氧化氢含量低时,ACN几乎不降解,但加入VC一段时间后,由于VC降解成脱氢抗坏血酸时伴随着过氧化氢的生成,当过氧化氢积累到一定量时,ACN才开始降解,由此提出VC是通过生成氧化产物过氧化氢,从而促进ACN的降解,即氧化假说。过氧化氢作为一种亲核试剂,可与ACN在C环2位碳处发生亲核反应(图3),该反应的产物不稳定,会进一步发生Baeyer-Villiger重排,这使得ACN的C2-C1’和C2-C3键暴露而容易断裂,从而形成一系列降解产物[44-45]。
另一方面,由于ACN抑制VC向单脱氢抗坏血酸和脱氢抗坏血酸的转变,并抑制过氧化氢的生成,自身被氧化成为ACN自由基,导致ACN的加速降解;同时VC参与抑制ACN自由基生成也引发了VC的加速降解[46-47]。
3.2 缩合假说
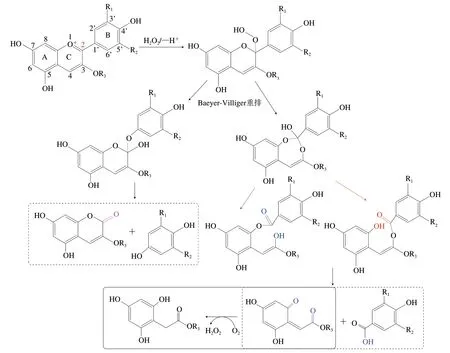
图3 过氧化氢降解ACN的推测机制[44-45]Fig. 3 Speculative mechanism of anthocyanin degradation by hydrogen peroxide[44-45]
ACN的C环4位碳易发生亲核加成反应,如亚硫酸盐是一种以硫原子为中心的亲核试剂,它可与ACN在C环4位碳处发生可逆反应,从而生成无色加合物(图4A)[4,44,48]。在红酒陈酿过程中,各种以碳原子为中心的亲核试剂也能够以类似的模式与ACN缩合,生成一种新的橙红色或砖红色色素——吡喃ACN,这种缩合反应也是红酒陈酿颜色变化的化学基础[49]。一般具有醛和酮的烯醇式结构物质都能够与ACN发生缩合反应,如与4-乙烯基酚(4-羟基苯乙烯)反应可生成苯酚基吡喃ACN(图4B)[50],与丙酮酸反应可生成vitisin A吡喃ACN(图4C)[51]。得益于吡喃环的特殊结构,ACN开环降解的C4位碳已被占据并形成相对稳定的环状结构,加上吡喃环的形成促进了ACN分子内部电子的均匀分布,一定程度地限制了ACN在C环2位碳上的亲核加成反应,因此吡喃ACN的颜色与其相应的ACN相比更稳定[44]。
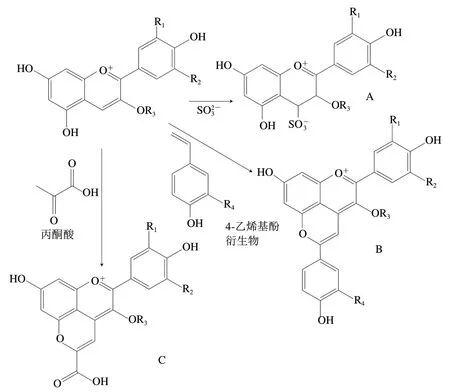
图4 ACN的C环4位碳亲核加成反应[48,50-51]Fig. 4 Nucleophilic addition at anthocyanin C4 position[48,50-51]
VC结构中也有类似的以碳原子为中心的烯二醇结构,也可能与ACN的C环4位碳发生亲核加成反应。参考上述理论,Jurd[43]在1972年提出“缩合假说”。虽然相应的加成产物鲜见报道,但一系列研究显示ACN和VC的协同降解与ACN C环4位的反应活性有关,García-Viguera等[52]将VC(质量浓度330 mg/L)加入到分别含有锦葵素-3-葡萄糖苷(质量浓度1.19 mg/L)(图5A)和锦葵素-3,5-二葡萄糖苷(质量浓度1.85 mg/L)(图5B)的pH 2.35柠檬酸盐缓冲液中,在20 ℃避光保存,利用高效液相色谱(high performance liquid chromatography,HPLC)法监测体系中ACN和VC的含量变化,发现锦葵素-3,5-二葡萄糖苷比锦葵素-3-葡萄糖苷降解更慢,且锦葵素-3,5-二葡萄糖苷体系中的VC也比锦葵素-3-葡萄糖苷体系中的降解更慢,由于锦葵素-3,5-二葡萄糖苷比锦葵素-3-葡萄糖苷两种ACN糖基化程度高,C环3、5位碳同时糖取代导致C环4位碳的空间位阻大幅增加,故García-Viguera等推测ACN和VC的协同降解作用与ACN的C环4位碳的反应活性有关。Levy等[53]将VC(质量浓度200 mg/L)加入到分别含有同浓度(0.1 mmol/L)矢车菊素(图5C)、矢车菊素-3-葡萄糖苷(图5D)和矢车菊素-3-芸香糖苷(图5E)的pH 6.5磷酸盐缓冲溶液和pH 4.5乙酸盐缓冲液中,在15、23 ℃和37 ℃下避光保存,监测146 h内体系中的ACN含量变化,结果显示,无论在3 种温度何种贮藏条件下,3 种ACN的稳定性均为矢车菊素<矢车菊素-3-葡萄糖苷<矢车菊素-3-芸香糖苷。对比三者的结构发现,由于3 种ACN的C环3位碳的取代基团大小差异,导致ACN C环4位碳的空间位阻由小到大依次为矢车菊素<矢车菊素-3-葡萄糖苷<矢车菊素-3-芸香糖苷,再次印证了ACN和VC的协同降解作用与和ACN的C环4位碳的反应活性有关,即ACN C环4位碳的反应活性越低,ACN与VC共存时的稳定性越高。
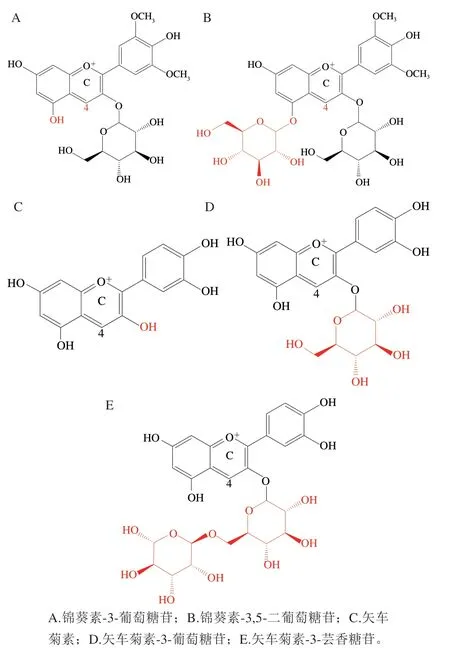
图5 不同程度C环4位碳反应活性的ACN结构式Fig. 5 Anthocyanin structures with different degrees of C4 carbon reactivity
4 ACN与VC相互作用的影响因素
综上所述,ACN和VC之间的确存在协同降解的相互作用。本文梳理归纳了文献报道中ACN结构、VC结构和浓度、氧气、温度、酚类、生物大分子对ACN和VC相互作用的影响。鉴于果蔬汁饮料的商业生产中,大多涉及灭酶灭菌处理以保证其货架期品质稳定性与安全性,故未对酶与微生物的影响展开详细论述。
4.1 ACN结构
ACN结构对其与VC的相互作用具有显著影响(表1)。ACN母核结构甲基化、糖基化、酰基化比例的提高,以及ACN C环的结构修饰均可一定程度缓解ACN与VC的相互作用[4,48]。
Gérard等[59]将黑胡萝卜、葡萄汁和紫薯的ACN提取物分别加入到含VC(质量浓度200 mg/L)模拟饮料体系中,并测定其在43 ℃避光条件下的保留率,有氧条件下,3 种ACN提取物的保留率依次为25%、47%和31%;无氧条件下,3 种ACN提取物的保留率依次为29%、50%、39%,结果表明,无论在有氧还是无氧环境下,葡萄汁ACN提取物在VC溶液中的保留率均最高,这归结于葡萄汁中主要的ACN结构,锦葵素的甲基化程度较黑胡萝卜中的矢车菊素、紫薯中的芍药素高。West等[23]研究葡萄渣中矢车菊素-3-葡萄糖苷和矮牵牛素-3-葡萄糖苷在6 ℃、pH 3避光条件下贮藏的稳定性时也得出相似结论。
Guldiken等[54]研究黑胡萝卜提取物中的矢车菊素-3-木糖葡萄糖半乳糖苷和矢车菊素-3-木糖半乳糖苷在室温、pH 3.5条件下的稳定性时发现,矢车菊素-3-木糖葡萄糖半乳糖苷和矢车菊素-3-木糖半乳糖苷的保留率分别约为47%和44%,说明ACN的糖基化程度提高可以一定程度限制ACN和VC间的相互作用。García-Viguera等[52]研究葡萄皮中的锦葵素-3-葡萄糖苷和锦葵素-3,5-二葡萄糖苷时也得出类似结论。
West等[23]将质量浓度0.5 mg/mL的VC添加到质量浓度1 mg/mL葡萄渣ACN提取物中,并测定葡萄渣ACN的保留率,当样品pH值为3、贮藏温度为25℃时,葡萄渣中的矮牵牛素-3-葡萄糖苷、飞燕草素-3-葡萄糖苷、飞燕草素3-(6’-乙酰)葡萄糖苷、飞燕草素3-(6’-香豆酰)葡萄糖苷的保留率依次为(6.2±1.8)%、(6.2±0.8)%、(5.7±1.2)%、(8.2±7.3)%,结果表明当母核结构相同时,糖基的芳香酸酰化有利于提高ACN在VC中的稳定性。
Farr等[58]将不同梯度质量浓度(0、250、500 mg/L和1 000 mg/L)的VC添加至矢车菊素-3-半乳糖苷单体和吡喃矢车菊素-3-半乳糖苷中,测定其在25 ℃避光保存时ACN在最大吸收波长处的吸光度并建立一级反应动力学模型,当VC质量浓度为250 mg/L时,两种ACN的半衰期分别为22 h和258 h,说明ACN C环的吡喃环结构修饰有利于减缓ACN和VC的相互作用,提高ACN的稳定性。Garcı́a-Viguera等[52]研究C环4位甲基取代和苯基取代的锦葵素-3-葡萄糖苷时也得出类似结论。
4.2 VC结构和浓度
在果蔬汁饮料体系中,VC处于氧化型和还原型两种形态的动态平衡中,两者可以相互转换[39]。Brenes等[60]在模拟果汁体系中研究了在添加质量浓度450 mg/L VC条件下红葡萄ACN和VC在25 ℃和35 ℃下的稳定性,15 d贮藏过程中氧化型VC的质量浓度先增大后减小,并在第5天达到峰值(约180 mg/L);期间还原型VC与氧化型VC的物质的量比由第0天的8∶1分别变化至第5天的1∶1和第10天的2∶1,到第15天时VC总量和还原型VC含量均为0。值得注意的是,ACN降解速率最大的0~2 d和10~15 d时段恰恰是氧化型VC生成速率最大的时段[60],说明VC结构对其与ACN相互作用有一定的影响,ACN更倾向于与还原型VC发生相互作用,生成氧化型VC。参考现行GB 5009.86—2016《食品安全国家标准 食品中抗坏血酸的测定》[61],氧化型VC含量需通过将其还原成还原型VC后由VC总量和原样中还原型VC含量的差值求得,推测直接测定或单独分离出稳定的氧化型VC可能存在一定技术难度或局限。在已报道的VC和ACN的相互作用研究中,大多数学者也更倾向于关注VC总量或还原型VC含量变化,对氧化型VC的含量变化关注相对有限,故本节重点归纳了VC的量效关系。
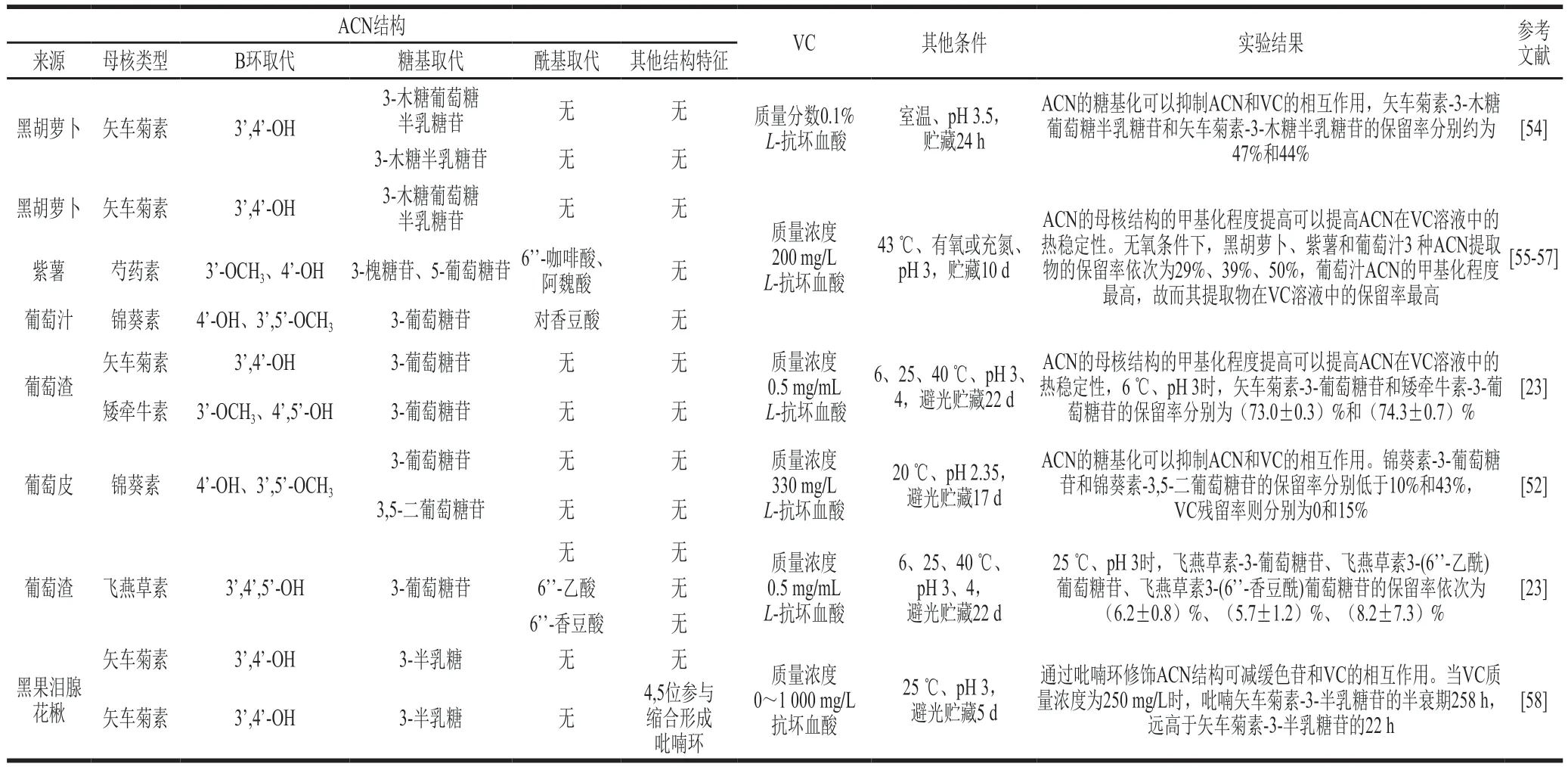
表1 ACN结构对果蔬饮料体系ACN和VC相互作用的影响Table 1 Effect of anthocyanin structure on the anthocyanin-vitamin C interaction in fruit and vegetable beverages
VC浓度的升高会加速果蔬汁体系里ACN的降解,即存在剂量相关性[56,62-63](表2)。
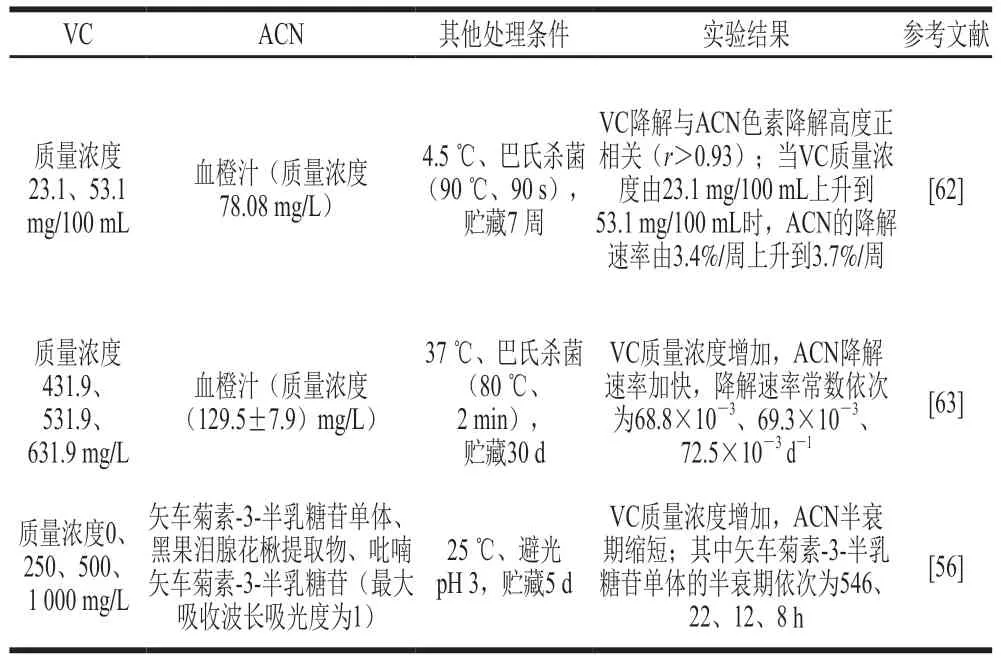
表2 VC质量浓度对果蔬饮料体系ACN和VC相互作用的影响Table 2 Effect of vitamin C concentration on the anthocyanin-vitamin C interaction in fruit and vegetable beverages
Choi等[62]将额外添加质量浓度30 mg/100 mL VC的血橙汁与未添加VC的血橙汁经巴氏杀菌后在4.5 ℃下保存,测定两组血橙汁中ACN和VC在贮藏过程中的变化,结果表明额外添加VC的血橙汁中ACN降解速率较未添加的快0.3%,VC降解速率则较未添加的慢7.9%,相关性分析结果显示VC降解与ACN降解高度正相关(r>0.93)。
Remini等[63]研究额外添加VC(质量浓度100、200 mg/L)的血橙汁在37 ℃条件下的贮藏稳定性,根据贮藏过程中ACN和VC浓度的变化建立一级动力学模型,在VC额外添加量为0、100、200 mg/L时,ACN的降解速率常数分别为68.8×10-3、69.3×10-3、72.5×10-3d-1,VC的降解速率常数分别为587.5×10-3、463.5×10-3、440.0×10-3d-1,推测VC浓度的升高可以增大ACN的降解速率。
Farr等[58]将不同梯度浓度(质量浓度0、250、500、1 000 mg/L)的VC添加至矢车菊素-3-半乳糖苷单体、黑果泪腺花楸提取物、吡喃矢车菊素-3-半乳糖苷中,测定其在25 ℃避光保存时ACN在最大吸收波长处的吸光度并建立一级反应动力学模型,以矢车菊素-3-半乳糖苷为例,不同VC质量浓度由低到高对应下的半衰期分别为546、22、12、8 h,即VC浓度越高,ACN半衰期越短,ACN-VC间存在剂量相关性。Nikkhah等[64]在几种浆果汁中加入了不同浓度的VC,研究其在避光冷藏条件下526 nm波长处吸光度的变化,结果表明VC的加入使吸光度明显减小。
4.3 氧气
ACN和VC单独存在时,氧气促进ACN和VC的降解;两者共存时,氧气可能通过促进VC降解而减缓ACN降解[21,63,65-66](表3)。
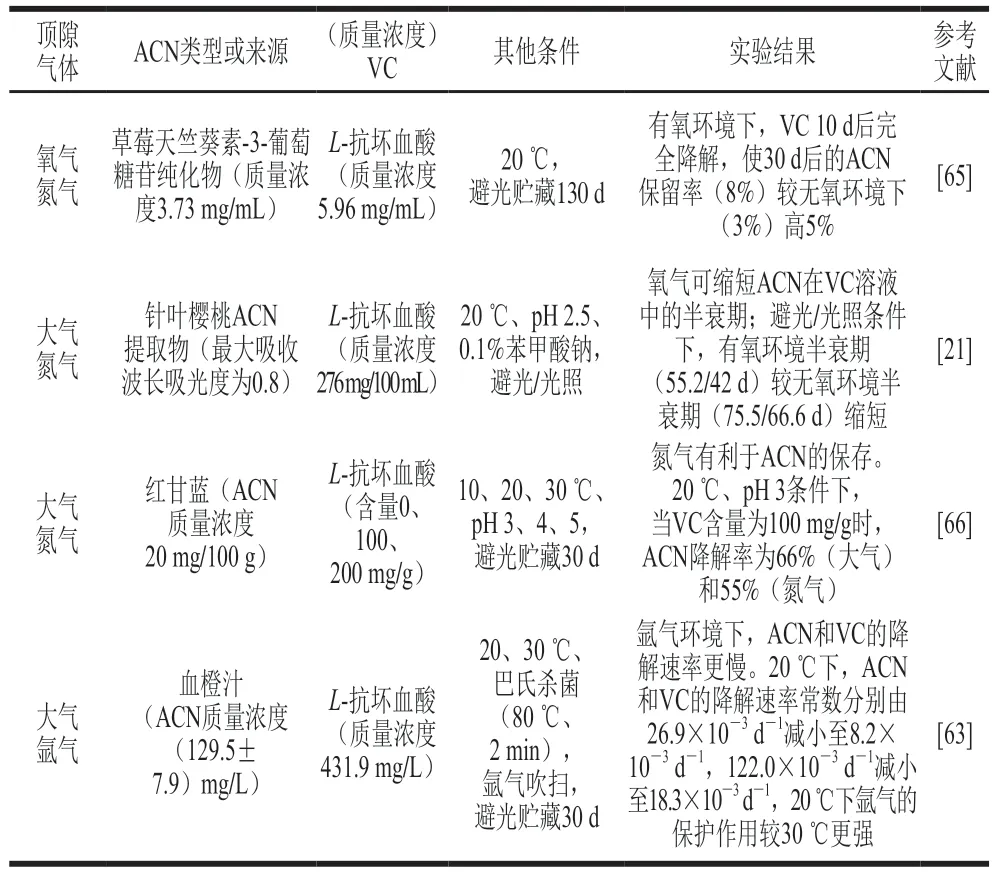
表3 顶隙气体对果蔬饮料体系ACN和VC相互作用的影响Table 3 Effect of headspace gas on the anthocyanin-vitamin C interaction in fruit and vegetable beverages
Poei-Langston等[65]研究草莓中提取的天竺葵素-3-葡萄糖苷和VC在20 ℃避光条件下共存时的稳定性,贮藏第30天时,ACN在有氧条件下的保留率较无氧条件下高5%;有氧环境下,VC在贮藏第10天几乎完全降解,而无氧环境下VC在第130天仍有少量残留,结果表明ACN和VC共存时,ACN在有氧环境下更稳定,VC在无氧环境下更稳定,Poei-Langston等推测这可能是因为有氧环境下VC保留率更低从而减缓了ACN降解。
Remini等[63]研究经氩气吹扫和未经氩气吹扫的巴氏杀菌血橙汁中ACN和VC的稳定性,20 ℃保存时,未经氩气处理的血橙汁中ACN和VC降解速率是经氩气处理的3.28 倍和6.67 倍,30 ℃保存时分别是1.67 倍和2.18 倍,表明氩气处理后血橙汁中氧气含量低,有利于ACN和VC的保留,且在较低温度下保护作用更显著。对针叶樱桃VC提取物和巴西莓ACN提取物稳定性的研究也发现经氮气处理样品的半衰期较大气组更长[21]。以上研究似乎与Poei-Langston等[65]的研究得出了完全相悖的结论,推测可能是因为Poei-Langston等[65]的研究中VC较ACN的相对含量低,贮藏前期被氧气消耗殆尽,所以氧气的存在反而提高了ACN的保留率;而Remini等[63]的研究中VC的相对含量较高,直到贮藏末期仍足以促进ACN降解,此时氧气和VC共同作用加速了ACN的降解。
4.4 温度
ACN和VC都是热敏性物质,温度的提高不仅会加速单一ACN或VC的降解,而且也会加速二者的相互作用(表4)。

表4 温度对果蔬饮料体系ACN和VC相互作用的影响Table 4 Effect of temperature on the anthocyanin-vitamin C interaction in fruit and vegetable beverages
曹雪丹等[67]将含有质量浓度50 mg/L VC的蓝莓清汁分别置于50、70 ℃和90 ℃水浴中保温5 h,测定ACN和VC含量,构建一级降解动力学模型,50、70、90 ℃下VC相对含量分别减少了10.57%、12.26%和59.19%,ACN相对含量分别减少了12.92%、34.05%和82.99%。ACN的降解速率常数k分别为0.026 3、0.086 4、0.360 4 h-1,表明温度越高,L-抗坏血酸和ACN的降解量越大,ACN的降解速率常数增大,即温度可以同时促进ACN和VC降解。Remini等[63]研究了额外添加质量浓度100 mg/L VC的血橙汁中ACN和VC在4、20、30、37 ℃贮藏过程中的一级降解动力学,ACN的降解速率常数分别为5、27.8、53.3、69.3 d-1,VC的降解速率常数分别为24.5、106.3、206.4、463.5 d-1,可以明显看出,ACN和VC的降解速率常数均随温度的升高而增大。黑米、紫薯、葡萄渣的ACN提取物和VC共存时,ACN和VC热稳定性也随着温度的升高而降低[23]。
随着食品加工技术的全面发展,新型非热加工技术逐步应用到果蔬汁的生产中[69-71]。典型非热加工技术对果蔬汁中ACN和VC的影响及其在贮藏过程中的变化也被陆续报道[72]。Torres等[22]研究了经超高压处理的血橙汁在4 ℃和20 ℃的ACN和VC贮藏稳定性,研究发现,经400 MPa/15 min的超高压处理后20 ℃贮藏条件下ACN和VC的降解速率分别是4 ℃的1.38 倍和26.26 倍,未经超高压处理的对照组20 ℃贮藏条件下ACN和VC的降解速率分别是4 ℃的2.72 倍和5.49 倍。由此可以得出,无论是否经过超高压处理,升高温度可以增大ACN和VC的降解速率。Tiwari等[68]研究了不同超声处理对草莓汁ACN和VC的贮藏稳定性,研究发现,经0.81 W/mL、10 min超声处理后,20 ℃贮藏条件下ACN和VC保留率分别比4 ℃条件下小13.49%、27.04%,未经超声处理的对照组,20 ℃贮藏条件下ACN和VC保留率分别比4 ℃条件下小7.57%、23.91%,结果显示,无论是否经过超声处理,超声处理的声能密度多大,ACN和VC在4 ℃下的稳定性均优于20 ℃下的稳定性;ACN和VC的保留率相关系数分别为0.905(4 ℃)和0.816(25 ℃),ACN和VC的保留率之间具有较强的相关性,即ACN和VC间存在协同降解作用。
4.5 其他物质
酚类和生物大分子对果蔬饮料体系ACN和VC相互作用的影响如表5所示。
4.5.1 酚类化合物
酚类化合物的添加可以作为辅色因子提高ACN稳定性,从而限制ACN和VC的相互作用。常用的辅色因子为多酚类化合物,例如绿原酸、芥子酸和单宁酸[78-79]等。这种保护作用是基于以π-π相互作用为主要驱动力的酚类与ACN芳香发色团的紧密分子缔合,形成ACN和酚类物质垂直或夹心型堆积;其本质包括但不限于氢键、范德华力、离子相互作用和疏水作用等[80-82]。
Poei-Langston等[65]在研究儿茶素(质量浓度8.94 mg/mL)对天竺葵素-3-葡萄糖苷(草莓中提取)和VC共存体系的稳定性时发现,有氧条件下,添加儿茶素组(处理组)ACN保留率比未添加儿茶素组(对照组)大,贮藏30 d后,处理组的ACN保留率比对照组高5%,与VC保留率则无显著差异,说明有氧环境下,儿茶素可一定程度上提高ACN稳定性,而对VC无影响;无氧条件下,处理组VC保留率比对照组小,在第18天左右有最大差异,处理组VC保留率比对照组小约30%;处理组ACN保留率比对照组大,但是差异不显著,说明在无氧环境下,儿茶素会促进VC降解,通过降低VC的浓度从而略微提高ACN稳定性。Tan Chen等[73]发现邻苯二酚、没食子酸、没食子酸乙酯和(-)-表没食子儿茶素没食子酸酯可以抑制VC对ACN的亲核攻击。Zhao Lei等[74]发现迷迭香酸可以抑制VC对黑米ACN提取物的降解。
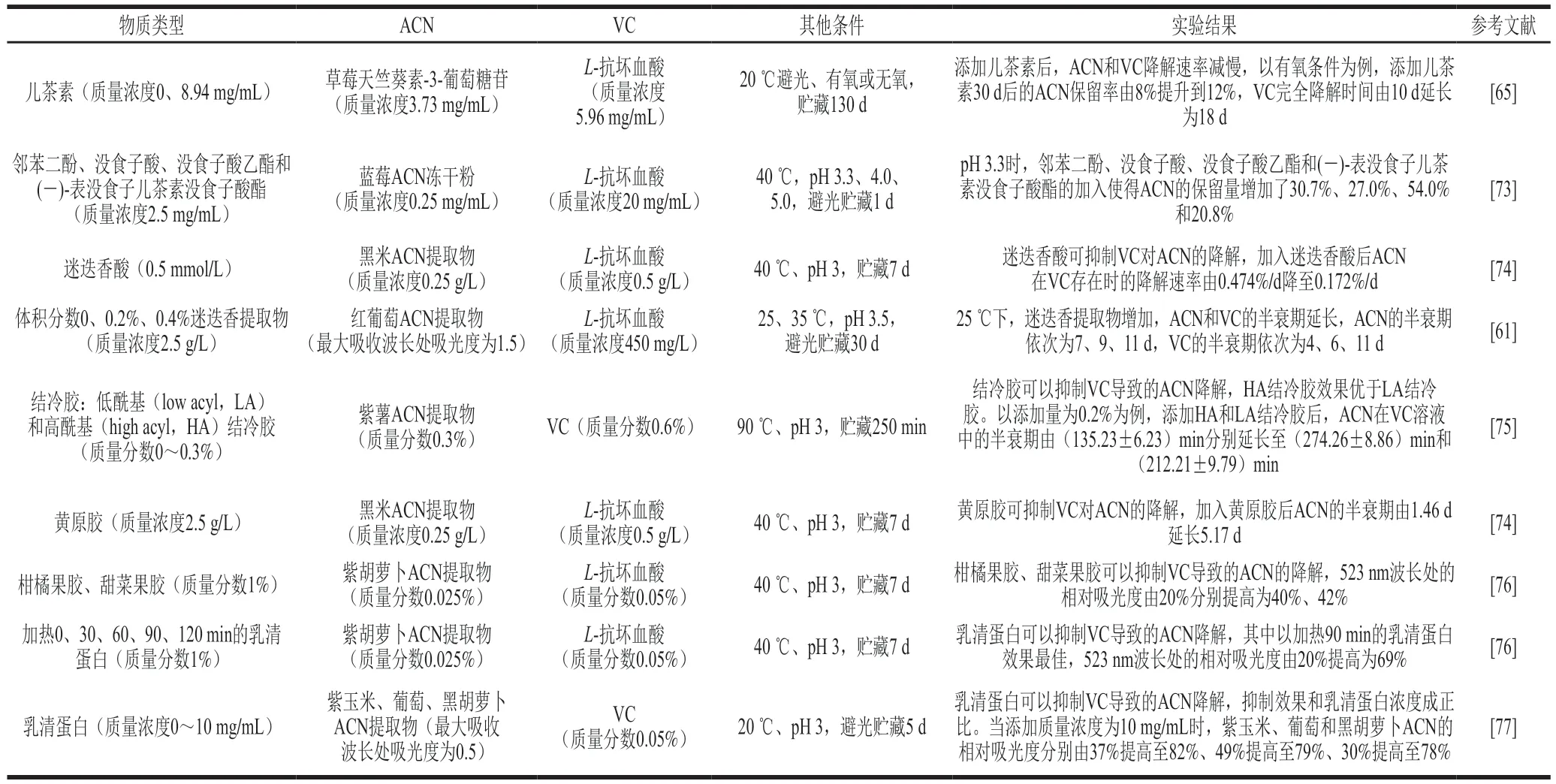
表5 酚类和生物大分子对果蔬饮料体系ACN和VC相互作用的影响Table 5 Effects of phenolics and biomacromolecules on the anthocyanin-vitamin C interaction in fruit and vegetable beverages
酚类在货架期中可以通过酶促和非酶反应被氧化降解成醌类物质或者深色聚合物,这些降解产物对ACN和VC的相互作用也会产生一定的影响。Jiang Yueming[83]研究荔枝多酚氧化酶对ACN的影响时发现当体系中不含酚类提取物时,荔枝多酚氧化酶和ACN的亲和力很低,ACN几乎不氧化降解;但当体系中加入酚类提取物时,ACN快速氧化降解并形成棕色色素,其中以邻苯三酚促进降解的能力最强,其次是儿茶酚和4-甲基儿茶酚。荔枝果皮中VC含量的降低与果皮褐变指数的增加有关,向反应混合物中添加VC可抑制多酚氧化酶导致的ACN降解。事实上,在更多的面向食品应用场景的研究中,把多酚酶促和非酶反应的动态变化简化成单一“多酚”因素来考虑其对互作的影响是最常见的研究思路。Brenes等[60]研究了迷迭香提取物对红葡萄ACN提取物与L-抗坏血酸共存体系贮藏稳定性的影响,以25 ℃为例,对于L-抗坏血酸而言,在第11天,添加0.2%和0.4%迷迭香提取物的样品中L-抗坏血酸质量浓度分别比未添加组多50 mg/L和130 mg/L。对于ACN而言,未添加VC的体系中,添加迷迭香提取物组与未添加组间无显著差异,在第30天ACN的质量浓度均降解为初始值的67%;添加了VC的体系中,在第11天观察到处理组与对照组的差异性,添加迷迭香酸组ACN降解速度小于未添加组,但是两个处理浓度间无显著差异。由此可推断,迷迭香提取物通过抑制L-抗坏血酸降解成脱氢抗坏血酸来抑制ACN和VC的降解。
4.5.2 生物大分子
在体系中添加某些生物大分子也可以提高ACN在VC体系中的稳定性,如黄原胶[74]、阿拉伯胶[84]、结冷胶[85]、果胶和乳清蛋白[76]等。Xu Xuejiao等[75]研究了LA和HA结冷胶对含有ACN的模拟饮料体系在VC存在下热稳定性(90 ℃)的不同影响,结冷胶的加入可以显著减轻热处理引起的褪色(P<0.05),在添加量为0.2%时效果最好,与未添加组相比添加LA和HA结冷胶体系的颜色保留率分别提高了33%和22%,表明结冷胶可提高ACN热稳定性,且添加量相同时,HA结冷胶的效果优于LA结冷胶。分子动力学模拟结果表明结冷胶与ACN存在相互作用,从而提高了ACN热稳定性,而HA结冷胶与ACN的相互作用强于LA结冷胶,这归因于酰基增加了空间位阻和柔韧性。Chung等[76]研究了柑橘果胶、甜菜果胶和乳清蛋白对含有ACN(质量分数0.025%)和VC(质量分数0或0.05%)模拟饮料稳定性的影响,40 ℃贮藏7 d后,与未添加物质组相比,加入柑橘果胶、甜菜果胶和分别加热0、30、60、90、120 min的乳清蛋白的样品,其在523 nm波长处的相对吸光度分别高20%、22%、25%、46%、45%、49%和44.5%,由此可见,加入柑橘果胶、甜菜果胶、乳清蛋白可以抑制VC导致ACN降解,乳清蛋白效果均优于柑橘果胶和甜菜果胶,以加热90 min的乳清蛋白效果最佳。
5 ACN与VC互作研究方法
基于ACN和VC本身的物理化学特点,多数研究者选择色差仪测色、紫外-可见吸收光谱或HPLC定性定量、计算活化能等方法对二者的呈色特性、结构、含量和反应活性进行研究,进而推演相互作用机制;也可以利用其他途径赋予ACN和VC新的结构特点,结合荧光特性、电位、自由基强度等手段利用新增特性进行研究。
5.1 色差仪分析法
ACN作为一种天然色素,因微环境改变引起ACN微结构的改变会使果蔬汁体系颜色特性发生一定程度的变化,故可使用色差仪测定体系中颜色参数的变化情况,评价ACN的品质。目前常用的颜色参数评价系统主要包括CIELab颜色系统和孟塞尔颜色系统。CIELab颜色系统相关颜色参数包括亮度L*值(0(黑色)~100(白色))、红绿度a*值(红色为正,绿色为负)和黄蓝度b*值(黄色为正,蓝色为负),而孟塞尔颜色系统相关的颜色参数包括亮度L*值、色度C(颜色饱和度)、色调角h(由波长决定的色觉颜色),h可以通过a*值和b*值来进行计算,即h=arctanb*/a*。另外还采用ΔE=[(ΔL*)2+(Δa*)2+(Δb*)2]1/2来计算颜色的整体差异[48,86]。
Choi等[62]采用CIELab颜色系统测定了含有不同含量VC的巴氏杀菌血橙汁在4.5 ℃下贮藏7 d后的颜色变化,贮藏过程中血橙汁的a*值逐渐减小,L*值和b*值逐渐增加,说明随着ACN的降解,样品体系会朝着橙色方向改变。Stebbins等[87]采用孟塞尔颜色系统分别测定了矢车菊素-3-葡萄糖单体和黑莓ACN提取物含有或不含有VC的情况下,于室温避光贮藏72 h的变化,结果显示,VC对矢车菊素-3-葡萄糖苷体系的色调角度(h)从20.3增加到29.7,表明体系在监测过程中由黄色调逐渐突出,整体颜色由红色逐渐转变为橙色,而亮度(L*)和色度(C)值的影响较小;额外添VC对黑莓ACN提取物体系的亮度(L*)、色度(C)和色调角(h)没有显著影响。
5.2 紫外-可见吸收光谱法
ACN和VC在紫外-可见光谱范围内有特征吸收峰,采用紫外-可见吸收光谱法监测ACN和VC相互作用体系中的变化。
在典型果蔬汁体系的酸性条件下,ACN由于带正电荷且存在8 个共轭双键的长生色团,故会强烈着色,可见光范围内的最大吸收波长通常在465~550 nm之间;另一个最大吸收波段在紫外光范围内270~280 nm之间[3]。另外,pH值的变化会导致ACN发生可逆的结构转变,从而呈现出明显不同的吸收光谱,基于该现象,分别测定不同pH值缓冲体系下的ACN溶液在最大吸收波长处和700 nm波长处的吸光度,进而计算出总ACN单体含量,即pH示差法[59]。该方法即使在存在聚合降解色素和其他干扰化合物的情况下,也可以准确快速测定总ACN单体含量[88]。
ACN降解可以通过聚合度指数来判断。聚合的有色ACN-单宁配合物可抵抗亚硫酸盐的漂白,而单体ACN的漂白反应会迅速完成。于样品液最大吸收波长处、420 nm波长处和700 nm波长处分别测定样品液与经亚硫酸盐处理样品液吸光度,可以计算样品的颜色密度和亚硫酸盐处理样品液的聚合色。聚合色和颜色密度之间的比率用于确定聚合颜色百分比,可用于确定降解指数[88]。
VC含量也可以通过紫外吸收光谱法进行测定。VC具有共轭结构,在紫外区(200~300 nm)有吸收,碱处理后VC极易降解,紫外吸收消失,故通过测定样品液与碱处理样品液在最大吸收波长处吸光度之差,再对照标准曲线,可计算样品中VC含量[89]。
5.3 HPLC法
HPLC法已成为ACN和VC定性定量分析最常用的研究手段[90-92],通过标准品与HPLC信号(峰高、峰面积等)的关系来绘制标准曲线,然后将样品该信号与标准曲线信号进行比较,获得样品相应物质的量。利用HPLC法可以解析ACN和VC间的相互作用对两者数量变化的影响。Martí等[93]利用HPLC法分别测定VC强化(质量浓度330 mg/L)和未强化石榴汁5 ℃避光贮藏过程中ACN和VC含量变化,发现150 d后VC强化石榴汁中的ACN相对含量较未强化石榴汁多降解了17%,验证了添加VC促进果蔬汁体系中ACN降解的结论。
HPLC也可以结合质谱仪来推断ACN的具体结构变化,分析ACN和VC之间可能存在的反应[35]。
5.4 电子自旋共振法
根据ACN和VC的氧化降解假说,ACN和VC共存时,可能会产生自由基,可以使用电子自旋共振法监测自由基的生成。
Stebbins等[87]以α-(4-吡啶基-1-氧)-N-叔丁基硝基酮(α-(4-pyridyl-1-oxide)-N-tert-butylnitrone,POBN)为自旋捕捉剂,用电子自旋共振法分别测定黑莓ACN提取物和矢车菊素-3-葡萄糖苷单体在含有(或不含有)VC贮存过程中响应信号的强弱,电子自旋共振能检测到二甲基亚砜与羟自由基反应生成自旋加合物和甲基自由基,结果显示,添加了VC的样品相较于未添加VC的样品的信号强,说明VC的加入可以促进体系自由基的形成;而黑莓提取物的响应值相比于ACN单体的响应值小,推测是黑莓ACN提取物中的多酚可以清除自由基。
Gérard等[59]以2,2,6,6-四甲基哌啶氧化物(2,2,6,6-tetramethyl-1-piperidinyloxy,TEMPO)(一种自由基清除剂)为自旋捕捉剂,在空气或氮气环境中,用电子自旋共振法分别测定黑胡萝卜、葡萄和紫薯的ACN提取物与VC混合后的样品体系随着光照时间延长的响应信号强弱的变化情况,结果显示,随着光照时间的延长,信号逐渐减弱,说明ACN和VC产生了自由基,且大部分的自由基是由于光照产生的;此外,通过对比信号减弱的速率,紫薯ACN提取物的信号减弱最慢,黑胡萝卜ACN提取物次之,葡萄ACN提取物最快,说明紫薯ACN提取物在光照条件下的稳定性最高。
5.5 其他方法
采用循环伏安法[66]测定ACN和VC共存体系中的ACN的还原能力和VC的氧化能力,预测两者间发生氧化还原反应的可能性。ACN在短波长区域具有荧光特性[94-95],采用荧光光谱法确定VC是否可以抑制ACN荧光强度,从而判断VC是否会促进ACN的荧光猝灭导致ACN降解。分子建模法[72]模拟ACN和VC分子结构特性,从而达到检测两者之间反应的目的。核磁共振技术[92]通过鉴定ACN及其与VC共存时产生的新物质,从而推断可能的降解机制。
6 结 语
由于果蔬饮料中ACN和VC间存在协同降解作用,导致果蔬饮料营养品质在加工和货架期过程的大幅损失。因此,明确ACN和VC间的相互作用机制,从根本上找到抑制ACN和VC协同降解的方法,对提升果蔬饮料的整体品质至关重要。
就目前研究成果来看,虽然VC的氧化产物促进ACN降解的“氧化假说”和VC直接与ACN发生缩合反应的“缩合假说”都从不同程度地得到了实验的验证,但是准确的ACN和VC相互作用机制尚没有统一定论,这主要是因为二者相互作用同时受到自身化学结构和外部环境等多方面因素的综合影响,而食品体系的复杂性又进一步增加了解析该反应的难度。大部分研究主要聚焦各因素对ACN或者VC分别产生的影响,直接关注各因素对ACN和VC之间的相互作用影响的研究相对有限;研究手段主要基于ACN或者VC本身的理化特性,直接解析ACN和VC的相互作用的分析方法尚待开发探索,故多数研究通过融会贯通多种实验现象的方法对两者的相互作用机制进行推理。随着科学技术的不断发展,对ACN和VC的相互作用的研究手段将更加直接,且对二者相互作用的认知将更加深入,这些新的突破将为食品体系中ACN与VC的更高效利用提供理论指导和技术支持。

