超声造影肝脏影像报告与数据系统对甲胎蛋白阴性患者肝脏局灶性病变恶性风险的预测价值
郑丽丽 冯梅晶 李军建 詹维伟 任新平
原发性肝癌在全球的发病率和死亡率分别居恶性肿瘤的第6位和第3位,其中80%~90%为肝细胞癌(hepatocellular carcinoma,HCC)[1]。甲胎蛋白(alphafetoprotein,AFP)与超声及其他影像学联合是临床筛查和诊断HCC的重要手段,但约1/3的HCC患者AFP呈阴性,为临床诊断带来了一定的困难[2-4]。超声造影(contrast-enhanced ultrasound,CEUS)可动态显示肿瘤的微循环灌注信息,现已成为HCC的一线影像学诊断工具[5-6]。美国放射学会发布了肝脏影像报告与数据系统(liver imaging reporting and date system,LI-RADS)用于规范操作、统一术语、促进影像报告标准化、减少图像解读误差,并对肝脏局灶性病变(focal liver lesion,FLL)进行HCC风险分层,同时引入了LR-M以区分HCC与非HCC恶性肿瘤(other hepatic malignancies,OM)。研究[7-8]证实CEUS LI-RADS对FLL有较好的诊断价值。本研究旨在探讨CEUS LI-RADS 2017版(v2017)对AFP阴性患者FLL恶性风险的预测价值。
资料与方法
一、研究对象
选取2018年1月至2021年10月在我院行CEUS检查的FLL患者108例,男74例,女34例,年龄21~83岁,平均(57.55±11.47)岁。多发18例,单发90例,共134个病灶,最大径0.5~11.5 cm,平均(2.93±1.89)cm。其中HCC 52个,OM 22个(肝内胆管细胞癌10个、转移癌8个、原发性神经内分泌肿瘤2个、肉瘤样癌和胆管腺鳞癌各1个),良性病灶60个。纳入标准:①所有患者均经组织病理检查或增强影像学检查和临床随访(≥6个月)证实;②均具有HCC高危因素,如肝硬化、慢性病毒性肝炎、HCC病史或HCC家族史、肝移植术史;③二维超声可清晰显示肝内病灶;④血清AFP阴性(化学发光法检测AFP≤8.78 ng/ml),且与CEUS检查时间间隔不超过2周。排除标准:①无HCC高危因素;②年龄<18岁、先天性或血管性因素所致肝硬化;③CEUS图像质量不佳或不完整;④肝内弥漫性再生结节;⑤接受过介入性或系统性治疗。本研究经我院医学伦理委员会批准(批准号:RJ 2017-72),所有患者均签署知情同意书。
二、仪器与方法
1.CEUS检查:使用迈瑞Resona 7、Resona 8或百胜MyLab Twice彩色多普勒超声诊断仪,SC5-1U、L9-3U或CA541探头,频率分别为1~5 MHz、3~9 MHz或1~8 MHz,采用低机械指数(0.04~0.12)对比增强模式;造影剂使用SonoVue(每支含六氟化硫气体冻干粉59 mg,意大利Bracco公司),使用前注入5.0 ml生理盐水振荡混匀配置成混悬液。患者取仰卧位或左侧卧位,常规超声记录肝内结节数目、位置、大小、回声、边界及血流分布情况,选取结节最大径切面,嘱患者平静呼吸,开启CEUS双幅模式,经肘外周浅静脉快速团注1.5 ml造影剂后尾随5.0 ml生理盐水冲管,从造影剂注射完毕开始计时,存储前60 s内动态影像,之后每隔30 s存储一张静态图像,观察时间6~8 min。观察指标包括:①动脉相高增强(arterial phase hyperenhancement,APHE),即部分或整体高增强而非边缘环状增强或周边不连续结节样增强等;②早期廓清,即<60 s开始廓清;③延迟廓清,即≥60 s开始廓清;④显著廓清,即≤120 s内呈“黑洞”样表现;⑤轻度廓清,即病灶呈低增强但不呈“黑洞”样表现或>120 s呈“黑洞”样表现。所有CEUS图像均由两名具有10年以上相关工作经验的超声医师采用盲法独立分析,并按照CEUS LI-RADS v2017[9]进行分类,意见不一致时协商解决。
2.CEUS LI-RADS v2017分 类 标 准[9]:①LR-1(100%良性),始终未见增强的无回声结节或动脉相呈周边结节样增强、缓慢向内完全或部分填充、门脉相及延迟相无廓清,以及各时相均为等增强的位于胆囊窝周围或肝S6段门静脉右支前方的无立体感或球体感的片状高/低回声区;②LR-2(良性可能性大),肝内最大径<10 mm的等增强实质结节或任意大小始终表现为等增强的非结节样病灶,以及随访超过2年大小稳定不变的原LR-3结节;③LR-3(HCC中度可疑),结节最大径<10 mm有APHE无廓清,或结节最大径<20 mm无APHE无廓清或有延迟/轻度廓清,或结节最大径≥20 mm无APHE无廓清;④LR-4(HCC可能性大),结节最大径<10 mm有APHE和延迟/轻度廓清,或结节最大径≥10 mm有APHE无廓清,或结节最大径≥20 mm无APHE有延迟/轻度廓清;⑤LR-5(明确HCC),结节最大径≥10 mm有APHE和延迟/轻度廓清;⑥LR-M(可能或明确为恶性,但不一定是HCC),任意大小结节存在动脉相环状增强或早期/显著廓清。
三、统计学处理
应用SPSS 23.0统计软件,计数资料以频数或率表示,组间比较采用χ2检验。以组织病理学结果或增强影像学检查和临床随访结果为金标准,分别计算CEUS LI-RADS v2017对AFP阴 性 患 者HCC和OM的诊断敏感性、特异性、阳性预测值、阴性预测值和准确率。应用MedCalc软件绘制受试者工作特征曲线,分析其曲线下面积(area under the curve,AUC),AUC比较采用Delong检验。P<0.05为差异有统计学意义。
结 果
一、AFP阴性FLL患者CEUS表现
HCC以APHE(92.31%)和延迟/轻度廓清(82.69%)为主。OM中50.00%呈APHE,45.45%呈环状增强,100%出现造影剂廓清,其中45.45%呈早期/显著廓清,54.55%呈延迟/轻度廓清。良性病灶以动脉相等增强(43.33%)和延迟相无廓清(76.67%)为主。见表1和图1~3。

表1 AFP阴性FLL患者CEUS表现 个
二、AFP阴性FLL患者CEUS LI-RADS v2017分类情况
CEUS LR-1、2病灶各14个、6个,均为良性,包括12个血管瘤、4个肝硬化相关增生结节和4个其他良性病灶;LR-3病灶31个,包括4个HCC和27个良 性病灶(22个肝硬化相关增生结节、3个局灶性结节性增生、1个血管瘤和1个炎性病灶);LR-4病灶17个,包括8个HCC、1个OM和8个良性病灶(3个局灶性结节性增生、3个肝硬化相关增生结节和2个血管瘤);LR-5病灶43个,包括38个HCC、1个OM和4个良性病灶(3个炎性病灶和1个局灶性结节性增生);LR-M病灶23个,包括2个HCC、20个OM和1个胆管细胞不典型增生。见图1~3。
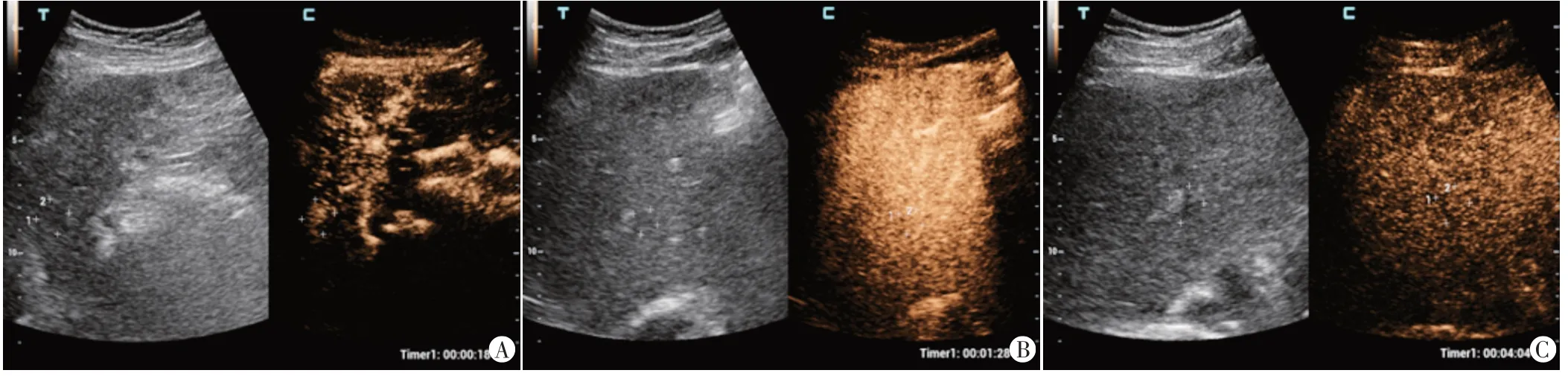
图1 HCC CEUS图(CEUS LR-4)
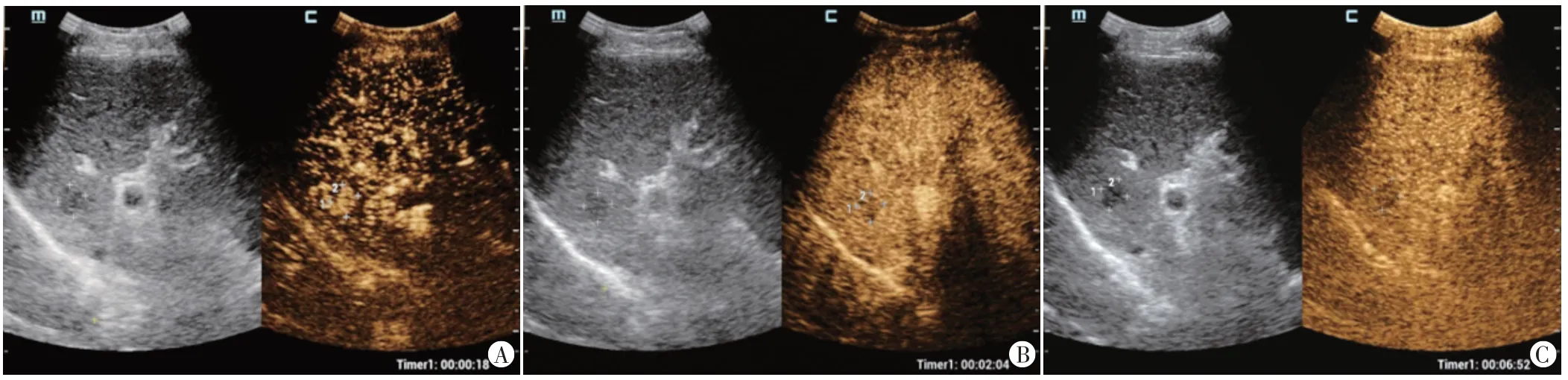
图2 HCC CEUS图(CEUS LR-5)
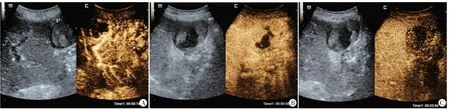
图3 肝脏原发性神经内分泌肿瘤CEUS图(CEUS LR-M)
三、CEUS LI-RADS v2017对AFP阴性患者HCC及OM的诊断价值
1.LR-5与LR-4、5诊断AFP阴性HCC的敏感性、特异性比较差异均有统计学意义(均P<0.05);阳性预测值、准确率及AUC比较差异均无统计学意义。见表2~4。
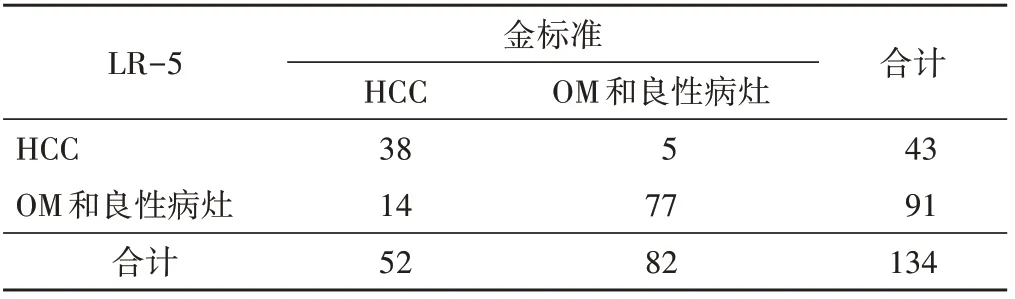
表2 CEUS LI-RADS v2017以LR-5为标准诊断AFP阴性HCC结果 个
2.LR-M对AFP阴性OM的诊断敏感性、特异性、阳性预测值、阴性预测值和准确率分别为90.91%、97.32%、86.96%、98.20%和96.27%,AUC为0.94。见表5。
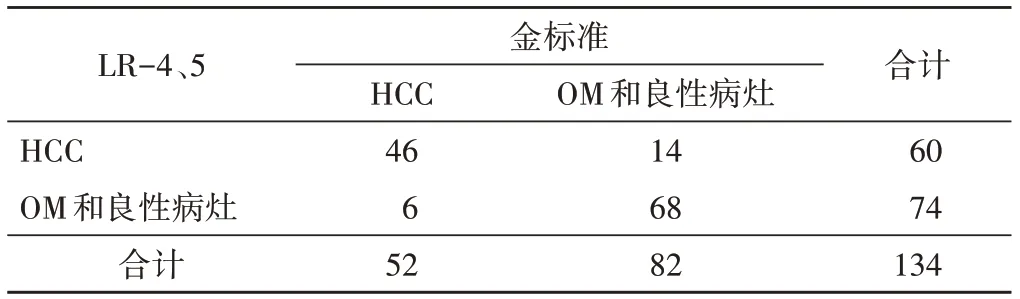
表3 CEUS LI-RADS v2017以LR-4、5为标准诊断AFP阴性HCC结果 个
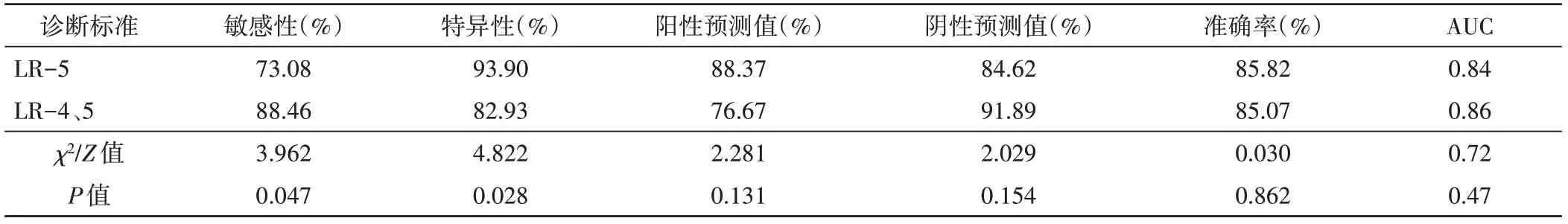
表4 CEUS LI-RADS v2017两种标准诊断AFP阴性HCC的效能比较
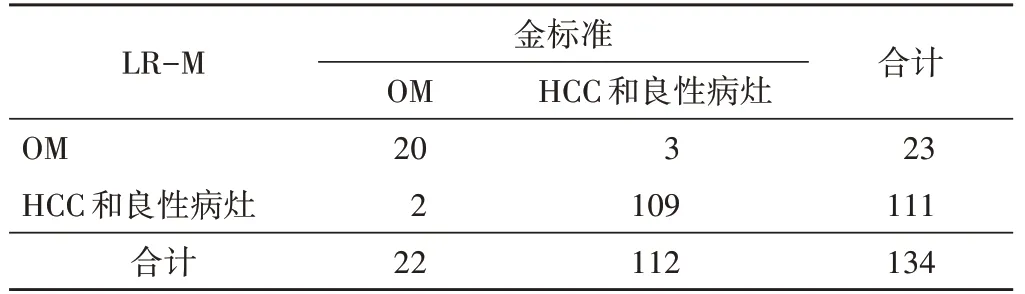
表5 CEUS LI-RADS v2017以LR-M为标准诊断AFP阴性OM结果 个
讨 论
HCC与OM具有不同的治疗方案及临床预后,因此,准确区分二者有助于临床治疗策略的制定和改善患者预后。本研究结果显示CEUS LI-RADS v2017对AFP阴性HCC高危患者FLL恶性风险的评估具有一定的应用价值。
LI-RADS分类中LR-1~5 FLL的HCC风险逐渐升高。本团队早期研究[10]结果显示,在HCC高危人群中,CEUS LR-5对HCC的诊断敏感性、特异性、阳性预测值分别为77.57%、92.22%、92.22%。本研究结果显示CEUS LR-5诊断AFP阴性HCC的特异性、阳性预测值分别为93.90%、88.37%,但敏感性较低(73.08%),与Wang等[11]应用CEUS LI-RADS对AFP阴性HCC的诊断效能相似;这与CEUS LR-5为保证对HCC的高特异性和阳性预测值而牺牲敏感性的设计目的一致。CEUS LR-5诊断HCC的AUC为0.84,与一项Meta分析[12]结果相似。但以LR-5为诊断标准可导致26.92%(14/52)的AFP阴性HCC被漏诊,若以LR-4、5为诊断标准,该值可降至11.54%(6/52),与既往研究[13]结果相似。说明LR-4、5的诊断标准可以弥补30%~40%的HCC患者因AFP阴性导致漏诊率较高的不足。既往研究[14-15]发现AFP阴性HCC的CEUS表现以APHE伴延迟/轻度廓清为主,本研究亦得到相同结果。但本研究3个HCC虽表现为APHE伴延迟/轻度廓清,由于最大径<10 mm,被归为LR-4,而其他LR-4良性病灶均无此表现,因此,虽然结节最大径<10 mm时其HCC可能性很小,但当出现APHE伴延迟/轻度廓清时,仍应提高警惕[16];同时,有3个炎性病灶被归为LR-5,既往研究[17]认为肝脏局灶性炎性病灶的CEUS表现多种多样,且缺乏特异性,多与恶性病灶的CEUS表现存在交叉重叠,需结合病史以提高诊断准确率。
LR-M的提出是为了区分肝脏其他原发恶性肿瘤及转移癌与HCC。本团队早期研究[10]结果显示,在HCC高危人群中,LR-M诊断OM的敏感性为73.68%,但本研究结果显示LR-M对AFP阴性OM的诊断敏感性为90.91%,分析原因可能与纳入OM的样本量不同有关。既往未区分AFP阳/阴性的研究[12,18]表明,LRM诊断OM的敏感性为85%~91%,而在Wang等[11]研究中,LR-M鉴别AFP阴性HCC与肝脏其他原发恶性肿瘤的敏感性达92.1%,与本研究结果相似。本研究OM中以肝内胆管细胞癌占比最高(45.45%,10/22),肝内胆管细胞癌是第二常见的肝内原发恶性肿瘤,与HCC有相似的危险因素,CEUS曾被肝癌相关指南移除的原因正是由于存在将肝内胆管细胞癌误诊为HCC的风险[16]。本研究10个肝内胆管细胞癌中,5个呈整体增强,5个呈环状增强,但均呈早期/显著廓清,均被归为LR-M。说明LR-M可以有效区分肝内胆管细胞癌与HCC。但仍有2个HCC因早期廓清被归为LR-M,可能与其分化较差有关。8个转移癌中,7个被归为LR-M,仅1个肠癌肝转移被归为LR-5。既往研究[19-20]发现肠癌肝转移病灶动脉相可呈环状增强、整体不均匀或均匀增强等多种表现,廓清时间19~270 s,与HCC的CEUS表现有一定的重叠。本研究中1个胆管腺鳞癌最大径为6.2 cm,CEUS表现为结节状及条索状等增强伴轻度廓清,内有大片状无增强区,符合LR-4,病理结果提示病灶内伴较多坏死。对于此类体积较大伴较多坏死的结节,恶性可能性较大,但目前的CEUS LI-RADS v2017尚未关注此类结节,未来仍需继续修订、完善。
综 上所 述,CEUS LR-5诊断AFP阴 性HCC的特异性、阳性预测值较高而敏感性低,LR-4、5可提高其敏感性;LR-M对AFP阴性OM有较好的诊断价值。但本研究样本量较小,今后有待扩大样本量继续研究验证。

