抗癌防移片对结直肠癌肝转移BALB/c 小鼠P65、STAT3、TNF-α 因子的影响
郭忠聪,杨宇婷,王智贤,龚 纯*
(1.湖南中医药大学第一附属医院肿瘤科,湖南 长沙 410007;2.湖南中医药大学研究生院,湖南 长沙 410208)
结直肠癌(colorectal cancer)指发生在结肠及直肠部位的恶性肿瘤,是全球第三大恶性肿瘤,其严重威胁着人类生命健康。 饮食结构改变、肥胖、吸烟等均是导致结直肠癌发生的不利因素[1]。 近年来,随着生活方式及饮食结构的改变,我国结直肠癌发病率急剧上升[2]。 目前,结直肠癌的治疗方法以手术切除为主,但术后总的5 年生存率只有50%左右[3]。 多数导致结直肠癌患者的死亡原因主要是由结直肠癌肝转移引起,随着肿瘤病情的进展,在50%的结直肠癌患者中都会发生肝转移,发生肝转移的结直肠癌患者中位生存期仅为6~12 个月。因此,研究结直肠癌肝转移发生、发展的机制及有效防治方法意义深远[4-5]。
中医药防治疾病重视整体观念,由多味中药配伍而成的中药复方可通过多个环节起效,可在改善肿瘤患者的临床证候、提高放化疗敏感性、降低放化疗不良反应、调节机体免疫力、降低复发转移率等方面发挥重要作用。 近年来湖南中医药大学第一附属医院肿瘤科在临床实践中运用抗癌防移片防治常见恶性肿瘤的复发转移,收到了满意的临床疗效。前期临床研究显示,抗癌防移片联合化疗不仅可提高结直肠癌肝转移患者的疾病缓解率,还可降低Ⅲ期结肠癌术后患者的复发转移率[6-10]。 前期实验显示,抗癌防移片可降低结直肠癌模型小鼠肝转移发生率,通过抑制血清肝细胞生长因子(hepatocyte growth factor, HGF)、血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达,抑制血管新生,从而抑制结直肠癌肝转移[11]。本研究拟在前期证实抗癌防移片可降低结肠癌肝转移率的基础上,以结直肠癌肝转移裸鼠模型为对象,围绕炎性微环境相关因子,以癌基因蛋白质p65、信号传导转录激活因子3(signal transduction and activator of transcription 3,STAT3)、肿 瘤 坏 死 因 子(tumor necrosis factor-α,TNF-α)为切入点,研究抗癌防移片抗结直肠癌肝转移的可能机制,为中医药防治结直肠癌肝转移提供更多的科学依据。
1 材料
1.1 实验动物
选择SPF 级别的BALB/c 小鼠共40 只,体质量18~22 g,6~8 周龄。 购自湖南斯莱克景达实验动物有限公司。 动物许可证号:SCXK(湘)2016-0002;实验单位使用许可证号:SYXK(湘)2015-0003。 饲养环境:温湿度适宜、人工12 h 昼/夜循环照明的SPF级动物房。 动物实验伦理批号:ZYFY20190920。
1.2 药物组成
抗癌防移片系三湘名医经验方(由红参、半枝莲、黄芪、薏苡仁、姜黄、女贞子、墨旱莲、莪术、九香虫、枸杞子、白术、湘曲等组成,湖南中医药大学第一附属医院药剂科生产,批号:040106)。奥沙利铂甘露醇注射液(L-OHP),规格:100 mL∶0.1 g,商品名:艾恒,购自江苏恒瑞医药股份有限公司,产品批号:国药准字H20050962。 氟尿嘧啶注射液(5-Fu),规格:10 mL,0.25 g,购自天津金耀药业有限公司,国药准字H12020959。 亚叶酸钙注射液(calcium folinate in jection, CF),规格:10 mL:0.1 g(以亚叶酸计),购自 江 苏恒瑞医药股份有限公司,国药准字H20000584。
1.3 主要试剂
快速金BCA 蛋白测定试剂盒(皮诺飞生物公司,批号:P0009);5×蛋白上样缓冲液(皮诺飞生物公司,批号:PN0033);磷酸化蛋白酶抑制剂(Servicebio公司, 批号:G2007);BCA 蛋白定量检测试剂盒(Service bio 公司,批号:G2026);RIPA 裂解液(皮诺飞生物公司,批号:P0005);磷酸化蛋白酶抑制剂(皮诺飞生物公司,批号:P0007);蛋白酶抑制剂(Beyotime,批号:P1030);PVDF膜(MILLIPORE 公司,批号:IPVH00010);小鼠TNF-α 酶联免疫吸附测定试剂盒(伊莱瑞特,批号:E-EL-M3063);小鼠白介素6(IL-6)酶联免疫吸附测定试剂盒(伊莱瑞特,批号:E-EL-M0044c)。
1.4 主要仪器
高速组织研磨仪(Jingxin 公司,型号:JXFSTPRP-48);高速离心机(科析仪器有限公司,型号:TGL-16);台式冷冻离心机(SCILOGEX 公司,型号:CF1524R);电磁炉(SUPOR 公司,型号:C22-IH69E5);电泳电源(型号:164-5070)、转膜槽(型号:170-3930);电泳槽(型号:165-8001)均购自BIO-RAD 公司;数显钟摆摇床(Servicebio 公司,型号:DS-S100);暗匣(广东粤华医疗器械厂有限公司,型号:AX-Ⅱ;FlexStation);多 功 能 酶 标 仪(Molecular Devices 公司,型号:Flexstation3);离心机(湖南湘仪仪器有限公司,型号:H1650-W)。
2 实验方法
2.1 模型制备
BALB/C-nu/nu 雄性裸鼠饲养于温湿度适宜、人工12 h 昼/夜循环照明的SPF 级动物房,适应性饲养1 周后,按随机分配的原则分为模型组、阳性对照组、中药低剂量组、中药中剂量组、中药高剂量组、中西药组(中药+阳性对照药)。 小鼠均用1%戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,于背侧中部、左侧腋中线与腋后线间,取1 cm 左右纵形切口进腹,暴露脾脏,于脾脏下极贴近脾包膜沿脾脏纵轴向上进针,注入敲除NF-κB p65、STAT3 表达的CT26 细胞悬液0.2 mL,退针后立即用蘸有络合碘的消毒棉签轻压针眼数秒,查看无出血后,将脾脏放回原位,依次间断缝合腹膜、皮肤,关腹[12-13]。
2.2 实验分组
将造模后的BALB/c 小鼠按随机原则进行分配,每组5 只。 模型组裸鼠以0.5 mL 生理盐水灌胃,1 次/d;阳性对照组根据《CSCO 结直肠癌诊疗指南(2022)》选择晚期结直肠癌一线治疗方案,具体药物为:L-OHP、5-Fu、CF,剂量L-OHP 1 mg、5-Fu 4 mg、CF 0.4 mg,腹 腔 注 射,1 次/周;中药低剂量组、中药中剂量组、中药高剂量组裸鼠以抗癌防移片中药混悬液灌胃,剂量分别相当于60 kg 成人等效剂量的1、3、5 倍,分别为1、3、5 g/mL 抗癌防移片混悬液,1 次/d;中西药组裸鼠以5 g/mL 抗癌防移片中药混悬液灌胃,1 次/d,并联合L-OHP 1 mg、5-Fu 4 mg、CF 0.4 mg 腹腔注射,1 次/周。 所有组别连续给药3周。
2.3 观察指标及方法
2.3.1 一般情况观察 给药过程中每日定时观察小鼠状态,包括精神、饮食、活动、皮毛、排泄物以及腹部。每隔3 天称量并记录小鼠体质量,各组小鼠灌胃3 周治疗结束后,进行采血工作等相关工作后,处死小鼠,立即解剖观察腹腔内情况,包括肝脏转移和其他脏器受累情况,腹腔淋巴结转移情况,有无血性腹水。 测量肝脏重量,将肝转移癌组织切下进行称重,计算癌重/肝重比和抑瘤率。 抑瘤率=(1-治疗组平均瘤重/对照组平均瘤重)×100%。
2.3.2 肝脏组织的病理学检测 剖腹观察并记录各组小鼠肝脏成瘤情况,摘取肝脏,称重,进行数据统计分析。首先用多聚甲醛对肝脏组织进行固定包埋,流水冲洗组织中残存的多聚甲醛,组织转入脱水机中进行梯度乙醇脱水,彻底脱水后浸入无水乙醇,浸蜡包埋。将组织切成厚度为4 μm 的切片,通过展片、捞片、烤片、脱蜡、乙醇浸入等HE 染色程序,采用中性树胶封片,在光镜下观察、拍照,得到相应的图片进行分析。
2.3.4 Western bolt 实验检测P65 及STAT3 蛋白表达 首先针对进行蛋白提取,用PBS 缓冲液冲洗组织块,加入组织蛋白提取试剂,充分匀浆后,在4 ℃12 000 r/min 离心15 min,收集总蛋白溶液。 总蛋白溶液变性,向每个样品的总蛋白溶液中加入5×loading buffer 上样缓冲液,加热,离心,涡旋混匀后再离心。 配制分离胶、浓缩胶后立即灌胶;玻璃板固定好后加入预先配制好的分离胶。 待胶凝固后,加入浓缩胶并插入梳子,待胶再次凝固后轻轻拔出梳子。处理好的各组蛋白样品并开始电泳。PVDF 膜于甲醇中活化1 min,分离胶,加入预冷的转膜液,设定电流为250 mA,于冰浴中转膜1 h。 封闭:将PVDF 膜放入适量5%脱脂奶粉中,于脱色摇床上振荡封闭1 h。 经过一抗孵育、二抗孵育。 滴加新鲜配制的ECL 混合溶液到膜的蛋白面侧,发光检测。根据不同的光强度调整曝光条件,显影、定影。 采用AlphaEaseFC 软件处理系统分析目标带的光密度值。
2.3.5 ELISA 法检测血清中TNF-α 蛋白浓度 将样本血清3000 r/min 离心10 min,取上清检测。 设置空白孔、标准孔、待测样品孔。 分别于各空中按实验规定加入样品稀释液100 μL。 覆膜,37 ℃孵育90 min。将孔内液体丢弃,甩干,不用洗板,每孔中加入生物素化抗体工作液100 μL,将覆膜盖上酶标板,37 ℃温育1 h。将剩余液体丢弃,洗板3 次,每次浸泡30 s,大约350 μL/孔,最后用吸水纸将孔内液体擦干。 每孔加入酶结合物工作液100 μL,覆膜盖上,37 ℃温育30 min。 将孔内液体丢弃,甩干,洗板5 次。 将显色剂(TMB)加入每个孔中约90 μL,将覆膜盖上酶标37 ℃避光孵育15 min。 每孔加入终止液终止反应,在450 nm 波长下用酶标仪测量各孔的光密度即OD 值。
2.4 统计学处理
实验数据采用SPSS 21.0 软件进行统计学分析。 计量资料以“±s”表示,数据符合正态分布及方差齐性时,两组间比较采用独立样本t 检验,多组间比较采用单因素方差分析,多重比较采用LSD 法;数据符合正态分布但方差不齐时,两组间比较用Satterthwaite 近似T 检验,多组间比较采用近似T 检验Welch 法;数据不符合正态分布,则采用非参数检验。计数资料以例数或百分率表示,组间比较采用χ2检验。 均以P<0.05 为差异有统计学意义。
3 结果
3.1 各组小鼠一般情况观察
模型组小鼠活动度最低, 进食量最少, 四肢消瘦,腹水严重;阳性对照组小鼠活动度低,但进食情况较模型组好,依然存在腹水情况;中药低剂量组小鼠活动度差,进食情况差,存在大量腹水情况;中药中剂量组小鼠活动度一般,进食量中等,有较多腹水;中药高剂量组小鼠活动度良好,进食情况良好,无腹水;中西药组小鼠活动度可,进食情况良好,无腹水。给药前及给药后1 周,各组间比较体质量无明显差异(P>0.05);给药后3 周,与模型组比较,中药高剂量组、中西药组、阳性对照组小鼠的体质量差异明显(P<0.05)。 详见表1。
表1 各组小鼠体质量变化情况(g,±s,n=5)

表1 各组小鼠体质量变化情况(g,±s,n=5)
注:与模型组比较,*P<0.05;与中药低剂量组比较,△P<0.05。
给药3 周11.02±3.50 25.92±2.09*△11.96±3.52 14.03±4.54 25.29±4.61*△26.69±1.90*△组别模型组阳性对照组中药低剂量组中药中剂量组中药高剂量组中西药组给药前19.98±5.62 20.18±4.14 20.39±2.06 20.04±3.67 19.85±6.96 20.21±1.97给药1 周17.57±3.82 16.22±2.67 17.65±4.70 17.21±4.02 16.39±2.90 16.83±6.28给药2 周13.29±4.25 17.47±2.05 13.84±1.94 15.39±3.89 17.49±5.76 18.08±4.30*△
3.2 各组肝组织瘤体比较
与模型组相比,中药高剂量组、中西药组阳性对照组、肝组织瘤体重量明显降低(P<0.05)。 详见表2、图1。
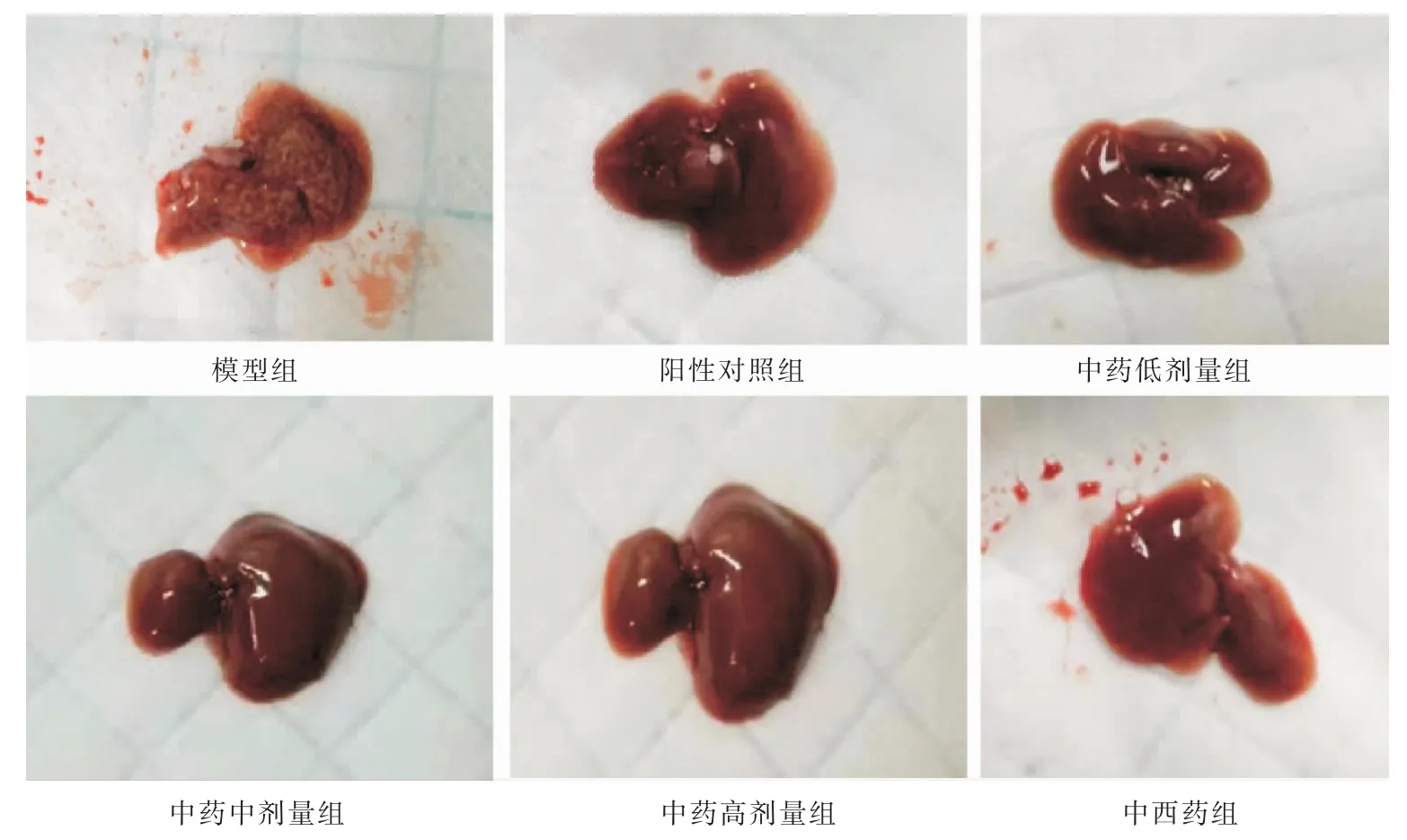
图1 各组肝转移瘤情况
表2 肝组织瘤体重量(g,±s)

表2 肝组织瘤体重量(g,±s)
注:与模型组比较,*P<0.05。
组别模型组阳性对照组中药低剂量组中药中剂量组中药高剂量组中西药组n 5 5 5 5 5 5瘤体重量2.8±0.25 1.00±0.23*1.54±0.24 1.24±0.23 1.46±0.23*0.96±0.21*
3.3 肝脏组织的HE 染色
模型组肝脏组织上可见多个大小不等的结节,HE 染色后在光镜下观察,肝脏细胞结构排列无序,细胞大小不一,异型性明显,细胞核增多,可见病理性核分裂,与肠上皮病灶形态类似。 与模型组比较,中药高剂量组、中西药组、阳性对照组小鼠肝脏组织结节明显少于模型组,细胞排列整齐,结构清晰,仅可见少许异型细胞。 详见图2。

图2 各组小鼠灌胃3 周后肝脏组织的HE 染色(×100)
3.4 Western bolt 检测结直肠癌肝转移瘤中P65 及STAT3 蛋白表达情况
与模型组比较,中药高剂量组、中西药组、阳性对照组P65、STAT3 蛋白表达显著降低,差异具有统计学意义(P<0.05);与阳性对照组比较,中西药组P65、STAT3 蛋白表达显著降低,差异具有统计学意义(P<0.05)。 中药低、中、高剂量组中P65 及STAT3 蛋白进行组间比较,呈剂量依赖相关,差异具有统计学意义(P<0.05)。 详见图3、表3。

图3 瘤组织中P65 和STAT3 蛋白表达灰度条带
表3 各组P65、STAT3 蛋白表达水平(±s,n=5)
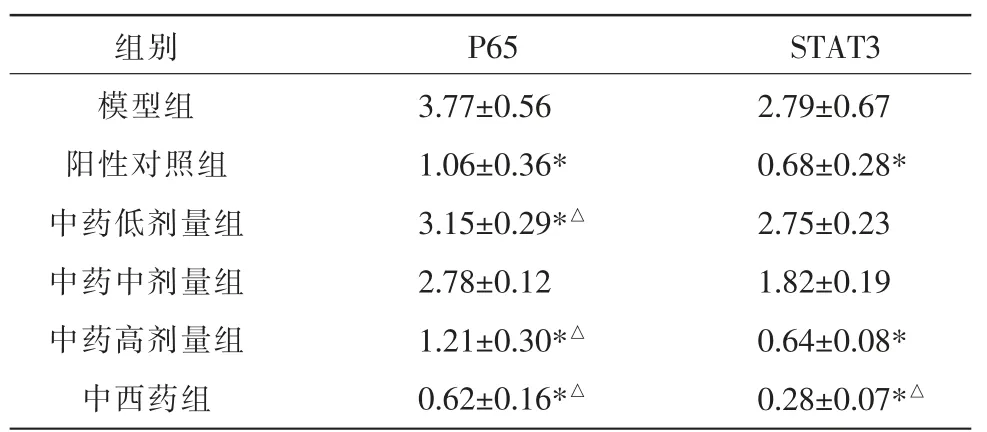
表3 各组P65、STAT3 蛋白表达水平(±s,n=5)
注:与模型组比较,*P<0.05;与阳性对照组比较,△P<0.05。
组别模型组阳性对照组中药低剂量组中药中剂量组中药高剂量组中西药组P65 3.77±0.56 1.06±0.36*3.15±0.29*△2.78±0.12 1.21±0.30*△0.62±0.16*△STAT3 2.79±0.67 0.68±0.28*2.75±0.23 1.82±0.19 0.64±0.08*0.28±0.07*△
3.5 ELISA 检测裸鼠血清中TNF-α 浓度含量情况
与模型组相比,中药低剂量组、中药中剂量组以及中药高剂量组的TNF-α 浓度含量呈下降趋势,差异有统计学意义(P<0.05)。中药低、中、高剂量组进行组间比较,差异无统计学意义(P>0.05),与阳性对照组相比中西药组,TNF-α 浓度降低,差异具有统计学意义(P<0.05)。 详见表4。
表4 各组TNF-α 浓度表达水平(pg/mL,±s,n=5)

表4 各组TNF-α 浓度表达水平(pg/mL,±s,n=5)
注:与模型组比较,*P<0.05;与阳性对照组比较,△P<0.05。
组别模型组阳性对照组中药低剂量组中药中剂量组中药高剂量组中西药组TNF-α 浓度223.574±15.253 93.657±10.273*208.452±12.354*△175.147±12.281*△68.382±13.607*△65.955±10.020*△
4 讨论
目前研究发现,有两种相对成熟的学说可以解释为何结直肠癌较易发生肝转移:“种子-土壤”及“机械和解剖”学说。 “种子-土壤”学说认为肿瘤的转移不仅取决于自身的繁殖、分裂、扩张能力,还取决于肿瘤细胞天生生长的“土壤”,即肿瘤微环境。肿瘤微环境中包含了一种重要的状态即肿瘤炎性微环境[14]。肿瘤炎性微环境主要由巨噬细胞、中性粒细胞、淋巴细胞,及其分泌的细胞因子、趋化因子和生长因子等炎性介质构成[15]。 NF-κB 被认为是肿瘤炎症反应的关键调节器,在哺乳动物中,通常以P65/P50 二聚体的形式传递转录活性。 信号转导子和转录激活子3(STAT3)是一种重要的转录因子,亦可通过磷酸化(p-STAT3)被激活,激活后的STAT3 可通过诱导细胞因子和趋化因子等的表达,在调节炎症反应中发挥重要作用。 不同细胞的活化、细胞因子水平的变化、炎性反应失衡等导致肝脏转移前微环境改变,是循环肿瘤细胞最终在肝脏定植、生长的关键[16-17]。 多种复杂类型细胞存在于人体肝脏内,其中的Kupffer 细胞本质属于巨噬细胞,其主要起到抗原呈递的作用,IL-1、IL-6、P65、STAT3、TNF-α 等细胞因子在一定条件下可由Kupffer 细胞释放从而影响肝脏微环境。 因此,炎性相关因子在肝脏转移瘤的形成过程中可能扮演较重要的角色[18]。
结直肠癌发病机制复杂,涉及多条通路和多种基因的调控,这与中医药治疗具有“多成分、多途径、多靶点”等作用特点契合[25],因此,中医药在治疗肿瘤方面的作用被越来越多的科研工作者所关注。在中医中,结直肠癌属于“肠覃”“脏毒”和“锁肛痔”等病症范围。《医宗金鉴·脏毒》中论述:“此病有内外阴阳之别”说明结直肠癌的病因复杂,与饮食不节、邪毒内侵、情志不遂、脏腑虚损等因素相关,其局部以湿热瘀毒为主属实,全身气血亏虚以脾肾为主属虚,因此,正虚为本,湿热瘀毒为标是结直肠癌发病的病机特点[19-20]。抗癌防移片系三湘名医经验方,主要由红参、半枝莲、黄芪、薏苡仁、姜黄、女贞子、墨旱莲、莪术、九香虫、枸杞子、白术、湘曲等中药组成。方中以红参为君,起到大补元气、健脾益气之功;半枝莲为臣,奏清热解毒、化瘀利尿之效;黄芪、白术、薏苡仁益气健脾;湘曲消食健胃,女贞子、墨旱莲、枸杞子滋补肝肾;莪术、九香虫、姜黄行气破血;全方合用,具有疏肝健脾、补肾益气,化瘀解毒等功效。多年的临床应用显示,抗癌防移片可降低结直肠癌患者术后复发转移率。
本研究结果显示,造模成功后,中药高剂量组的小鼠的精神状态、大便稀溏、腹水等一般情况有明显改善,并且造模后小鼠体质量增加。中药高剂量组肝组织瘤体平均体质量均低于模型组,一定程度上可抑制结直肠癌肝转移瘤的生长。 光镜下观察肝脏病理组织变化提示,与模型组比较,中药高剂量组、中西药组、阳性对照组小鼠组织细胞排列整齐,结构清晰,仅可见少许异型细胞。抗癌防移片抑制结直肠癌肝转移,分子机制研究结果显示,抗癌防移片可显著抑制结直肠癌肝转移瘤组织中P65 和STAT3 的蛋白表达,同时也可显著抑制结直肠癌肝转移瘤动物模型血清中外泌的TNF-α 蛋白浓度表达,上述结果证实了抗癌防移片抑制结直肠癌肝转移的作用机制之一与调控NF-κB 和STAT3 信号通路的蛋白及基因表达相关。 本次动物实验研究结果提示,抗癌防移片对预防结直肠癌肝转移有一定的作用,其机制与抑制P65、STAT3、TNF-α 蛋白表达有一定的关系。 综上所述,抗癌防移片可通过NF-κB 及STAT3 通路,发挥其抑制结直肠癌肝转移治疗目的,为抗癌防移片治疗结直肠癌的临床应用提供实验基础。

