扶正口服液对诱导性癌症恶病质裸鼠骨骼肌中ERAD/ERSIA 通路的影响
孙银辉,何 晓,李涵宇,窦 娴,陈 晟,彭慧婷,杨 晓,刘 华,李 菁,王理槐*
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007)
癌症恶病质(cancer cachexia, CC)是一组常见于恶性肿瘤晚期消耗性症状的总称,是肿瘤患者死亡的原因之一,但其发病机制及有效治疗策略尚待探索。 内质网应激(endoplasmic reticulum stress,ERS)介导的内质网应激相关性降解(ER-associated degradation, ERAD)-内质网应激性凋亡(endoplasmic reticulum stress induced apoptosis, ERSIA)途径是机体细胞内蛋白质稳态和质量控制的关键机制,ERAD-ERSIA 稳态失衡在CC 骨骼肌消耗过程中扮演重要角色[1],多项研究[2-3]证实,上调ERAD 途径蛋白表达抗凋亡对细胞具有保护作用。 然而如何通过ERAD 途径影响CC 肌肉代谢的抗凋亡机制则缺乏研究。课题组基于“脾在体合肉,主四肢,肾在体合骨”的生理特性及明代李中梓“脾肾互赞”学说,提出了“健脾益肾法干预CC 骨骼肌消耗”的治疗思路,并创湖南中医药大学第一附属医院院内制剂扶正口服液(主要由茯苓、党参、太子参、熟地黄、黄精、女贞子、淫羊藿等组成)。 前期[4-8]研究证实,扶正口服液可通过降低肿瘤微环境中炎症因子的表达改善CC,但其机制有待深入研究。 基于此,本研究拟使用扶正口服液干预不同阶段的CC 模型裸鼠, 观察不同时间段肿瘤体积、裸鼠摄食量、体质量变化,检测ERAD 通路调控蛋白X 盒结合蛋白1(X-box binding protein1, XBP1)、内质网跨膜蛋白激酶1(inositol requiring enzyme 1, IRE1)、内质网相关降解蛋白1(Derlin-1)、滑膜细胞凋亡抑制物1(synovial apoptosis inhibitor 1, SYVN1) 表达和ERSIA 信号通路CCAAT增强子结合蛋白同源蛋白 (CCAAT/enhancer-binding protein-homologous protein, CHOP)、c-Jun 氨基末端激酶(c-Jun N-terminal kinase, JNK)蛋白表达情况,探讨扶正口服液对CC 的作用及其机制。
1 材料与方法
1.1 实验动物
BALB/c-nu 裸鼠36 只,雄性,购自湖南安生美药物研究院有限公司,许可证号:SCXK(湘)2019-0004,鼠龄4~5 周。 分笼喂养,自由采食,温度为(24±3) ℃,湿度为40%~60%。实验全程完成于湖南中医药大学动物实验中心。 研究经湖南中医药大学动物实验伦理委员会审批(审批号:LL2020052601),对动物的各种处理均遵循中华人民共和国科技部2006年颁布的《关于善待实验动物的指导性意见》的相关规定。
1.2 实验药品、试剂及器材
扶正口服液(湖南中医药大学第一附属医院,批号:20210518);SYVN1、IRE1、XBP1、CHOP、p-JNK(江苏亲科生物研究中心有限公司,批号:DF12235、DF7709、AF5110、DF6025、AF3318);Derlin-1[艾博抗(上海)贸易有限公司,批号:Ab176732];羊抗兔-HRP(北京博奥森生物技术有限公司,批号:bs-0295GHRP);30%制胶液(索莱宝生物技术有限公司,批号:A1010)。 YLS-Q6 型裸鼠灌胃器(淮北正华生物仪器设备有限公司);Leica Dm LB2 型显微镜(美嘉仪器股份有限公司);HXT/C 型低温解剖操作台(上海优浦科学仪器有限公司);H2050R-1 型低温高速离心机(上海华岩设备有限公司);ACS-3 型电子记价秤(上海台衡仪器仪表有限公司)。
1.3 CC 模型建立[9-11]及分组干预
选取36 只6~7 周龄BALB/c-nu SPF 级裸鼠,依据前期研究基础及相关文献[9-10]造模,采用苦寒泻下、饥饱失常、力竭运动三因素诱导法诱导14 d,建立脾虚证裸鼠模型,随机取12 只分为A 组(正常裸鼠生理盐水灌胃)、B 组(正常裸鼠扶正口服液灌胃)。 剩余24 只脾虚证裸鼠右前腋下接种CT26 结肠癌细胞,接种剂量0.1 mL/只,接种过程在1 h 完成。接种后同时采用苦寒泻下、饥饱失常两因素诱导法,继续诱导14 d,致瘤后体质量显著下降,裸鼠右侧腋下扪及肿块,精神萎靡,无明显自主活动,同时出现摄食量下降、体质量下降、毛发干枯及活动减少等症状时,提示CC 模型已建立。成功建立脾虚证裸鼠CC 模型的24 只裸鼠随机分成A、B、C、D 组,每组6 只。
A 组:生理盐水40 mL/kg 灌胃,连续56 d;B组:按人-小鼠等效剂量换算,灌胃扶正口服液(40 mL/kg),连续56 d;C 组:生理盐水(40 mL/kg)于CC 后灌胃14 d;D 组:CC 后扶正口服液(40 mL/kg)灌胃14 d;E 组:生理盐水(40 mL/kg)于CC 后灌胃28 d;F 组:CC 后连续灌胃扶正口服液(40 mL/kg)28 d。
1.4 观察指标
1.4.1 体质量测定 分别在0、14、28、42、56 d 解剖取材前各称重1 次, 精确到0.01 g, 称重时间选在14:00~16:00,最后以颈椎脱臼法处死各组实验裸鼠,剥离出整个瘤体,测量比对其最大直径,肿瘤组织经10%中性甲醛固定,以备组织切片及免疫组化分析使用;肌腱无损失分离双侧后肢骨骼肌备用。1.4.2 摄食量观察 裸鼠同笼喂养,提供同一饲料,每日14:00~16:00 记录每组裸鼠摄食总量。摄食量=前一日饲料量-次日剩余饲料量,测第14、28、42、56天的摄食量。
1.4.3 肿瘤体积测定 颈椎脱臼法处死各组实验裸鼠,剥离瘤体,开始用游标卡尺测定肿瘤的长、短径,按以下公式计算肿瘤体积:肿瘤体积(V)=1/2×a×b2,其中a、b 分别代表肿瘤的长径(mm)、短径(mm)。
1.5 HE 染色观察骨骼肌组织病理学变化
将裸鼠肌肉组织放于标记编号的包埋盒中,脱水、透明、浸蜡、包埋、切片、烤片,再进行HE 染色,在100 倍、400 倍视野进行采集。 将切片置于显微镜下,选取每块肌肉横截面内300~400 条肌纤维进行测量,在每块肌肉横截面切片图像上,随机选择一个不位于图像边缘的方格作为起点,有规律地间隔若干个方格,分别计数各选定方格内的肌纤维(通过调整方格大小,保证最终能采集到足够的肌纤维总数),在计数每个方格内的肌纤维数目时,方格上方及左侧边框上的肌纤维不作计数和测量。 采集到足够数量的肌纤维,并采用Image-Pro Plus 6.0 医学图像分析软件分析,计算每块肌肉的肌纤维横截面积。
1.6 RT-PCR 检测ERAD/ERSIA 信号通路激活情况
各组裸鼠取材后提取RNA,经多功能酶标仪检查浓度后,去除残留基因组DNA,逆转录制备cDNA,设置逆转录程序,逆转录后得到cDNA,稀释10 倍,-20 ℃保存备用。 以2-ΔΔCt法(Livak 法)进行定量分析,再用校准样本的ΔCt 值归一试验样本的ΔCt值,最后计算表达水平比率。 引物序列见表1。

表1 RT-PCR 引物序列
1.7 Western blot 检测ERAD/ERSIA 信号通路激活情况
从冰箱中取出冻存的样本,称取适量的组织按照1∶9 的比例加入含有蛋白酶抑制剂的裂解液,在4 ℃的条件下震荡至组织块全部破碎,置于冰上裂解20 min,4 ℃,12 000 r/min 离心20 min,离心半径8 cm,吸取上清。采用BCA 蛋白浓度测定试剂盒测定蛋白质浓度,根据测定结果对蛋白浓度进行调整,保证不同组别之间蛋白浓度一致,根据实际情况计算样本最终上样量,与适量loading buffer 混匀,95 ℃煮5 min,冰浴冷却后于-80 ℃保存。 制备电泳胶,上样,电泳,转膜,免疫印迹显色,将每个指标与内参GAPDH 进行灰度值比较,计算出每个指标的相对灰度值,使用Graphpad prism(6.01)软件进行绘图。
1.8 统计学方法
数据分析采用SPSS 18.0 统计软件完成,计量资料用“±s”表示,正态分布计量资料用单因素方差分析(One-Way ANOVA)进行比较,偏态分布计量资料采用秩和检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 各组裸鼠一般情况比较
实验过程中,A、B 组裸鼠一直保持体格大小正常,体质量波动小,肤色红润等健康体征,未见异常;C、E 组肿瘤体积随时间增长而增大,体格逐渐消瘦,裸鼠活动性差,肤色苍白,皮褶度变大,CC 体征逐渐加重;D 组与C 组相比略显红润,稍活跃;F 组与E 组相比体征有略微的改善。图1a 为裸鼠处死前的拍照。
2.2 各组裸鼠肿瘤体积比较
实验末期剖取瘤体拍照,测量计算肿瘤长短径估算体积并对比。与C 组比较,D 组肿瘤体积减小(P<0.05),E 组肿瘤体积明显增大(P<0.05);与E 组比较,F 组肿瘤体积减小(P<0.05)。 详见图1b、图1c。

图1 各组裸鼠一般情况及肿瘤体积变化情况
2.3 各组裸鼠摄食量、体质量比较
与A、B 组比较,C、D 组摄食量均下降(P<0.05);与C 组比较,D 组摄食量增加,E、F 组摄食量下降(P<0.05);与D 组比较,E、F 组摄食量下降(P<0.05);与E 组比较,F 组摄食量增加(P<0.05)。 与A、B 组比较,在第6 周C、D 组体质量下降(P<0.05),在第8周E、F 组体质量下降(P<0.05);与C 组比较,第6周D 组体质量增加(P<0.05);与E 组比较,第8 周F组体质量增加(P<0.05)。 详见图2。

图2 各组裸鼠摄食量、体质量变化情况
2.4 各组裸鼠骨骼肌组织病理变化
A、B 组骨骼肌组织肌纤维排列规则整齐,可见线粒体分布于相邻的肌原纤维之间,C、D、E、F 组骨骼肌组织肌纤维肿胀,结构紊乱,排列不齐,肌横纹不清晰,局部肌膜不完整,肌核分布不均,出现核聚集或部分肌细胞核消失,肌间隙严重消失;D、F 组较C、E 组肌纤维排列整齐,条理较清晰,只有少部分肌纤维肿胀,肌细胞核较均匀分布在肌膜下,无增生和肿胀或固缩,肌纤维间隙尚正常,且F 组较D 组改善更明显。 详见图3。
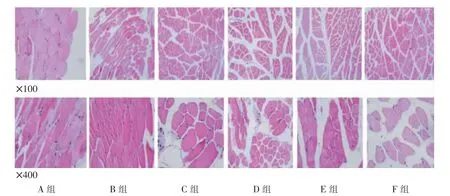
图3 各组裸鼠骨骼肌组织HE 染色
2.5 各组裸鼠骨骼肌组织中CHOP mRNA 及CHOP、p-JNK 蛋白表达比较
与A 组比较,B、C、D、E、F 组CHOP mRNA 及CHOP 蛋白表达下降(P<0.05),C、D、E 组p-JNK 蛋白表达升高(P<0.05),B、F 组p-JNK 蛋白表达下降(P<0.05)。与B 组比较,C 组CHOP mRNA 及CHOP、p-JNK 蛋白表达升高(P<0.05),D、E、F 组CHOP mRNA 表达下降(P<0.05),D、E 组CHOP、p-JNK 蛋白表达升高(P<0.05),F 组CHOP、p-JNK 蛋白表达下降(P<0.05)。 与C 组比较,D、E、F 组CHOP mRNA及蛋白表达下降(P<0.05),D、F 组p-JNK 蛋白表达下降(P<0.05),E 组p-JNK 蛋白表达升高(P<0.05)。与D 组比较,F 组CHOP mRNA 表达下降(P<0.05),E组CHOP、p-JNK 蛋白表达升高(P<0.05),F 组CHOP、p-JNK 蛋白表达下降(P<0.05)。 与E 组比较,F 组CHOP mRNA 及CHOP、p-JNK 蛋白表达下降(P<0.05)。 详见图4。

图4 各组裸鼠骨骼肌组织CHOP mRNA 及CHOP、p-JNK 蛋白相对表达量比较
2.6 各组裸鼠骨骼肌组织中XBP1、IRE1、Derlin-1、SYVN1 mRNA 及蛋白表达比较
与A 组比较,B 组XBP1、IRE1、Derlin-1、SYVN1蛋白及mRNA 表达升高(P<0.05);C 组XBP1、Derlin-1、SYVN1 mRNA 表达下降(P<0.05),IRE1 mRNA表达升高(P<0.05),XBP1、IRE1、SYVN1 蛋白表 达 升高(P<0.05),Derlin-1 蛋 白 表 达 下 降(P<0.05);D组XBP1 mRNA 表达下降(P<0.05),Derlin-1、SYVN1 mRNA 表达升高(P<0.05),XBP1、Derlin-1、SYVN1蛋白表达升高(P<0.05),IRE1 蛋白表达下降(P<0.05);E 组XBP1、Derlin-1、SYVN1 mRNA 表达下降(P<0.05),IRE1 mRNA 表达升高(P<0.05),XBP1、IRE1、Derlin-1、SYVN1 蛋白表达下降(P<0.05);F 组XBP1、Derlin-1、SYVN1 mRNA 表达下降(P<0.05),IRE1 mRNA 表达升高(P<0.05),XBP1、Derlin-1 蛋白表达下降(P<0.05),IRE1、SYVN1 蛋白表达升高(P<0.05)。 与B组比较,C 组XBP1、Derlin-1、SYVN1 蛋白及mRNA表达下降(P<0.05),IRE1 mRNA 及蛋白表达升高(P<0.05);D 组XBP1、DREL1、SYVN1、IRE1 mRNA表达下降(P<0.05),XBP1、Derlin-1、SYVN1 蛋白表达升高(P<0.05),IRE1 蛋白表达下降(P<0.05);E组XBP1、Derlin-1、SYVN1、mRNA 表达下降(P<0.05),IRE1 mRNA 表达升高(P<0.05),XBP1、Derlin-1、SYVN1、IRE1 蛋白表达下降(P<0.05);F 组XBP1、Derlin-1、SYVN1 mRNA 表达下降(P<0.05),IRE1 mRNA表达升高(P<0.05),XBP1、SYVN1 蛋白表达升高(P<0.05),IRE1、Derlin-1 蛋白表达下降(P<0.05)。 与C组比较,D 组XBP1、Derlin-1、SYVN1 mRNA 及蛋白表达升高(P<0.05),IRE1 mRNA 及蛋白表达下降(P <0.05);E 组XBP1、IRE1、Derlin-1、SYVN1 mRNA 及蛋白表达下降(P<0.05);F 组IRE1 mRNA 表达下降(P<0.05),XBP1、SYVN1 蛋白表达升高(P<0.05),IRE1、Derlin-1 蛋白表达下降(P<0.05)。 与D 组比较,E 组XBP1、Derlin-1、SYVN1 mRNA 表 达 下 降(P<0.05),IRE1 mRNA 表达升高(P<0.05),XBP1、IRE1、Derlin-1、SYVN 蛋白表达下降(P<0.05);F 组IRE1 mRNA 表达升高(P<0.05),Derlin-1、SYVN1 mRNA 表达下降(P<0.05),XBP1、Derlin-1、SYVN 蛋白表达下降(P<0.05),IRE1 蛋白表达升高(P<0.05)。与E 组比,F 组XBP1、IRE1、Derlin-1、SYVN1 蛋白及mRNA 表达均升高(P<0.05)。 详见图5。
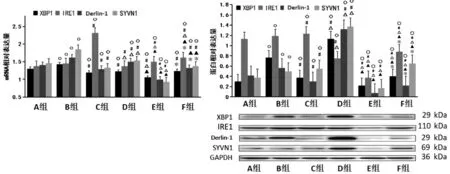
图5 各组裸鼠骨骼肌组织中XBP1、IRE1、Derlin-1、SYVN11mRNA 及蛋白相对表达量比较
3 讨论
CC 状态下,骨骼肌细胞内质网应激介导的未折叠蛋白反应通过减少错误折叠蛋白的生成缓解内质网压力,不能被重新折叠的错误折叠蛋白通过ERAD 途径予以降解以促进骨骼肌细胞生存。 若持续的ERAD 都不能恢复肌细胞内质网正常功能,则细胞启动ERSIA 促进细胞死亡。 因此,“ERADERSIA 稳态失衡”在CC 骨骼肌消耗过程中扮演重要角色[11],促进恢复“ERAD-ERSIA 稳态”是治疗CC的潜在策略。
研究表明,内质网应激、线粒体通路、死亡受体通路及氧化应激等均参与了细胞凋亡,其中ERS 是目前的研究热点[12]。研究发现,ERS 包括未折叠蛋白反应、内质网相关性死亡和整合应激反应是3 个相互联系的动态过程,其中最主要的是未折叠蛋白反应[13]。研究证实,ERS 表达过强或者持续时间过长均会引发细胞凋亡,ERS 是引发细胞凋亡的重要途径[14]。ERS 主要通过CHOP、JNK、Caspase-12 途径诱导凋亡,其中CHOP 介导的细胞凋亡信号通路是ERSIA的主要形式[15]。 同时,ERAD 的大致过程为羟甲基戊二酰辅酶A 还原酶降解蛋白1(hydroxymethylglutaryl-goA reductase degradation protein 1, Hrd1)通过一种目前尚未知的机制识别并结合错误折叠蛋白,接着由Derlin-1、硒蛋白(VCP/P97-interacting membrane protein, VIMP)、E3 泛素连接酶和p97 组成的复合物也加入其中,最终形成一个更大的转位复合物。错误折叠蛋白经泛素化修饰后,通过跨膜通道转运至细胞质蛋白酶体中降解,XBP1、IRE1、SYVN1也被证实在ERAD 途径中有重要作用[16]。
本研究显示,随着肿瘤的增长,C、D、E、F 组裸鼠的体质量逐渐下降,第6 周发现,在扶正口服液的作用下D 组裸鼠体质量较C 组有升高的趋势,第8周发现,在扶正口服液的作用下F 组裸鼠体质量较E 组有升高的趋势,缓解了CC。同时,D、F 组裸鼠的摄食量较未给药的裸鼠有所提升。CC 病程中肿瘤体积会逐渐增大,但D、F 组较同期C、E 组肿瘤体积减小,提示扶正口服液可能通过减小肿瘤体积缓解CC。 通过RT-PCR、Western blot 法检测组织蛋白、mRNA 的表达发现:ERSIA 主要通路蛋白CHOP、p-JNK 在D 组较C 组表达下降,在F 组较E 组表达下降;ERAD 途径的主要通路蛋白XBP-1、Derlin-1、SYVN1 则 在D 组 较C 组 表 达 升 高,XBP1、IRE1、Derlin-1、SYVN1 蛋白在F 组较E 组表达升高。上述结果提示在CC 过程中,扶正口服液可能通过抑制ERSIA 的促骨骼肌凋亡途径和促进ERAD 的骨骼肌细胞抗凋亡途径,纠正“ERAD-ERSIA 失衡”而改善CC 状态。
同时,本研究团队发现扶正口服液干预晚期CC 优于早期CC。中医认为,肿瘤初期,正气未虚,瘀毒邪气内盛,此时当以驱邪为主[17-19]。 若此时重用健脾益肾法为主的扶正口服液,则闭门留寇,邪毒更甚,故早期使用扶正口服液干预CC 无明显疗效优势;肿瘤晚期时,机体邪正俱虚,但正虚更甚,难以驱邪外出[20-22]。 此时使用扶正口服液以扶正祛邪,用药切合病机,故晚期扶正口服液干预CC 的疗效明显。
综上所述,本研究证实扶正口服液的抗CC 作用及其优势作用时间,初步揭示了ERAD-ERSIA 通路在CC 中的作用。 扶正口服液通过上调骨骼肌XBP1、IRE1、Derlin-1、SYVN1 蛋白表达激活ERAD通路,下调CHOP、p-JNK 蛋白表达抑制ERSIA 通路,纠正“ERAD-ERSIA 稳态失衡”是其抗CC 的机制之一。 这为扶正口服液临床用于改善肿瘤晚期CC提供了支撑,后续将继续对该制剂的药理机制做深入探索。

