非酒精性脂肪性肝病合并肝纤维化与心血管疾病常见危险因素的关系
师强伟 于蕊
非酒精性脂肪性肝病(NAFLD)是指除外酒精及其他明确肝损伤病因所致的以弥漫性肝细胞大泡性脂肪变为主要特点的慢性肝脏疾病,其疾病谱包括非酒精性单纯性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)及与其相关的肝硬化和肝细胞癌[1-3]。NAFLD在西方国家是最常见的慢性肝脏疾病,其发病率近年来在中国也呈上升趋势,成为我国重要的公共健康问题之一[4]。尽管NAFLD在人群中的发病率逐渐升高,但只有少数人发展为肝脏相关的严重并发症及死亡,心血管疾病仍是NAFLD患者致残及死亡的最主要原因[5]。研究发现肝脏纤维化是NAFLD患者长期总体死亡率、发生肝移植和肝脏相关并发症的独立危险因素[6],也有研究关注到NAFLD与心血管疾病危险因素间的关系,如代谢综合征、血脂异常、糖尿病、高血压、肥胖等[7-10],而少有研究关注到NAFLD患者合并肝纤维化与心血管疾病危险因素的关系。目前,基于肝脏瞬时弹性成像技术(TE)的Fibroscan可通过测定弹性剪切波在组织内的传播速度快速检测肝脏硬度值(LSM),从而判断肝纤维化的程度[11],而受控衰减参数(CAP)可用于评估患者肝脏脂肪变性程度[12]。这两种检测方法因经济和便捷在临床得到了广泛的开展。本研究拟调查NAFLD患者中合并肝纤维化与心血管疾病常见危险因素的关系,为NAFLD患者心血管疾病风险评估提供依据。
对象与方法
1.对象:回顾性纳入2019年1月~2020年7月于我院就诊的NAFLD患者545例,其中男259例(47.5%),女286例(52.5%),年龄18~73岁,平均年龄(42.30±12.08)岁。纳入标准:(1)年龄≥18岁;(2)经Fibroscan检测CAP≥290 db/m。排除标准:(1)有大量饮酒史;(2)合并HBV,丙型肝炎病毒(HCV)或HIV感染;(3)合并肝细胞癌或其他恶性肿瘤;(4)妊娠;(5)临床资料缺失。根据是否合并肝纤维化将545例患者分为合并肝纤维化组(92例,16.9%)及无肝纤维化组(453组)。本研究已通过我院伦理委员会审核批准。
2.方法:收集患者的临床资料,包括年龄、性别、吸烟史、饮酒史、BMI、血脂[甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)]、肝功能(ALT、AST)、高血压病及糖尿病病史。诊断标准:脂肪肝:经Fibroscan检测CAP≥290 db/m[13-14];肝纤维化:经Fibroscan检测LSM≥8.2 Kpa;糖尿病:有糖尿病病史或空腹血糖≥7.0 mmol/L;高血压病:有高血压病病史或收缩压≥140 mmHg和(或)舒张压≥90 mmHg;HDL-C血症:HDL-C≤1.0 mmol/L;肥胖:BMI≥28.0 kg/m2。
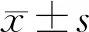
结 果
1.两组患者的临床资料比较:合并肝纤维化组年龄、HDL-C水平、BMI、高血压病及糖尿病病史患者比例均高于无肝纤维化组,TC水平低于无肝纤维化组(P<0.05)。见表1。

表1 两组患者的临床资料比较
2.NAFLD患者肝纤维化与心血管疾病危险因素的logistic回归分析结果:将心血管疾病的危险因素(肥胖、低HDL-C血症、高血压病、糖尿病)分别作为因变量,将有无合并肝纤维化作为二分类自变量与多变量(MV,包括年龄、性别、ALT、AST、吸烟史、高血压病、糖尿病、低HDL-C血症),模型采用BMI或CAP进行校正,结果显示,肝纤维化是NAFLD患者肥胖、低HDL-C血症、高血压病及糖尿病的独立危险因素(P<0.05)。引入BMI或CAP进行校正后OR值均有所下降,但显著性依然存在。见表2。
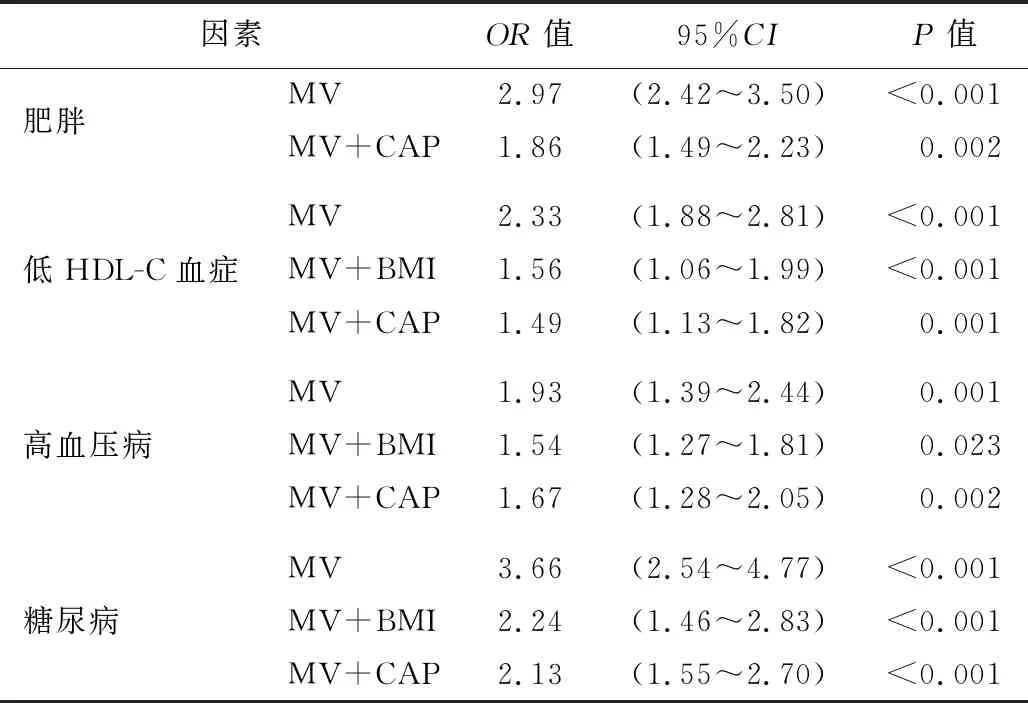
表2 NAFLD患者肝纤维化与心血管疾病危险因素的logistic回归分析结果
讨 论
本研究中NAFLD合并肝纤维化的发生率为16.9%,较既往文献报道的发生率偏高[15-16]。本研究发现,合并肝纤维与NAFLD患者肥胖、低HDL-C血症、合并高血压病及糖尿病相关,而这些关联性容易被肝脂肪变及肥胖混淆,当我们将CAP及BMI纳入到多变量模型后,关联程度有所下降但依然存在。
对于本研究结果有以下几种可能的解释。肝纤维化与心血管疾病危险因素的关联可能是双向且复杂的。肝脏在慢性炎症、损伤和修复中发生了肝纤维化,而慢性炎症可引起促炎转录因子[如核因子(NF)-κB]的慢性激活,并导致胰岛素抵抗的进一步加重[17]。而胰岛素抵抗可能会削弱胰岛素抑制脂肪分解的能力,从而增加肝脏游离脂肪的输送,进而促进肝脏脂肪和纤维化的发展[18]。“二次打击”学说是NAFLD发病机制中的经典学说,慢性炎症可诱导肝细胞出现氧化应激反应,而肝细胞氧化应激尤其是线粒体内氧化应激在NAFLD进展过程起着重要最用,从慢性炎症、氧化应激反应机制下进展为NAFLD、非酒精性脂肪性肝炎甚至肝纤维化,而慢性炎症反应及氧化应激同样也可刺激诱导血管壁内皮增生、动脉粥样硬化斑块形成、血管腔变窄、外周血管阻力增加,导致高血压病。此外,肥胖等心血管疾病的危险因素也可诱导肝纤维化,这种关系亦可由其他因素介导,如肥胖可引起血糖稳态的失衡,进而导致肝纤维化。
而在本研究中,肝纤维化患者的TC水平却偏低,这可能是因为由于他汀类药物的使用可降低肝内血管阻力从而减缓了肝纤维化的发展[19]。欧洲的一项多中心研究报道,经肝组织病理学观察证实,他汀类药物可降低肝脂肪变性及中重度肝纤维化的发生风险,但Patatin样磷脂酶域蛋白31148M基因突变可影响此保护效应[20]。
本研究也存在一定的局限性,首先,本研究纳入的人群是经Fibroscan检查筛查出的NAFLD患者,在人群的选择上有一定的偏倚性,这也可解释本研究结果中肝纤维化的发生率高于既往文献报道的原因;其次,经Fibroscan检查CAP≥290 db/m并不是诊断NAFLD的金标准,但由于临床病理标本难以获得及CAP检查的便捷和较好的一致性,使得其在临床对NAFLD患者进行筛查成为可能。作为横断面研究,本研究结论并不能证明NAFLD患者肝纤维化与心血管疾病的危险因素存在因果关系,但我们发现的两者之间的相关性应引起临床医生及患者的重视。
总而言之,NAFLD患者合并肝纤维化与肥胖、低HDL-C血症、高血压病及糖尿病相关,经BMI及CAP校正后关联依然存在,这一发现应引起重视。NAFLD患者必要时需筛查肝纤维化程度,NAFLD合并肝纤维化的患者可能罹患心血管疾病的风险增加,而其机制需要更多的前瞻性及基础研究进一步证实。

