基于DNA模板的荧光铜纳米粒子研究进展
周帅龙
(温州大学,浙江 温州 325035)
荧光分析法是一种常用的物质定性和定量分析方法,它具有灵敏度高、选择性强、方法简单等优点,常用于各种物质的检测分析中[1]。在诸多荧光材料中,金属荧光纳米材料在近年来广受关注。金属荧光金属纳米粒子是由贵金属(Au、Ag、Cu等)与生物分子(DNA、蛋白质等)为原料合成的新型荧光金属纳米材料,具有突出的生物相容性[2-5]。另外此类荧光纳米材料具有超大Stokes位移特性,能够避免生物物质自荧光干扰,因此在环境检测分析、生物传感方面极具竞争力[6-9]。
荧光金属纳米粒子是原子和大型纳米颗粒之间的中间过渡态,在溶液中一般不能稳定存在。为了降低巨大的表面能,小型的纳米粒子倾向于聚集成更大的颗粒,从而导致荧光性质发生变化[10]。因此,需要一个合适的支架或模板以抑制其聚集,这些模板是一些对金属离子具有高亲和力的阴离子和螯合配体,如硫醇、聚合物、DNA、蛋白质等。
在荧光金属纳米材料的各种模板中,DNA因其独特的结构而成为最优秀的模板之一。与其他模板相比,以DNA为模板具有一系列显著的优势:DNA的序列可编程,荧光金属纳米材料的种类和特征可随DNA模板序列和结构的变化而变化;DNA分子通过与其他单元(如—SH、—NH2等有机基团、互补序列、适配体、DNA酶等)结合,在功能修饰方面具有优越的灵活性,也使得荧光纳米粒子的应用更加多样化;以DNA为模板合成方法简便,条件温和。将制备好的 DNA/金属离子配合物与适当的还原剂在室温下反应几分钟到几小时即可完成的合成。此外,DNA是一种生物大分子,具有良好的生物相容性和水溶性,这使得DNA模板化合成荧光金属纳米材料在生化传感方面具有巨大的潜在应用价值[11-13]。
目前,已验证DNA碱基中的氮可以与许多金属离子配位:Ag+结合位点为嘧啶上的N3和嘌呤上的N7,Au3+与腺嘌呤上的 N7有较高的亲和力,Cu2+能与胸腺嘧啶上的N3结合。DNA与金属离子形成DNA-金属离子复合物后,特定还原剂将金属离子还原成金属原子并聚集形成荧光金属纳米粒子[14-16]。DNA核苷和金属配位位点的化学结构及DNA-荧光纳米粒子合成示意图如图1所示。
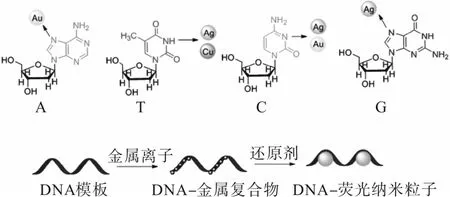
图1 DNA核苷和主要金属配位位点的化学结构及DNA-荧光纳米粒子合成示意图
1 DNA-荧光铜纳米粒子合成与应用
截至目前,已报道了各种不同性质的 DNA-荧光金属纳米粒子,如金、银、铜纳米粒子。与金、银相比,铜的化学性质更活泼(φᶿ[AuCl4]-/Au为1.002 V、φᶿ(Ag+/Ag) 为 0.799 V,φᶿ(Cu2+/Cu) 为0.339 V),因此CuNPs更容易被氧化。所以,荧光铜纳米粒子的合成更为严谨,其荧光也相对不稳定。但是,CuNPs的荧光发射中有一个超大Stokes位移(~270 nm),且其强度与DNA模板的长度成正比。此外,由于铜作为生命系统的微量营养元素,铜纳米材料比其他重金属纳米材料具有更强的生物相容性和环境友好性。因此,DNA-荧光铜纳米粒子作为一种原位合成的纳米探针在生物传感器的开发中具有广阔的应用前景[17]。
2010年,MOKHIR[18]小组首次报道了 dsDNA可以模板化形成荧光铜纳米粒子。Cu2+与硬 Lewis碱(氧原子)或中Lewis碱(氮原子)结合后Cu2+被还原为Cu+,随后Cu+通过歧化反应在dsDNA上生成Cu0,进而生长成为CuNPs(λex为340 nm、λem为605 nm)。另外,他们还发现纳米颗粒的大小与DNA模板中的碱基对数量成正比,而作为对照组的ssDNA与肽核酸(PNA)/DNA双链是完全无效的。于是他们推断:CuNPs的主要成核位点在dsDNA双链间的凹槽之间;电荷的多少也非常重要,电荷较多的dsDNA更容易引起纳米粒子的成核与生长。Cu2+以DNA双链为模板合成CuNPs示意图如图2所示。
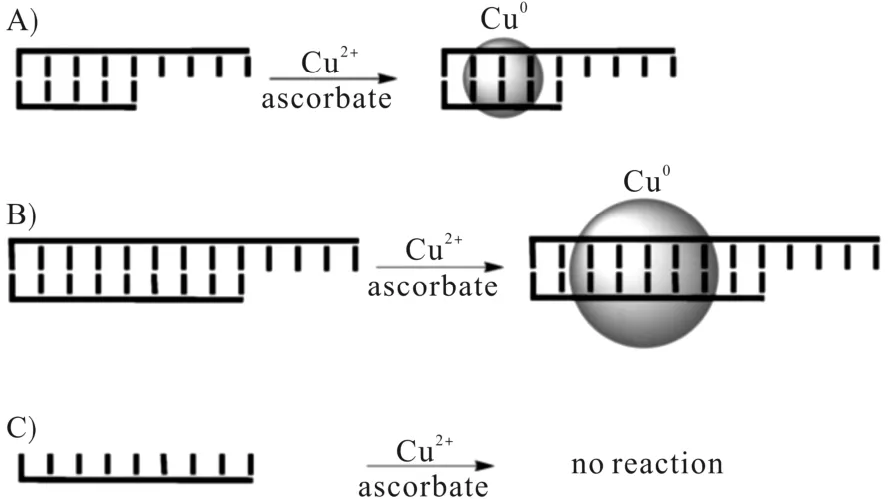
图2 Cu2+以DNA双链为模板合成CuNPs示意图
2013年,WANG 课题组发现聚T-ssDNA同样可以有效合成 CuNPs (λex=340nm、λem=615nm),且纳米粒子的尺寸与 ssDNA中碱基 T的聚合度成正比。研究中发现,只有聚T-ssDNA能够有效合成荧光铜纳米材料,而聚 A、G、C-ssDNA则不行,这是由于只有T碱基才能与Cu2+特异性结合并还原为Cu0,然后沿着聚T-ssDNA模板进一步成核生长[19]。
2014年,同样是WANG课题组以特异性的聚(AT-TA)-dsDNA 为模板用于合成了 CuNPs (λex为590 nm、λem为 340 nm),且其荧光强度不仅与聚(AT-TA)-dsDNA的长度成正比,而且与序列中 AT的聚合度成正比[20]。
然而,CuNPs光稳定性较差,这使其在应用中存在巨大障碍。为了克服这一缺陷,2014年WANG等引入了 DNA滚动循环复制(RCR)技术[21]。该技术可以产生长ssDNA,其中包含数千个周期性复制的圆形模板。通过引入互补 DNA,使得串联dsDNA用于形成串联dsDNA-CuNPs,这极大地增强了CuNPs的稳定性。因为通过引入大量无关ssDNA可以消耗大量的·OH,而且随着DNA模板浓度的增加,CuNPs的荧光强度会增强。
CuNPs的形成高度依赖于DNA的长度,其荧光发射信号与DNA模板的长度成正比,这为生物传感器的开发提供了一种可行的策略。2013年,WANG运用该策略开发了一种用于核酸酶检测的无标记荧光方法[22]。其中,聚T-DNA序列(T30)在无核酸酶的情况下保持长链状态,可以有效地合成CuNPs。在核酸酶存在下,T30被酶切成单核苷酸或寡核苷酸片段,因此荧光减弱。最终此策略实现了对核酸酶的选择性高灵敏检测,如图3所示。

图3 DNA-CuNPs生物传感器用于核酸酶检测
2017年,OUYANG[23]课题组在聚T-DNA序列3’端设计了一个 ATP适配体(富 G-DNA序列)。当ATP存在时适配体形成G-四链体结构,有效地阻碍适体衍生的寡核苷酸的消化,5’端的聚T-DNA序列可以作为模板合成 CuNPs。而当无 ATP时,DNA长链被消解为短链,则无法形成CuNPs。最终,以此建立起了一种简便的用于检测ATP浓度的方法。
2021年,LI[24]等报道了一种简单的酶和无标记荧光生物传感器定量检测miRNA。DNA检测探头包含聚T-DNA序列(T20)、目标分子检测DNA序列及聚G-DNA序列。首先,DNA片段以柔韧的ssDNA形式存在,导致 PET过程中 G/hemin配合物与DNA/CuNPs之间的长度相对较短,导致了较高的荧光猝灭效率。与目标 miRNA混合后,柔性 ssDNA的检测片段转变为刚性双链,导致电子供体到受体的空间增大,从而导致荧光发光。
2021年,WANG[25]又报道了一种以DNA为模板合成的具有聚集诱导发射增强(AIEE)特性的铜纳米组装体(CuNASs)。该DNA树枝状分子CuNASs在血清中表现出良好的稳定性,并可被 Pb2+快速猝灭,以此可实现对 Pb2+离子的高灵敏度选择性荧光检测。
2 结语
近年来,荧光金属纳米材料因其独特的物理化学性质和在生物传感、生物医学等领域的潜在应用,引起了人们的极大兴趣[26-31]。在诸多荧光纳米材料研究中,以DNA为模板合成CuNPs在生物传感器的开发中具有明显的优势:制备效率高、操作简单、合成动力学速度快;荧光性能好,如红色发射,超大Stokes位移;环境友好、生物安全;易于与其他功能单元集成,实现多功能应用[32-34]。但是,尽管基于DNA合成CuNPs的生物传感器的研究在近年来取得了显著的进展,但这一研究领域仍处于早期阶段,仍有很大的研究和改进空间。如在基础方面,虽然已有一些关于DNA模板化合成CuNPs的成功案例,但对此机理的研究还不够透彻。另外在应用方面,CuNPs的光稳定性比较脆弱,容易发生氧化,需要通过精心控制实验条件、合理操纵微环境等策略来提高其稳定性。对此,还需要众多科研工作者进一步努力探索,使 DNA-CuNPs在生物传感、医药等领域发挥更大的价值。

