60Co γ射线照射对人脐静脉内皮细胞线粒体结构和功能的影响
闫凯欣,赵亚伟,王溢豪,易 静,段 晗,陶 宁,王 华,,胡舜英
(1.解放军总医院心血管病医学部,北京 100853;2.军事科学院军事医学研究院辐射医学研究所,北京 100850;3.安徽医科大学生命科学学院,安徽 合肥 230032)
放射性心脏病(radiation-induced heart disease,RIHD)是临近心脏的胸部肿瘤放疗时,射线损伤心脏所产生的迟发性心脏并发症[1]。近年来,对于与纵膈放疗相关的心血管并发症的研究发现,相比无放疗史的患者,有纵隔放疗史的患者的冠心病发生率更高,对RIHD长期发展的影响更大[2]。临床研究显示,纵隔淋巴瘤、乳腺癌、肺癌和食管癌患者在接受局部放疗后多年诱发心脏毒性的风险明显增加,且产生的心脏毒性均与RIHD的发生有关[3-4]。但是,放射治疗是癌症治疗一种重要的手段,通过放疗可提高许多癌症患者的生存率,为改善肿瘤患者的长期预后,需高度重视放疗所带来的RIHD并发症,深入研究RIHD发病机制具有重要临床意义[5]。
相比于心脏组织中其他类型的细胞,血管内皮细胞对于辐射更为敏感[6]。目前认为,RIHD的发病机制主要在于射线对于血管内皮细胞的损伤,从而导致冠脉受损[7]。研究发现,大鼠接受20 Gy射线心脏局部照射,在照射后120 d,照射组大鼠心肌微循环灌注较未照射组显著下降[7]。但血管内皮细胞的放射损伤机制仍未完全阐明[8]。放射生物学的经典理论认为,射线导致DNA损伤是机体放射损伤的主要机制[9],而有研究显示,射线导致细胞中线粒体代谢障碍在放射损伤的发病机制中可能亦起着重要作用[3]。
当细胞受到放射、化疗药物和缺氧等外部刺激时,线粒体作为一种调节生物能量和生物合成途径中的重要细胞器,可快速调节自身功能以满足细胞的代谢需求[12]。线粒体功能状态与线粒体膜电位、线粒体膜通道孔、活性氧(reactive oxygen species,ROS)生成和线粒体分裂等变化密切相关[13],健康的线粒体网络对于心血管功能至关重要[14]。本研究通过60Co γ射线照射人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC),观察线粒体功能和线粒体结构,尤其是线粒体分裂及相关蛋白的变化,探讨60Co γ射线照射对HUVEC线粒体结构和功能的影响。
1 材料与方法
1.1 细胞、试剂和仪器
HUVEC,美国菌种保藏中心。DMEM培养基、ROS检测试剂盒,美国Thermo公司;胎牛血清,美国Gemini公司;RIPA裂解液和线粒体膜电位(mitochondrial membrane potential,MMP)(ΔΨm)检测试剂盒,碧云天公司;细胞线粒体膜通道孔(mitochondrial permeability transition pore,mPTP)检测试剂盒,上海杰美基因公司;APC-Annexin V/PI凋亡检测试剂盒,美国Biogens公司;一抗:β肌动蛋白单抗,美国Proteintech公司;兔抗大鼠磷酸化动力相关蛋白1(power-related protein1,DRP1)和磷酸化线粒体分裂因子(mitochodrial division factor,MFF)单抗,基因集团基因生物技术国际贸易(上海)有限公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG抗体(二抗),北京中杉金桥公司;ECL发光液,北京庄盟公司。Power-Pac164-5050电泳仪,美国Bio-Rad公司;BD FACSCalibur流式细胞仪,美国BD公司;X-Light V3转盘共聚焦,意大利CrestOptics公司;7500Fast实时荧光定量PCR系统,美国ABI公司;Tanon5200全自动化学发光成像仪,上海天能公司;VarioskanFlash光谱扫描多功能读数仪,美国Thermo公司;60Co γ射线辐照装置由军事医学研究院辐射医学研究所提供,单次照射剂量率为64.46 cGy·min-1。
1.2 HUVEC培养和传代
以含有10%胎牛血清与1%HEPES液的低糖DMEM为HUVEC的培养基,置37℃,5%CO2的恒温细胞培养箱中培养,隔2 d换液,待细胞生长至80%~90%融合度时传代,传代比例为1∶3。
1.3 HUVEC分组处理
将生长状态良好的HUVEC细胞以3×106L-1的密度接种于6孔板内(每孔2 mL)置37℃,5%CO2的恒温细胞培养箱中培养24 h使细胞均匀贴壁后,分别进行5,10和20 Gy60Co γ射线照射,同时设未照射细胞为细胞对照组,①照射后24和48 h进行相关检测或②照射后48 h进行相关检测。
1.4 细胞形态观察
利用显微镜观察1.3分组①处理的细胞,观察细胞形态、数量并拍照记录。
1.5 流式细胞术检测HUVEC凋亡率
收集1.3分组①处理的细胞用不含EDTA的胰酶消化贴壁的HUVEC细胞,300×g离心5 min,收集细胞后用磷酸盐缓冲液漂洗2次。加5 μL APCAnnexinⅤ混匀,室温避光孵育15 min;再加入PI细胞核染料5 μL混匀,室温避光孵育10 min。洗涤后加入PBS 400 μL重悬细胞,用流式细胞仪检测并分析细胞凋亡率〔早期凋亡细胞(APC+PI-)和晚期凋亡或坏死细胞(APC+PI+)〕。
1.6 化学荧光染色法检测HUVEC中ROS水平
取1.3分组①处理的细胞,弃细胞培养上清,更换2 mL不含血清的DMEM培养基,每孔加入2 μL H2DCFDA 探针 10 mmol·L-1,使探针终浓度为 10 μmol·L-1,孵育 30 min。孵育结束后用 PBS漂洗3次,在激光共聚焦显微镜下随机选取细胞分布均匀部位,观察贴壁细胞,进行定性分析。绿色荧光强度表示ROS水平。
1.7 流式细胞术和化学荧光染色法检测HUVEC线粒体膜电位
1.7.1 流式细胞术
将试剂盒中的 CCCP(10 mmol·L-1)按照 1∶1000的比例加入到细胞培养液中,稀释至10 μmol·L-1,处理细胞 20 min 作为阳性对照。JC-1单体的最大激发波长为514 nm,最大发射波长为529 nm;JC-1聚合物的最大激发波长为585 nm,最大发射波长为590 nm。
取1.3分组①处理的细胞,胰酶消化细胞,离心弃上清,用PBS漂洗1次,加培养基500 μL重悬细胞;再加染色工作液500 μL,混匀置培养箱避光孵育20 min;4℃,300×g离心5 min,弃上清,用预冷1×缓冲液漂洗2次;1×缓冲液500 μL重悬细胞,流式细胞仪检测HUVEC细胞中红色荧光细胞百分比,定量MMP。
1.7.2 化学荧光染色法
取1.3分组①处理的细胞,按线粒体膜电位化学荧光染色法检测试剂盒操作说明操作。吸弃细胞培养上清,加新鲜细胞培养液1 mL和JC-1染色工作液0.5 mL,充分混匀,孵育20 min;孵育结束后吸弃上清,用预冷1×JC-1缓冲液洗涤2次,加细胞培养液1 mL,在激光共聚焦显微镜下随机选取细胞分布均匀部位,观察贴壁细胞,进行定性分析。以红色荧光与绿色荧光比值定量MMP(ΔΨm)。
1.8 化学荧光染色法检测HUVEC细胞线粒体膜通道孔开放状态
取1.3分组①处理的细胞,按mPTP检测试剂盒操作说明操作。小心吸弃细胞培养上清,加37℃预热的清理液0.5 mL清洗1次,再加染色工作液0.5 mL,充分混匀,置培养箱37℃避光孵育20 min,孵育结束后吸弃染色工作液,用预热的清理液清洗2次,在激光共聚焦显微镜下随机选取细胞分布均匀部位,观察贴壁细胞,进行mPTP开放定性分析。绿色荧光减弱表明mPTP活性增强、开放增加。
1.9 透射电镜观察HUVEC细胞线粒体结构
取1.3分组②处理的细胞,软毛刷轻轻刮下细胞,用2.5%戊二醛2%多聚甲醛混合固定液4℃固定过夜后,吸弃废液,用磷酸盐缓冲液(PBS)(0.1 mol·L-1,pH 7.4)洗3次;1%四氧化锇(OsO4)常温下固定1 h;回收 OSO4废液;再次用 PBS(0.1 mol·L-1,pH 7.4)洗涤3次,每次10 min;梯度乙醇脱水后,分别用3∶1,1∶1的丙酮和环氧树脂进行样本浸透。置烘箱60℃聚合24 h。用ImageJ软件计算线粒体个数,并测量周长和面积。
1.10 Western印迹法检测HUVEC中p-Drp1和p-Mff蛋白表达水平
取1.3分组②处理的细胞,用RIPA裂解液裂解,10 000×g,4℃离心10 min,吸取上清液。BCA法测定蛋白质浓度,调整各组蛋白质浓度,以4∶1体积比加入5×上样缓冲液混匀,100℃煮10 min。将提取的蛋白质进行聚丙烯酰胺凝胶电泳,上样量为20 μg,分离后转至PVDF膜,5%脱脂奶粉室温封闭2 h。加入一抗(抗p-Drp1和p-Mff抗体,稀释比均为1∶2000),4℃孵育过夜。TBS-T清洗4次,每次5 min。随后加HRP标记山羊抗兔IgG抗体(二抗)(1∶5000),室温孵育1 h,TBS-T洗膜4次,每次5 min。以β肌动蛋白作为内参对照。发光、显影、扫描后分析蛋白条带积分吸光度(integrated absorbance,IA),用目标蛋白与内参蛋白IA比值表示目标蛋白相对表达水平。
1.11 统计学分析
实验结果数据用±s表示,应用GraphPad-Prism7进行统计学分析,组间比较采用单因素方差分析和正态分布t检验分析。P<0.05为差异具有统计学意义。
2 结果
2.1 60Co γ射线照射对HUVEC细胞形态的影响
形态观察结果显示,HUVEC细胞经60Co γ射线照射后24和48 h,细胞对照组(0 Gy)生长状态均良好,细胞数量多,细胞延展性较好,贴壁牢固,折光性好;而5,10和20 Gy照射组,随照射剂量增加,HUVEC细胞数量逐渐减少,且细胞均有不同程度变小、皱缩,贴壁不牢固(图1)。

Fig.1 Effect of60Co γ-ray irradiation on human umbilical vein endothelial cells(HUVECs)morphology at 24 and 48 h post-irradiation under microscope.
2.2 60Co γ射线照射对HUVEC细胞凋亡的影响
流式结果显示,60Co γ射线照射后24和48 h,与细胞对照组相比,5,10和20 Gy组HUVEC细胞凋亡率均增加(P<0.01)(图2)。

Fig.2 Effect of60Co γ-ray irradiation on apoptosis of HUVECs evaluated by flow cytometry.A2 and B2 were the quantitative results of A1(24 h)and B1(48 h),respectively.±s,n=3.**P<0.01,compared with 0 Gy(cell control)group.
2.3 60Co γ射线照射对HUVEC中ROS水平的影响
荧光染色结果显示,60Co γ射线照射后24和48 h,与细胞对照组相比,5,10和20 Gy组HUVEC绿色荧光强度明显增加(P<0.05,P<0.01),表明60Co γ射线照射导致ROS产生增加(图3)。
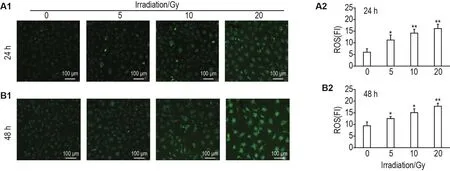
Fig.3 Effect of60Co γ-ray irradiation on reactive oxygen species(ROS)production in HUVECs by laser confocal fluorescence imaging.A2 and B2 were the semi-quantitative results of A1(24 h)and B1(48 h),respectively.FI:fluorence intensity.±s,n=3.*P<0.05,**P<0.01,compared with cell control group.
2.4 60Co γ射线照射对HUVEC线粒体膜电位的影响
流式细胞术结果显示,60Co γ射线照射后24和48 h,与细胞对照组相比,5,10和20 Gy组HUVEC红色荧光细胞比例显著降低(P<0.01)(图4),表明线粒体膜电位下降。
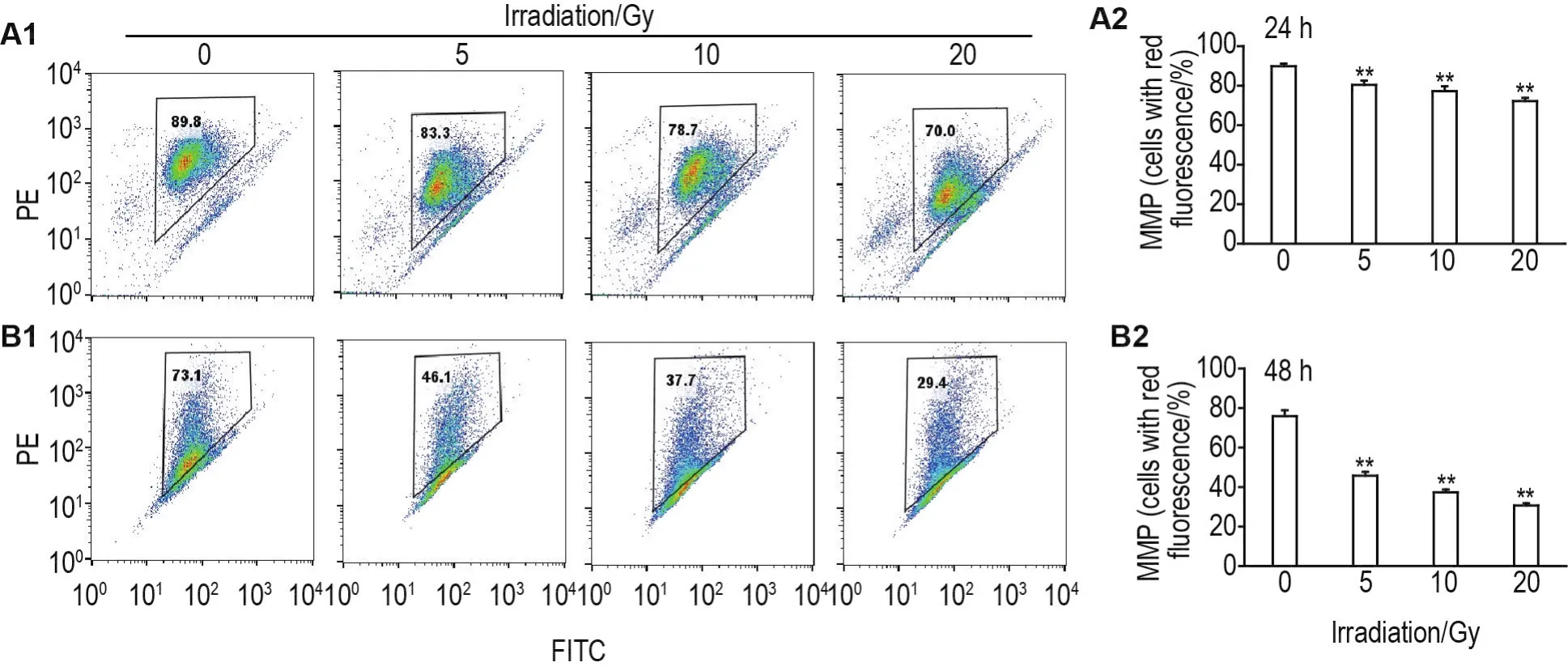
Fig.4 Effect of60Co γ-ray irradiation on mitochondrial membrane potential(MMP)in HUVECs by flow cytometry.A2 and B2 were the quantitative results of A1(24 h)and B1(48 h),respectively.±s,n=3.**P<0.01,compared with cell control group.
荧光共聚焦显微镜观察结果显示,60Co γ射线照射后24和48 h,与细胞对照组相比,5,10和20 Gy组HUVEC红色荧光与绿色荧光比值显著降低(P<0.01)(图5)。
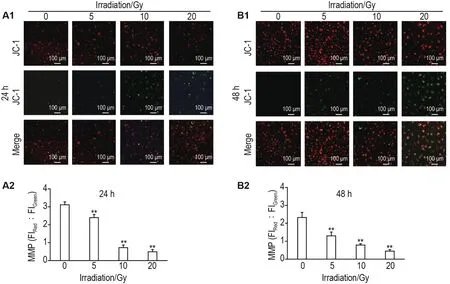
Fig.5 Effect of60Co γ-ray irradiation on MMP in HUVECs by laser confocal fluorescence imaging.A2 and B2 were the semi-quantitative results of A1(24 h)and B1(48 h),respectively.±s,n=3.**P<0.01,compared with cell control group.
2.5 60Co γ射线照射对HUVEC线粒体膜通道孔开放的影响
结果显示,60Co γ射线照射后24和48 h,与细胞对照组相比,5,10和20 Gy组HUVEC绿色荧光强度显著减弱(P<0.05,P<0.01)(图6),提示60Co γ射线照射导致HUVEC的mPTP开放程度提高。

Fig.6 Effect of60Co γ-ray irradiation on mitochondrial permeability transition pore(mPTP)opening in HUVECs by laser confocal fluorescence imaging.A2 and B2 were the semi-quantitative results of A1(24 h)and B1(48 h),respectively.±s,n=3.*P<0.05,**P<0.01,compared with cell control group.
2.6 60Co γ射线照射对HUVEC线粒体结构的影响
电镜观察线粒体结构结果显示,细胞对照组线粒体结构完整,线粒体脊保存完好。5,10和20 Gy照射组线粒体内部有不同程度的肿胀,线粒体内部结构破坏严重,特异性结构脊不清晰(图7A)。与细胞对照组相比,5,10和20 Gy组单个线粒体面积显著增加(P<0.05,P<0.01)(图7B1);10和20 Gy组单个线粒体周长增加(P<0.01)(图7B2);5,10和20 Gy组线粒体密度显著下降(P<0.05,P<0.01)(图7B3);5,10和20 Gy组异常线粒体比例显著增加(P<0.01)(图7B4)。
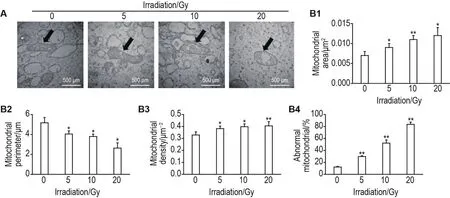
Fig.7 Effect of60Co γ-ray irradiation on mitochondrial morphology in HUVECs under transmission electron microscope.Arrows show the mitochondrial structure.B1,B2,B3 and B4 were the semi-quantitative results of A.±s,n=3.*P<0.05,**P<0.01,compared with cell control group.
2.7 60Co γ射线照射对HUVEC中p-Drp1和p-Mff蛋白表达水平的影响
Western印迹实验结果(图8)显示,与细胞对照组相比,5,10和20 Gy照射48 h组,p-Drp1和p-Mff蛋白表达水平均显著增加(P<0.05,P<0.01)。
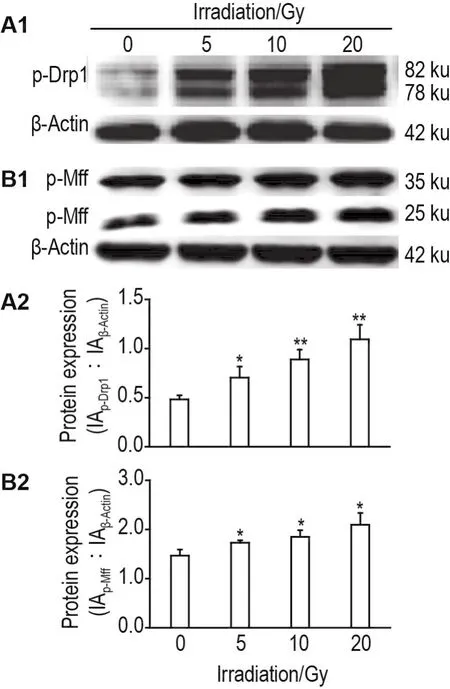
Fig.8 Effect of60Co γ-ray irradiation on levels of phosphorylated dynamin-related protein 1(p-Drp1)and p-mitochondrial fission factor(p-Mff)in HUVECs by Western blotting.HUVECs were radiated for 48 h.A2 and B2 were the semi-quantitative results of A1(p-Drp1)and B1(p-Mff),respectively.±s,n=3. *P<0.05,**P<0.01,compared with cell control group.
3 讨论
利用放射疗法治疗肿瘤是一种常见的治疗手段,但在放射治疗时,心脏被归属为放射不敏感器官,因而心脏的放射损伤并未得到应有的重视,而且放射治疗导致的心脏并发症多发生在患者进行放疗很多年以后,已经不在随访范围内[15]。而且,射线几乎可以对心脏的所有结构造成损伤,包括心脏瓣膜病、心包疾病、冠脉疾病、心肌病、传导系统疾病等[16],因此放射性心脏损伤的发生率有低估的可能。目前研究认为,内皮细胞是射线损伤的靶细胞,血管内皮细胞受损,会导致心脏循环障碍继发心肌细胞的变性及心肌纤维化[3]。本研究发现,60Co γ射线照射可对HUVEC造成损伤,加重线粒体分裂,导致显著的线粒体功能障碍,可能是放射性心脏损伤的重要机制之一。
本研究结果显示,HUVEC受到60Co γ射线照射后,细胞形态发生变化,细胞皱缩,贴壁不牢,细胞凋亡显著增多,同时活性氧生成增多,细胞功能受损;此外,线粒体膜电位下降、线粒体膜通道孔开放增加,显示放射诱导显著的线粒体功能障碍。线粒体是制造能量的细胞器,当线粒体功能受损后,细胞中能量生成减少,会进一步导致细胞功能障碍;而细胞功能受损,又会影响线粒体的正常功能。辐射对细胞损伤的早期作用,有可能是通过线粒体功能紊乱进行调节的。
本研究电镜结果显示,照射后HUVEC线粒体内部有不同程度的肿胀,内部结构破坏严重,特异性结构脊不清晰;线粒体密度明显下降,单个线粒体面积、单个线粒体周长和异常线粒体数量明显增加,显示线粒体结构严重受损。线粒体分裂在维持线粒体稳态,调节线粒体功能中发挥重要作用[17]。线粒体分裂是线粒体动态变化的重要特征之一[18],目前发现的介导线粒体分裂的主要蛋白分子包括位于细胞基质中的Drp1[19]。线粒体的表面受体,可以招募Drp1,从而使线粒体发生分裂[19],目前已知的受体包括 Mff,Fis1,MiD49 和 MiD51[20]。本研究结果显示,受照后HUVEC中线粒体相关分裂蛋白p-Drp1和p-Mff表达水平升高,表明60Co γ射线照射可以促进线粒体分裂相关蛋白的表达,加重了线粒体分裂。
本研究结果显示,60Co γ射线照射促进HUVEC凋亡,ROS生成增多,MMP下降、mPTP开放增加,诱发了线粒体功能障碍;电镜检测发现,60Co γ射线照射显著加重HUVEC线粒体结构损伤,线粒体分裂相关蛋白表达增多,促进线粒体分裂。提示放射诱导的线粒体结构和功能障碍可能是血管内皮细胞放射损伤的重要机制,放射诱导的线粒体分裂可能在其中起着重要作用。但本研究仍有很多不足之处,需要进一步通过体内实验得以验证;辐射诱导的线粒体分裂相关蛋白变化是如何调控线粒体分裂以及线粒体功能功能,具体机制仍需进一步探讨。

