线粒体钙离子单向转运体对脑胶质瘤干细胞增殖和自我更新的影响
李 琳,陈佳意,韩秋影,李爱玲,满江红,潘 欣
(国家生物医学分析中心,北京 100850)
脑胶质瘤源自神经上皮,是最常见的颅内恶性肿瘤之一,约占脑肿瘤的1/2。据病理学特征其可分类为星形细胞瘤、髓母细胞瘤、多形性胶质母细胞瘤、室管膜瘤和少突胶质母细胞瘤等,其中多形性胶质母细胞瘤是胶质瘤中恶性程度最高的一类肿瘤,患者平均生存周期仅为12~15个月[1-2]。最常用的治疗方法是手术切除结合放化疗,但疗效很不理想[3]。脑胶质瘤干细胞(glioma stem cells,GSC)是肿瘤中一类具有自我更新、多向分化潜能和肿瘤形成能力的细胞。越来越多的研究表明,GSC使肿瘤抵抗放疗和化疗,最终导致癌症复发[4-7]。
2011年,2个研究团队同时发现CCDC109A基因编码线粒体钙离子单向转运体(mitochondrial calcium uniporter,MCU)[8-9]。MCU是一类位于线粒体内膜分子质量约35 ku的蛋白,控制钙离子进入线粒体,是细胞能量代谢、产生活性氧和诱导细胞凋亡的主要介质[10-11],目前认为其与肿瘤生长和转移相关。据报道,受体相互作用蛋白激酶1可通过MCU促进结肠癌能量代谢,最终促进肿瘤发展[12]。MCU通过低氧诱导因子1α影响血管内皮生长因子表达,促进乳腺癌细胞的侵袭和迁移[13]。MCU还可通过抑制烟酰胺腺嘌呤二核苷酸/去乙酰化酶3/超氧化物歧化酶2通路促进活性氧的产生,从而促进肝癌细胞的侵袭和迁移[14]。
多形性胶质母细胞瘤在脑胶质瘤中恶性程度最高,手术切除结合放化疗的疗效并不理想,原因之一是其中的GSC对放化疗不敏感,且具有无限增殖和自我更新的能力,能促使肿瘤发展[3-7]。因此,研究调控脑GSC对抑制脑胶质瘤发生发展及治疗提供了新策略。线粒体离子通道是新发现的肿瘤靶点,能够调节肿瘤的生长和进展[15]。已有研究报道,线粒体钙离子吸收与乳腺癌、肝癌、结肠癌和胰腺癌等发展密切相关,提示靶向MCU可能是抑制肿瘤的新策略。但MCU在胶质瘤以及肿瘤干细胞中的作用尚未阐明,且关于MCU介导的线粒体钙离子信号通路在癌症中的功能研究亦处于起步阶段。因此阐明MCU在胶质瘤发生发展中的作用,对于改善胶质瘤临床治疗效果具有重要意义。本研究观察MCU对脑GSC增殖和成瘤能力的影响,为探讨MCU作为脑胶质瘤潜在治疗靶点提供依据。
1 材料与方法
1.1 动物、细胞、试剂和仪器
BALB/c祼小鼠:北京维通利华实验动物技术有限公司,SPF级环境饲养。人脑GSC(T456,T4121,T387和 T3832)、人胶质瘤细胞(U87和U251)和人神经干细胞(16157),美国加州大学圣迭戈分校Jeremy Rich实验室;人星形胶质细胞(NHA),北京北纳创联生物科技有限公司;人胚胎肾细胞(HEK293T),中国科学院上海细胞库;大肠杆菌E.coliDH5α感受态细胞(BC102),中国博迈德基因技术有限公司;pCMV-VSVG质粒和PAX2质粒均由本实验室自制获得;兔抗人MCU多克隆抗体、细胞消化酶、Triton™X-100和抗β微管蛋白抗体,美国Sigma-Aldrich公司;辣根过氧化物酶标记山羊抗兔IgG抗体和山羊抗小鼠IgG抗体,优宁维生物公司;PowerUp SYBR Green Master Mix、神经细胞基础(neuro-basal)培养基和B-27血清替代物,美国Thermo Fisher公司;DMEM培养基、青/链霉素混合液、左旋谷氨酰胺、丙酮酸钠、胰蛋白酶和磷酸钙转染试剂盒,中国迈晨科技有限公司;胎牛血清,中国依科赛生物科技有限公司;5×PrimeScript RT Master Mix,日本TaKaRa公司;碱性成纤维生长因子(basic fibroblast growth factor,bFGF)和重组人表皮生长因子蛋白(recombinant human epidermal growth factor protein,rhEGF),美 国 R&D Systems公司;MCU抑制剂DS16570511,美国MedChemExpress公司;质粒提取试剂盒和Cell Titer-Glo®Luminescent细胞活力检测试剂盒,美国Promega公司。CO2恒温细胞培养箱(FORMA3111)和PCR仪(GSX1),美国Thermo Fisher Scientific公司;微量分光仪(NanoDrop2000c),中国基因有限公司;低温高速离心机(5424R),德国Eppendorf公司;Western电泳仪(164-5070),美国Bio-Rad公司。
1.2 细胞培养
T456,T4121,T387,T3832和16157细胞接种于干细胞完全培养基〔每500 mL neuro-basal培养基中加入B-27血清替代物10 mL,左旋谷氨酰胺5 mL,丙酮酸钠5 mL,青/链霉素双抗混合液5 mL及bFGF和rhEGF(终浓度均为10 μg·L-1)〕,U87,U251和NHA细胞接种于DMEM完全培养基(每500 mL DMEM培养基中加入胎牛血清50 mL和青/链霉素双抗混合液5 mL),置37℃,5%CO2恒温培养箱中培养。
1.3 MCU shRNA序列设计
在Public TRC Portal和Sigma网站中检索MCU基因,获得得分高且经过验证适用于pLKO.1载体的2个MCU短发夹RNA(short hairpin RNA,shRNA)干涉序列:MCU shRNA#1序列为5'-CCGGCAATCAACTCAAGGATGCAATCTCGAGATTGCATCCTTGAGTTGATTGTTTTTTG-3',MCU shRNA#2序列为5'-CCGGCCAGCAACTATACACCACACTCTCGAGAGTGTGGTGTATAGTTGCTGGTTTTTTG-3'。同时设shRNA干涉阴性对照(shNT)序列为5'-CCGGCGCTGAGTACTTCGAAATGTCCTCGAGGACATTTCGAAGTACTCAGCGTTTTTTG-3'。上述序列由北京天一辉远生物科技有限公司合成。
1.4 质粒载体构建
将1.3序列95℃退火,连接载体pLKO.1,构建shNT,shMCU#1和shMCU#2及LUC-shNT,LUC-shMCU#1和LUC-shMCU#2质粒。质粒与大肠杆菌E.coliDH5α感受态细胞混合,冰上静置30 min,然后热激;随后将菌液铺板,16 h后取单菌落提取质粒DNA测序鉴定。
1.5 含MCU shRNA慢病毒包装、制备和细胞感染
1.5.1 慢病毒包装和制备
直径10 cm培养皿中加入DMEM完全培养基10 mL,每皿接种HEK293T 2.5×106细胞培养12 h。按磷酸钙转染试剂盒说明书的方法制备质粒转染体系:HBS 1 mL,pCMV-VSVG质粒1.5 μg,PAX2质粒4.5 μg,CaCl2溶液67 mL,目的质粒(shNT,shMCU#1,shMCU#2,LUC-shNT,LUC-shMCU#1 或LUC-shMCU#2)6 μg。混匀静置15 min,将转染体系加入上述培养皿中,置37℃,5%CO2恒温培养箱中培养6 h。弃上清,换为干细胞完全培养基,继续培养至72 h,分别收集培养上清。上清于常温、7000×g离心5 min,再次收集上清,用0.45 μm孔径滤器过滤,获得shNT,shMCU#1和shMCU#2及LUC-shNT,LUC-shMCU#1或LUC-shMCU#2慢病毒,置-80℃冰箱保存待用。
1.5.2 细胞转染
向直径10 cm培养皿中加入干细胞完全培养基5 mL,接种消化处理好的 T387,T3832,T4121和T456细胞,密度约为2×109L-1。加入shNT,shMCU#1和shMCU#2慢病毒或LUC-shNT,LUC-shMCU#1和LUC-shMCU#2慢病毒5 mL,混匀。置37℃,5%CO2培养24 h后细胞传代,并加入嘌呤霉素(终浓度2 g·L-1)筛选48 h,得到成功感染shNT,shMCU#1和shMCU#2病毒的细胞,分别命名为shNT,shMCU#1和shMCU#2细胞;得到成功感染LUC-shNT,LUC-shMCU#1和LUC-shMCU#2病毒的细胞,分别命名为LUC-shNT,LUC-shMCU#1和LUC-shMCU#2细胞。
1.6 Western印迹法检测细胞中MCU蛋白表达
将4种脑GSC和2种胶质瘤细胞(U87和U251)吸至15 mL的离心管中,离心弃上清;加入生理盐水10 mL洗涤细胞,再离心弃上清;加入细胞消化酶2 mL消化3 min,加入氯化钠10 mL离心,收集细胞。将胶质瘤细胞U87和U251用胰蛋白酶消化成悬浮单细胞,转移至15 mL的离心管中离心,弃上清,收集细胞。使用实验室自配的RIPA裂解液裂解上述细胞收集蛋白质,经Bradford法进行蛋白质定量进行SDS-PAGE凝胶电泳,转印至PVDF膜,用5%牛奶封闭1 h,加入抗MCU抗体(稀释比例1∶1000)和抗β微管蛋白抗体(稀释比例1∶5000),4℃摇床孵育过夜。而后用辣根过氧化物酶标记山羊抗兔IgG抗体(1∶5000)室温孵育1 h后,加入Western发光检测液检测MCU蛋白条带。
1.7 RT-qPCR检测细胞MCU mRNA水平
Trizol法提取4种脑GSC、2种胶质瘤细胞(U87和U251)和转染病毒的4种脑GSC总RNA。逆转录体系总体积为10 μL。取总RNA 500 ng,加入5×PrimeScript RT Master Mix 2 μL,双蒸水补至10 μL,于PCR仪中37℃ 20 min,85℃ 15 s,逆转录为cDNA,再进行RT-qPCR检测。内参基因β肌动蛋白上游引物为(F)AGAAAATCTGGCACCACACC,下游引物为(R)AGAGGCGTACAGGGATAGCA;MCU上游引物(F)CCACCGGACGGTACACCA,下游引物(R)GTACCTTTTCCAGGGGA-GCC。反应条件:95℃ 10 min;95℃ 15 s,60℃ 60 s,40个循环。MCUmRNA表达水平用2-ΔΔCt表示。
1.8 CellTiter-Glo®Luminescent试剂盒检测细胞活力
用MCU抑制剂DS16570511处理脑GSC(T456和T4121)、人神经干细胞(16157)及人星形胶质细胞(NHA),分别设细胞对照(0.1%DMSO)组、DS16570511 25和50 μmol·L-1组,于培养第0,2,4和6天检测细胞活力,第6天观察形成肿瘤球的大小和细胞形态。
将成功转染shNT,shMCU#1和shMCU#2病毒的4种GSC及DS16570511处理的T387,T4121,16157和NHA细胞以每孔2000细胞加入96孔板,每孔加入所需培养基200 μL,每组设3复孔。将96孔板置37℃,5%CO2细胞培养箱中,分别在培养第0,2,4和6天加入细胞活力检测试剂100 μL,将96孔板置Glomax全自动荧光仪,检测各孔细胞荧光强度。细胞活力(%)=(实验组荧光强度-对照组荧光强度)/对照组荧光强度×100%
1.9 细胞形成肿瘤球的大小和数量检测
同1.8处理细胞,培养至第6天,用成像显微镜观察每组细胞肿瘤球大小,同时利用手动计数器记录每组细胞形成肿瘤球的数量。
1.10 裸小鼠颅内原位成瘤实验
将构建的T387-LUC-shNT,T387-LUC-shMCU#1和T387-LUC-shMCU#2细胞及T4121-LUC-shNT,T4121-LUC-shMCU#1和T4121-LUC-shMCU#2细胞分别处理成单细胞悬液,将5×104细胞注射至麻醉的BALB/c裸小鼠脑实质中,进针位置为:前卤点前1 mm,中线右1 mm。每组8只。接种25 d后,用IVIS活体成像系统对小鼠脑部进行生物发光检测,检测小鼠脑内移植瘤体积,并记录小鼠生存时间。
1.11 统计学分析
实验结果数据用±s表示。所有实验均重复至少3次,实验结果采用GraphPad Prism软件进行统计学分析,3组以上的比较使用单因素方差分析(one way ANOVA),组间两两比较应用t检验。细胞活力比较采用重复测量资料的方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 MCU在脑GSC和胶质瘤细胞中的表达
Western印迹实验结果(图1A)显示,与胶质瘤细胞 U87和 U251相比,T4121,T387,T3832和T456 4种脑GSC中MCU蛋白表达较高。RT-qPCR结果(图1B)显示,除T456细胞,上述3种脑GSC中MCUmRNA水平亦高于U87和U251(P<0.05,P<0.01)。
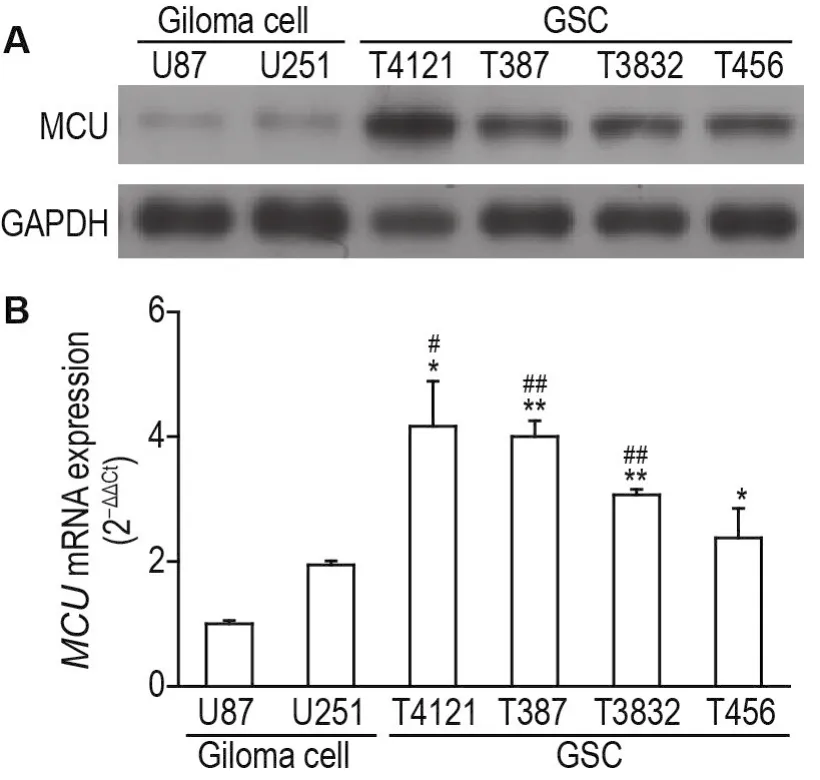
Fig.1 Expression of mitochondrial calcium uniporter(MCU) in brain glioma stem cells(GSCs)T456,T4121,T387 and T3832,and glioma cells U87 and U251 detected by Western blotting(A)and real timequantitative PCR(RT-qPCR)(B).-x±s,n=3.*P<0.05,**P<0.01,compared with U87 cells;#P<0.05,##P<0.01,compaired with U251 cells.
2.2 shRNA对4种脑GSC中MCU mRNA表达的敲低效果
图2结果显示,与shNT相比,分别转染shMCU#1和shMCU#2病毒4 d后,4种脑GSC中MCUmRNA水平均显著下降(P<0.01),其中T387-shMCU#1和T387-shMCU#2细胞下降至T387-shNT细胞的30.6%和33.8%,T4121-shMCU#1和T4121-shMCU#2细胞下降至T4121-shNT细胞的34.5%和35.1%,T3832-shMCU#1和T3832-shMCU#2细胞下降至T3832-shNT细胞的27.6%和22.0%,T456-shMCU#1和T456-shMCU#2细胞下降至T456-shNT细胞的32.3%和21.9%。
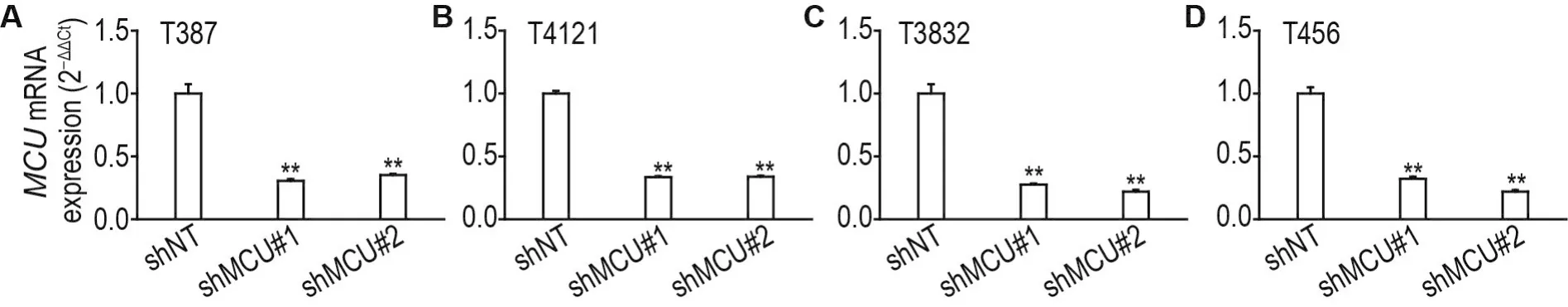
Fig.2 Knockdown effect of short hairpin RNA(shRNA)on mRNA levels of MCU in T387(A),T4121(B),T3832(C)and T456(D)cells by RT-qPCR.T387,T4121,T3832 and T456 cells were transfected with negative control shRNA(shNT),MCU-shRNA#1(shMCU#1)and MCU-shRNA#2(shMCU#2)for 96 h.±s,n=3.**P<0.01,compared with corresponding shNT group.
2.3 敲低MCU表达对脑GSC活力的影响
图3结果显示,培养至第6天,转染shMCU#1和 shMCU#2慢病毒的 T387,T4121,T3832和T456细胞较各自shNT组比较,细胞活力均明显降低(P<0.01),表明敲低MCU表达后脑GSC增殖被抑制。

Fig.3 Effect of MCU knockdown on viability of T387(A),T4121(B),T3832(C)and T456(D)cells.See Fig.2 for the cell transfection.The cells transfected by shRNA were seeded into 96-well plates with 2000 cells per well.Cell viability was detected using the CellTiter-Glo® luminescent cell viability assay.±s,n=3.**P<0.01,compared with corresponding shNT group.
2.4 敲低MCU表达对脑GSC形成肿瘤球大小和数量的影响
图4结果显示,培养至第6天,4种脑GSC分别转染shMCU#1和shMCU#2慢病毒后,其形成的肿瘤球较小,且数量较各自shNT组均显著减少(P<0.01),表明敲低MCU表达可影响GSC增殖和自我更新能力。
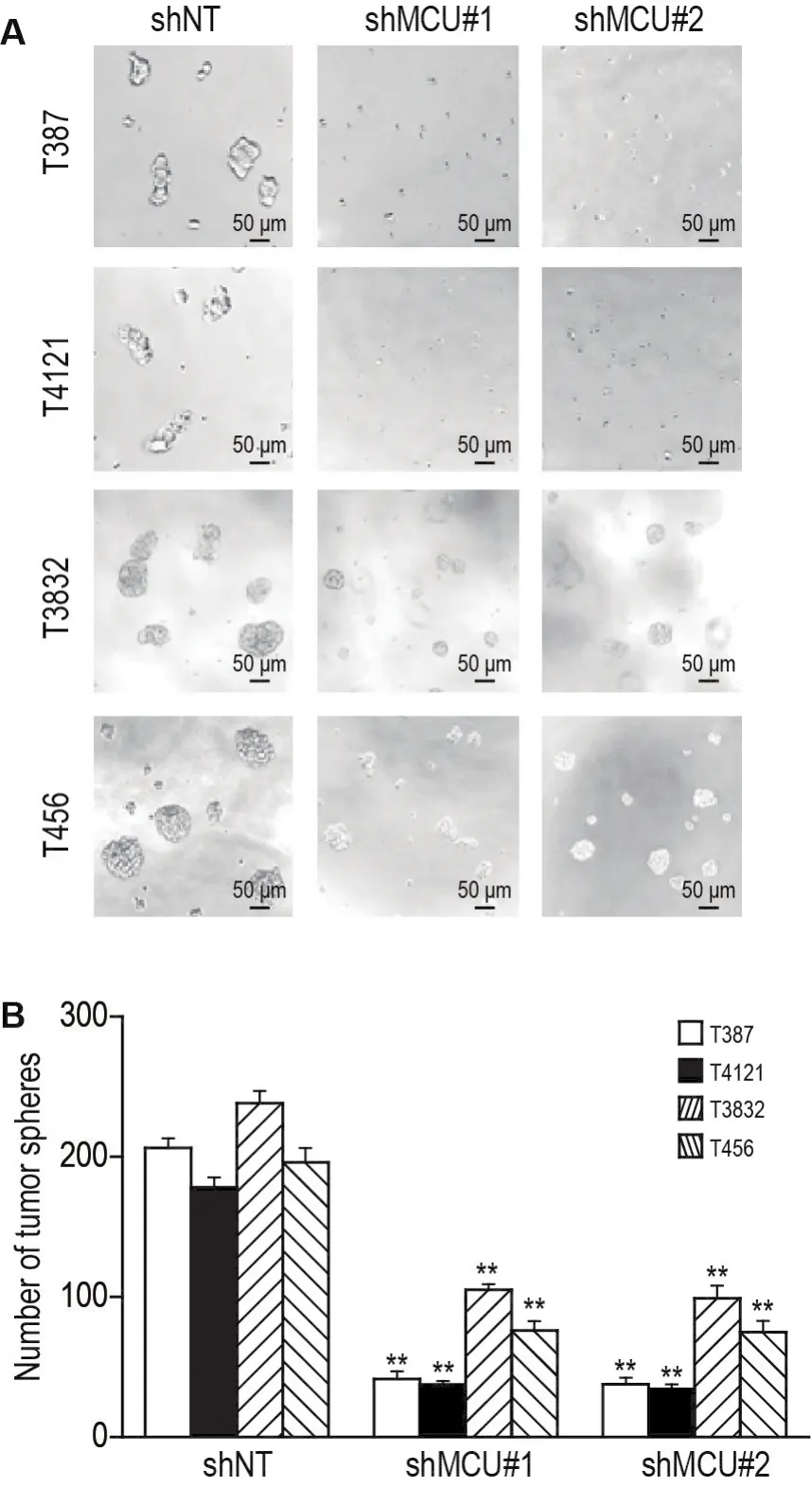
Fig.4 Effect of MCU knockdown on tumor sphere formation of T387,T4121,T3832 and T456 cells.See Fig.2 for the cell transfection.The formation of tumor spheres was observed on the 6thday after transfection.The morphology of tumor spheres(A)was photographed with an imaging microscope and the number of tumor spheres(B)was counted.±s,n=3.**P<0.01,compared with corresponding shNT group.
2.5 MCU抑制剂DS16570511对GSC形成肿瘤球大小和数量的影响
图5结果显示,培养至第6天,DS16570511 25 μmol·L-1可显著抑制T387,T4121和16157细胞活力(P<0.05,P<0.01)及肿瘤球大小(P<0.05),但对NHA细胞活力影响较弱(P<0.05),对NHA细胞形态无明显影响;50 μmol·L-1能显著抑制该4种细胞活力(P<0.01),同时NHA细胞死亡。表明DS16570511 25 μmol·L-1可特异性抑制脑GSC和神经干细胞,而对正常神经胶质细胞生长无明显影响。
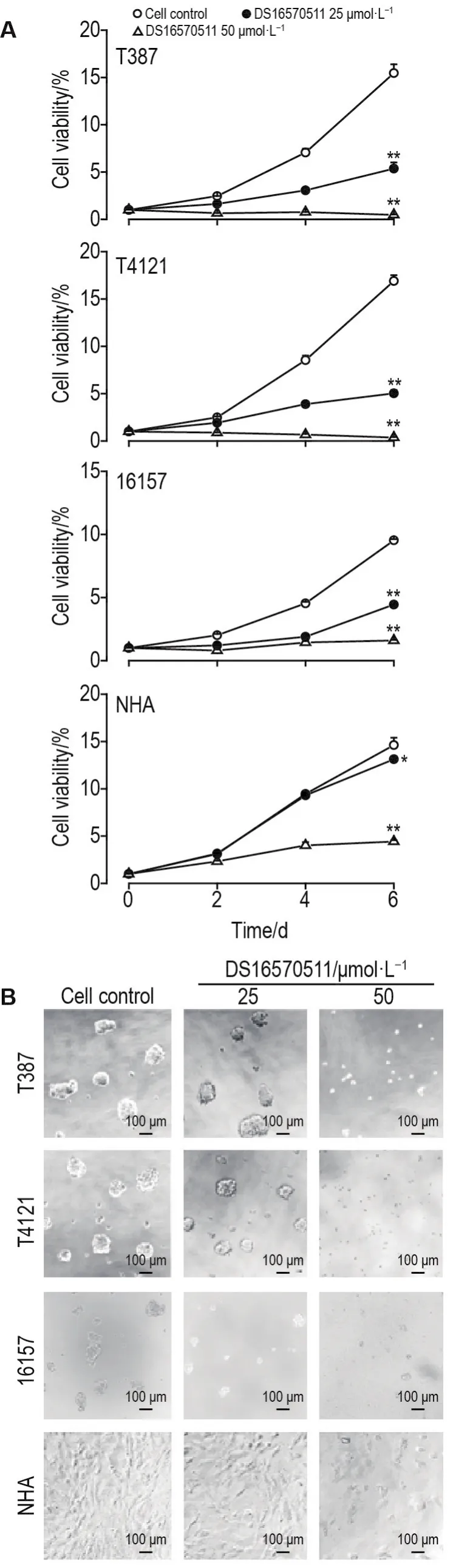
Fig.5 Effect of DS16570511 on cell viability(A)and tumor sphere formation(B)of T387,T4121,16157 and NHA cells.GSC(T456 and T4121),human neural stem cells(16157)and human astrocytes(NHA)were treated with MCU inhibitor DS16570511.The cell viability was detected on the 0,2nd,4thand 6thdays.The size of tumor spheres and cell status were detected on the 6thday.±s,n=3.*P<0.05,**P<0.01,compared with corresponding cell control group.
2.6 敲低MCU表达抑制GSC的成瘤能力,延长小鼠生存时间
图6结果显示,与接种LUS-shNT细胞组相比,接种LUS-shMCU#1和LUS-shMCU#2细胞的裸小鼠颅内移植瘤区域发光明显减弱,祼小鼠存活时间亦显著延长。T387-LUC-shNT细胞移植瘤小鼠平均存活33 d,敲低MCU后移植瘤小鼠平均存活时间分别延长至67和66 d;T4121-LUC-shNT细胞移植瘤小鼠平均存活34 d,敲低MCU后移植瘤小鼠平均存活时间分别延长至75和73 d。
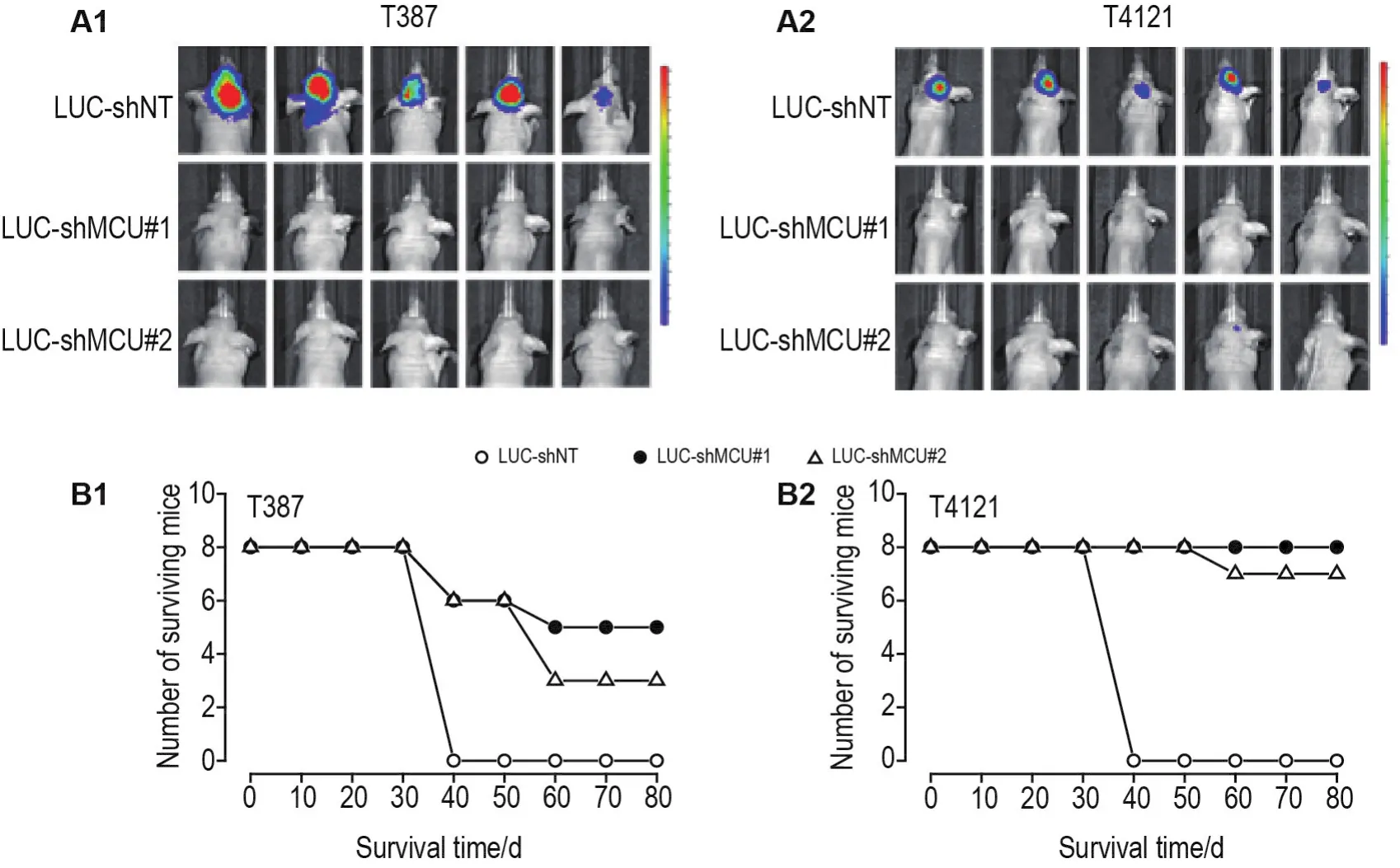
Fig.6 Knockdown MCU inhibited tumorigenesis ability(A1,A2)of T387 and T4121 cells and prolonged survival time(B1,B2)of xenografted nude mice.The cells transfected by LUC-shRNA were injected into the intracranial of BALB/c nude mice.Bioluminescence imaging was performed on the brains of BALB/c nude mice afer 25 d,and the mouse survival time was recorded.n=8.
3 讨论
本研究结果表明,MCU在GSC中高表达,且敲低MCU可抑制GSC自我更新能力和增殖,提示MCU可能是影响GSC生长的靶点。据报道,DS16570511是 MCU 抑制剂,25 μmol·L-1能显著抑制线粒体的钙吸收,即抑制MCU功能[16]。本研究结 果表明,DS16570511 25 μmol·L-1处理后T387,T4121和16157细胞活力明显降低,但对NHA细胞活力和增殖影响较小,表明MCU可能特异性地在脑GSC中发挥作用。GSC的主要功能是起始肿瘤发生,促进肿瘤发展。为此,本研究构建了裸小鼠颅内原位移植瘤模型。结果显示,敲低MCU后裸小鼠颅内移植瘤生长明显缓慢,且移植瘤裸小鼠的存活时间显著延长。上述结果表明,MCU可调控脑GSC增殖。
已知线粒体钙具有调控细胞死亡和能量合成的重要功能。但MCU是否通过调控GSC的能量合成或其他细胞死亡途径影响GSC增殖尚不清楚。本研究仅聚焦于MCU在脑GSC的功能,未阐明具体的网络调控机制,如MCU已知的调控因子腺苷酸活化蛋白激酶或钙调蛋白依赖性蛋白激酶Ⅱ等在GSC中是否发挥调控MCU功能的作用值得进一步探索。
综上所述,敲低MCU表达可抑制GSC体外增殖和自我更新能力,亦可抑制GSC在裸小鼠颅内原位成瘤能力,且延长移植瘤小鼠的存活时间。本研究为MCU调控肿瘤发展研究提供依据,也为其调控脑GSC研究提供新思路。

