腹腔镜右半结肠癌根治术采用淋巴示踪技术引导肠系膜上动脉旁淋巴结清扫的临床意义*
廖伟林,刁德昌,汪佳豪,林佳鑫,唐新,李文娟,李洪明,易小江,卢新泉,冯晓创,陈昭宇
1 广州中医药大学第二临床医学院 广东广州 510405
2 广东省中医院结直肠外科 广东广州 510120
右半结肠癌淋巴引流范围的探索是解决右半结肠癌根治术淋巴结清扫内侧界问题的关键。根据结直肠的淋巴引流规律[1-2]以及消化道的组胚原理,以肠系膜上动脉(superior mesenteric artery,SMA)作为淋巴结清扫内侧界更加符合肿瘤学原则。为了进一步明确右半结肠癌淋巴引流范围,本中心应用纳米炭和吲哚菁绿(indocyanine green,ICG)淋巴示踪技术首次在活体中证明右半结肠癌淋巴引流区域覆盖SMA腹侧面的肠系膜,提示右半结肠癌根治术SMA旁淋巴结清扫的潜在肿瘤学价值[3]。
相对于以肠系膜上静脉(superior mesenteric vein,SMV)作为淋巴结清扫内侧界的右半结肠癌根治术,动脉导向的右半结肠癌根治术淋巴结清扫的难度更大,容易损伤SMA周围的肠干淋巴管和肠系膜上神经丛,导致术后乳糜漏、腹痛、腹泻等并发症风险增加[4]。纳米炭和ICG淋巴示踪技术在胃肠肿瘤手术中具有界定淋巴引流区域,增加淋巴结清扫数目和减少术中并发症等作用[5-7]。但是目前尚无研究探索淋巴示踪技术对右半结肠癌根治术SMA旁淋巴结清扫效果及手术安全性的影响。本研究回顾性分析2019年1月至2021年6月期间在广东省中医院结直肠外科行腹腔镜下动脉导向右半结肠癌根治术的95例结肠癌患者的临床资料,探究淋巴示踪技术在腹腔镜右半结肠癌根治术SMA旁淋巴结清扫中的应用价值,现报告如下。
1 资料与方法
1.1 一般资料
回顾性收集2019年1月至2021年6月期间在广东省中医院结直肠外科行腹腔镜下动脉导向右半结肠癌根治术的95例结肠癌患者的临床资料。95例患者中,23例术前注射ICG,20例显影成功;19例术前注射纳米炭混悬注射液,16例显影成功。53例未注射淋巴示踪剂。本研究将淋巴结显影成功的36例患者归为淋巴示踪组,59例未注射淋巴示踪剂或显影失败的患者归为对照组,两组的一般资料比较差异均无统计学意义(均P>0.05),见表1。本研究经广东省中医院伦理委员会批准,伦理审批号(BF2019-026)。

表1 两组的一般资料比较
1.2 纳入与排除标准
纳入标准:(1)术后病理诊断为结肠癌;(2)既往无腹部手术史;(3)接受腹腔镜手术;(4)采用纳米炭或ICG淋巴示踪技术。排除标准:(1)阑尾恶性肿瘤、神经内分泌肿瘤;(2)伴有肿瘤远处转移;(3)术前放化疗;(4)手术视频资料缺失。
1.3 注射淋巴示踪剂
手术前一天,患者完成肠道准备后进行结肠镜检查。结肠镜下将纳米炭混悬注射液或ICG注射在距离肿瘤边缘1 cm处2~3个点。操作时先在预注射位点注入小剂量生理盐水使得黏膜层分离,避免示踪剂注射到错误的层面。内镜医师使用25-G细针头将纳米炭混悬注射液(50 mg/1 mL)或者ICG(25 mg/10 mL)注射到黏膜下层,应注意避免刺穿肠壁。
1.4 手术方法
手术标准选择方面,其中肿瘤位于回盲部和升结肠的患者采用右半结肠癌根治术,肿瘤位于结肠肝曲的患者采用右半结肠癌扩大根治术。手术包括以下几个主要步骤:(1)系膜游离,以尾侧入路暴露在右半结肠系膜和小肠系膜交界处切开腹膜进入升结肠后间隙,向头侧游离系膜至十二指肠胰头水平。(2)中央血管结扎,以SMA左侧缘作为淋巴结清扫的内侧界,依次游离并根部结扎回结肠动静脉、右结肠动静脉、中结肠静脉、中结肠动脉(middle colic artery,MCA)右支/MCA(右半结肠癌扩大根治术)。(3)肠管切除,离断近端1/3或2/3(右半结肠癌扩大根治术)的横结肠、10 cm末端回肠、距离肿瘤10 cm内的胃网膜右系膜以及大网膜(右半结肠癌扩大根治术),整块切除右半结肠。淋巴示踪组如果在计划清扫区域外发现显影淋巴结,则进行超出标准范围的淋巴结清扫。
手术结束后,主刀医师立即分离结肠系膜并分检区域淋巴结,根据其在结肠系膜上的位置分为N1(肠旁)、N2(中间)或N3(中央)淋巴结。将SMA旁的中央淋巴结分为203A、213A、223A淋巴结。
1.5 观察指标
(1)ICG或纳米炭显影情况【包括SMV旁淋巴结显影情况,SMA旁淋巴结(203A、213A、223A淋巴结)显影情况,NO.6淋巴结显影情况】及超出标准清扫范围情况。
(2)术中情况(手术时间、术中出血量)。
(3)术后恢复情况【首次排气时间、首次进食时间、拔除引流管时间、腹腔引流量、术后住院时间及术后并发症(包括乳糜漏、腹泻、肠梗阻、术后腹腔出血)】。乳糜漏的诊断标准[8-9]:①腹腔引流管引流出乳白色液体;②引流液的甘油三酯浓度>1.2 mmol/L;③排除胆漏、胰漏、肠漏等其他并发症。腹泻的诊断参考《中国腹泻病诊断治疗方案》[10]:粪便性状有改变,呈稀便、水样便、黏脓便或脓血便;排粪次数比平时增多。结合右半结肠癌术后患者特点,本研究关于腹泻的诊断标准如下:①粪便性状较术前明显改变,便质稀烂或呈水样便;②排粪次数≥3次/天;③发生在术后3个月内,持续时间超过1周。
(4)术后病理(总淋巴结检出数目、N3淋巴结检出数目、SMA旁淋巴结检出数目、阳性淋巴结检出数目)。
(5)两种示踪剂显影效果比较,比较指标包括显影情况,超出标准范围的淋巴结清扫情况,总淋巴结检出数目,N3淋巴结检出数目,阳性淋巴结检出数目及阳性淋巴结检出率。
1.6 统计学方法
选用SPSS 26.0统计学软件对数据进行处理。计量资料以()或M(QL,QU)表示,组间比较行t检验或非参数检验;计数资料以[n(%)]或(n)表示,组间比较行χ2检验或Mann-WhitneyU检验或Fisher精确检验法。以P<0.05为差异有统计学意义。
2 结果
2.1 ICG或纳米炭显影情况
淋巴示踪组36例患者中(表2):35例(97.2%)患者出现SMV旁淋巴结显影,其中SMV后方显影3例(8.3%);29例(80.6%)患者出现SMA旁淋巴结显影,203A、213A、223A淋巴结显影率分别为52.8%、33.3%和63.9%;3例患者出现SMA左侧淋巴结显影,所有患者均未见SMA动脉鞘显影;NO.6淋巴结显影率为11.1%。共6例(16.7%)患者在计划清扫区域外发现显影淋巴结,实施超出标准范围的淋巴结清扫。淋巴示踪组显影图像见图1、图2。

图1 SMA、SMV周围的淋巴示踪情况
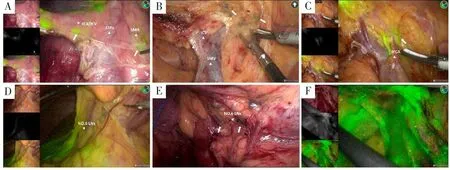
图2 滋养血管根部淋巴结及NO.6淋巴结显影情况
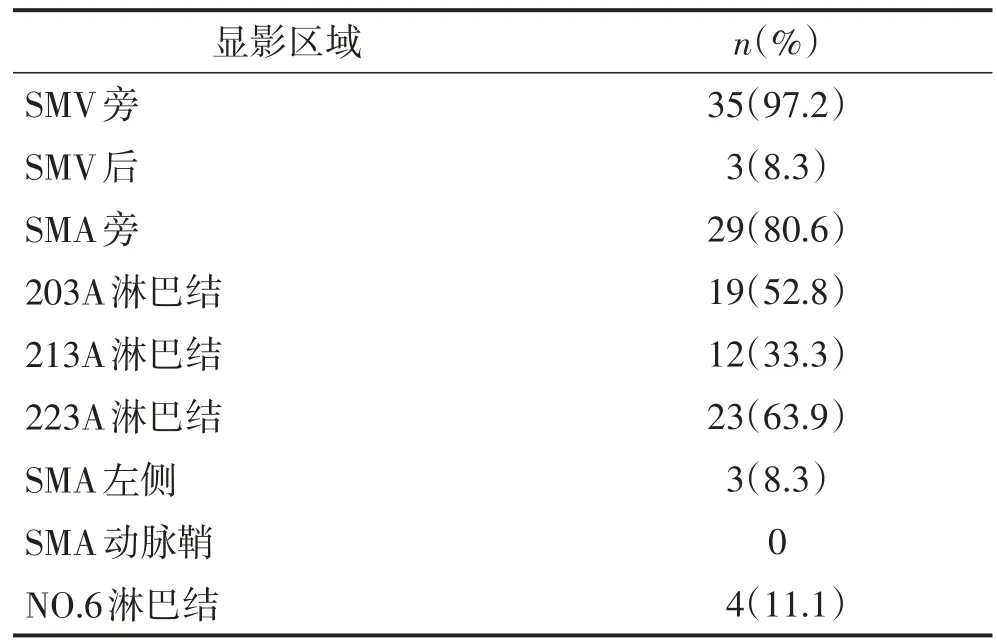
表2 淋巴示踪组术中显影情况
2.2 两组术中情况比较
淋巴示踪组1例患者术中出现淋巴漏,术中可见绿色荧光的淋巴液从肠系膜表面渗漏到腹腔(图2F),用超声刀烧灼闭合淋巴管并喷洒组织胶水封堵,术后未出现淋巴漏。两组手术时间、术中出血量比较差异均无统计学意义(均P>0.05),见表3。

表3 两组术中情况比较
2.3 两组术后恢复情况比较
两组首次排气时间、首次进食时间、拔除引流管时间、腹腔引流量、术后住院时间及术后并发症发生率比较差异均无统计学意义(均P>0.05),见表4。所有发生并发症患者经内科治疗后均可好转出院,无30天内再住院病例,无围手术期死亡病例。
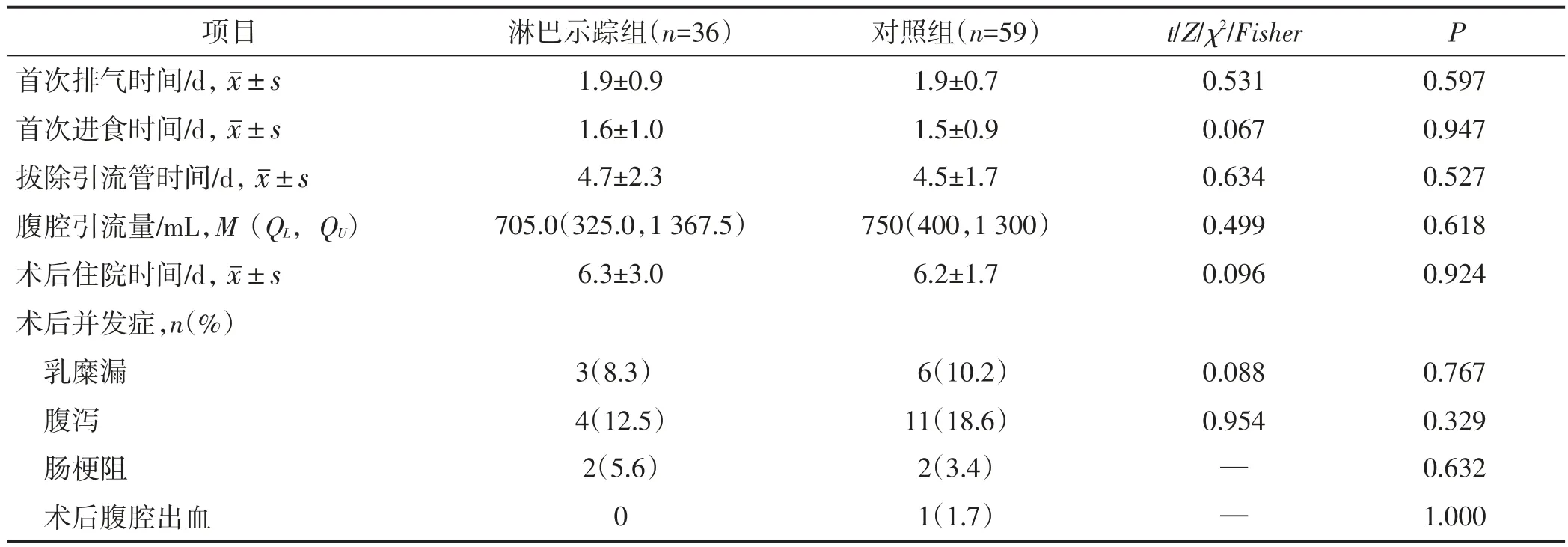
表4 两组术后恢复情况比较
2.4 两组术后病理比较
淋巴示踪组的总淋巴结检出数目、N3淋巴结检出数目均多于对照组,差异有统计学意义(均P<0.05),两组阳性淋巴结检出数目、SMA旁淋巴结检出数目比较差异均无统计学意义(均P>0.05)。见表5。
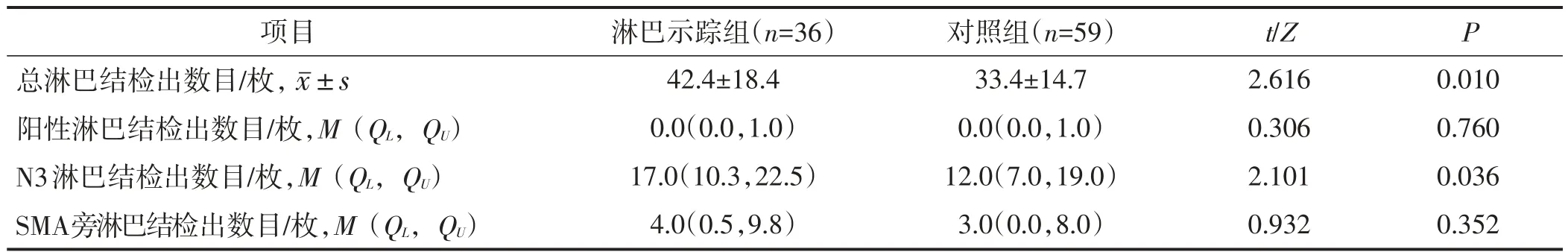
表5 两组术后病理比较
2.5 两种示踪剂显影效果比较
纳米炭组和ICG组患者的肿瘤位置、T分期、N分期比较差异均无统计学意义(均P>0.05),提示可进行后续的显影效果比较。两种示踪剂的显影情况,超出标准范围的淋巴结清扫情况,总淋巴结检出数目,N3淋巴结检出数目及阳性淋巴结检出数目比较差异均无统计学意义(均P>0.05),提示两种示踪剂整体显影效果基本一致,但是纳米炭组的阳性淋巴结检出率高于ICG组,差异有统计学意义(P<0.05)。见表6。

表6 两种示踪剂显影效果比较
3 讨论
淋巴结转移是影响肿瘤患者预后的主要因素之一,因此胃肠道恶性肿瘤根治性切除强调彻底的区域淋巴结清扫。淋巴示踪是一类在手术过程中将淋巴引流路径和区域淋巴结分布可视化的技术,已经被应用于胃肠道恶性肿瘤根治性手术中,有助于确定淋巴结清扫范围和检出淋巴结[7,11]。
目前,关于右半结肠癌根治术D3淋巴结清扫内侧界的争议不断,而明确右半结肠的区域淋巴引流范围是消除上述争议的关键。综合结直肠淋巴引流的基本规律、结肠系膜分布规律以及尸体解剖研究报道的区域淋巴管走行范围,本中心于2017年提出以SMA中线作为右半结肠癌淋巴结清扫内侧界的观点[12]。在当时,淋巴结在SMA周围的具体分布情况仍然不能被准确描述,围绕这一问题的活体观察研究尤为缺乏。2018年开始,本中心应用ICG和纳米炭淋巴示踪技术在术中观察右半结肠的淋巴显影情况。本研究显影成功病例中,中央淋巴结显影率高达97.2%,80.6%的患者可出现SMA旁淋巴结清晰显影,证明了ICG和纳米炭对肠系膜上动静脉周围的淋巴示踪效果良好,右半结肠淋巴液引流至SMA周围并非偶然现象。与Nesgaard等[13]的研究结论不同,右半结肠淋巴引流并非精确地以SMA中线作为终点,而是普遍引流至SMA并覆盖MCA和ICA之间SMA腹侧面系膜,在少数病例中甚至出现SMA左侧淋巴显影现象,SMA后方和SMA血管鞘内则未见显影。此外,通过术中显影情况我们发现,淋巴引流范围存在个体差异,可能与血管变异相关。在既定的清扫范围下,ICG和纳米炭淋巴示踪技术有助于外科医师观察到区域淋巴结分布的特殊情况,术中灵活处理超出标准清扫范围的区域淋巴结[14]。根据前述研究结果,我们将右半结肠癌淋巴结清扫范围的内侧界修正为SMA左侧缘,并明确了保护SMA血管鞘的肿瘤学安全性。ICG和纳米炭淋巴示踪技术作为活体下观察淋巴引流的有效手段,弥补了既往病理学研究和尸体研究的局限性,有助于界定SMA导向右半结肠癌根治术的手术范围和清扫标准。
本研究的病理结果显示,淋巴示踪技术的应用能够增加右半结肠癌根治术总淋巴结检出数目和N3淋巴结检出数目,达到更准确的肿瘤分期效果。但淋巴示踪组的阳性淋巴结检出数目并未见增加。既往文献报道,阴性淋巴结清扫数目的增加同样有利于改善进展期结直肠癌患者的生存获益[15-16],其原因可能是更充分地切除淋巴组织内潜在的微转移癌灶。N3淋巴结检出数目增加则证明了淋巴示踪下中央淋巴结清扫更为彻底。近期国内的一项多中心研究报道了SMA旁淋巴结清扫有延长Ⅲ期右半结肠癌患者的无病生存期的趋势(P=0.056)[17],佐证了包括SMA旁淋巴结在内的N3淋巴结清扫的肿瘤学价值。此外,有研究表明,中央淋巴结转移和淋巴结跳跃转移与结直肠癌预后不良相关[18],理论上N3淋巴结检出数目越多,对中央淋巴结转移和淋巴结跳跃转移的评估越准确。
纳米炭和ICG的显影效果各有特点。ICG示踪呈现片状分布的荧光区域,而纳米炭呈现点状散在分布的黑染淋巴结,前者突出淋巴引流方向和范围,后者则突出淋巴结具体位置。两种示踪剂应用下SMA旁淋巴结和NO.6淋巴结的显影率基本一致,总淋巴结检出数目、阳性淋巴结检出数目、N3淋巴结检出数目亦基本一致。而值得注意的是,纳米炭示踪下阳性淋巴结检出率升高。笔者认为造成这一差异的主要原因是纳米炭染色对于标本离体后观察单个淋巴结或淋巴结群具有明显优势,便于病理科医师区分脂肪组织和淋巴结;采用ICG示踪则难以在手术标本离体后继续观察淋巴引流情况。有研究指出小于5 mm的淋巴结在肉眼观察下非常容易被忽视,纳米炭染色能够提高小淋巴结的检出率[19-20]。此外,由于纳米炭具有高度的淋巴系统趋向性,经纳米炭黑染的淋巴结可能具有更高的阳性率[20]。但本研究受限于淋巴示踪组的样本量较小,对组间差异统计结果影响较大,该结论尚需要在后续研究中进一步验证。
淋巴示踪技术引导右半结肠癌淋巴结清扫并未增加术后并发症风险。SMA旁淋巴结清扫的主要手术风险是肠系膜上神经丛损伤和淋巴管损伤,临床表现为以腹痛、腹泻为主的胃肠功能紊乱和乳糜漏。由于肠系膜上神经丛主要分布于SMA血管鞘内,自2018年始,本中心采取保留SMA血管鞘及鞘内神经的方法,降低了患者术后胃肠功能紊乱的发生率[4]。此外,在胰腺下方,SMA、SMV周围的淋巴管收集肠系膜淋巴液后汇集至腰干和肠干,胰腺周围的过度清扫可能导致粗大淋巴管损伤。在淋巴示踪条件下,所有患者均未出现SMA血管鞘显影,根据显影范围清扫淋巴结后SMA血管鞘仍保持光滑完整,因此与对照组相比,未增加术后腹泻的发生率。16.7%的患者接受超出标准范围的淋巴结清扫,扩大的范围包括幽门下淋巴结和SMA左侧淋巴结。病理结果显示淋巴示踪组的总淋巴结检出数目和N3淋巴结检出数目均多于对照组,但术后乳糜漏风险并未增加。这证明了淋巴示踪技术引导右半结肠癌淋巴结清扫不会增加肠系膜上神经丛和淋巴管的损伤风险。尚有少数病例可在ICG的示踪下观察到术中淋巴漏,指导术者闭合损伤的淋巴管。
综上所述,淋巴示踪技术能够有效显影包括SMA周围区域在内的中央淋巴结,帮助了解右半结肠区域淋巴引流规律,确定以SMA左侧缘作为右半结肠癌根治术淋巴结清扫终点。淋巴示踪条件下总淋巴结检出数目和N3淋巴结检出数目增加,提高了淋巴结清扫效果,同时术后并发症风险未见增加。相比ICG,纳米炭示踪可能有助于提高阳性淋巴结检出率。
利益冲突声明 全体作者均声明不存在与本文相关的利益冲突。