枸杞多糖通过调控α-MSH蛋白的表达抑制UVA诱导的细胞黑色素生成
肖常青, 陈教全, 唐奕, 欧珊珊, 李华平, 彭丽倩, 李振洁, 朱慧兰
广州市皮肤病防治所,广东 广州 510095
黑色素是由皮肤黑素细胞生成,具有保护皮肤免受紫外线辐射、避免细胞DNA损伤的作用,但其过速增长或分布不均会导致皮肤局部黑色素沉积过度,将导致老年斑、雀斑和黄褐斑甚至皮肤癌,对患者的生活造成极大的困扰[1-3]。目前临床上使用较多的美白药物,如苯二酚、氢醌、曲酸等均具有较好的抑制黑色素生成能力,但这些物质具有刺激性和细胞毒性,会造成色素脱失、过敏甚至皮肤癌等不良反应,因此追求高效且安全的黑色素抑制剂是美白目前的研究方向[4-5]。有研究报道,部分的中草药及天然抗氧化剂具有抑制细胞黑色素生成的作用[6-8]。枸杞多糖(lycium barbarum polysaccharide,LBP)是从枸杞子中提取的多糖类化合物,是一种天然抗氧化剂,有广泛的药理学作用,包括抗氧化、抗肿瘤、保护神经系统、降血脂等[6-8]。明枸杞子水提物对酪氨酸酶(tyrosinase)有抑制作用[11],但关于LBP调控UVA诱导黑素细胞生成的作用及分子机制尚不明确。本研究通过体外建立UVA诱导的黑素细胞黑色素生成,探讨LBP抑制黑色素生成的作用及机制,旨在为LBP治疗色素性疾病提供依据。
1 材料与方法
1.1 主要试剂、仪器
HaCaT细胞(中科院细胞库),HEM细胞(中科院细胞库)。LBP(西安天丰生物科技有限公司,棕黄色粉末,用PBS配置50 mg/mL母液,分装后于-20 ℃避光保存),DMEM-高糖细胞培养液(美国Gibco),Nonapeptide-1acetatesalt(N-1A,MedChemExpress),0.25%胰蛋白酶(美国Gibco),RPMI 1640培养液、PBS(杭州吉诺),GAPDH一抗(生工生物),MITF一抗(成都正能),tyrosinase一抗、TRP1一抗、TRP2一抗(Affinity),α-MSH ELISA检测试剂盒(武汉华美)。UVA-TL/10灯管(荷兰PHILIPS),电热恒温水浴锅(上海精宏),分光光度计(ThermoScientific),JS多功能水平电泳槽、全自动凝胶成像分析仪(上海培清)。
1.2 方法
1.2.1 HaCaT和HEM细胞培养 在37 ℃、5% CO2条件下用DMEM-高糖培养基孵育HaCaT、HEM细胞。用0.25%胰蛋白酶消化后行传代培养。选生长良好的对数生长期细胞进行实验。
1.2.2 CCK8法检测细胞的增殖 根据本课题组前期实验成果[12],采用30 J/cm2UVA剂量处理细胞。UVA灯每次照射前测试UVA强度,照射距离固定为15 cm, 依据UVA剂量/UVA强度确定照射时间。CCK8试剂盒检测LBP对细胞增殖的影响:将HaCaT、HEM细胞接种于96孔培养板,细胞的密度控制在1×104个/孔,细胞贴壁后吸去上清液,加入LBP浓度为0、20、50、100、200、300、400、500 μg/mL的培养液,培养24 h后,弃原培养液,每孔加入CCK8试剂100 μL/孔,37 ℃、5% CO2培养箱中孵育3 h后,在酶标仪上,检测波长450 nm,测量吸光度(A值)。细胞相对生长率=实验组A值/对照组A值×100%。选择同时对HEM细胞和HaCaT细胞生长均无明显抑制的LBP浓度为实验浓度。
1.2.3 细胞分组 将HEM细胞、HaCaT细胞随机分为5组:空白组,UVA组,UVA+LBP组,UVA+N-1A组,UVA+LBP+N-1A组。空白组:仅正常培养,不做任何处理;UVA组:直接进行UVA照射(照射方法同1.2.2所述);UVA+LBP组:HEM/HaCaT细胞与上述得到的实验浓度LBP在37 ℃共培养24 h后, 进行UVA照射;UVA+N-1A组:HEM/HaCaT细胞与20 μM N-1A在37 ℃共培养24 h后, 进行UVA照射;UVA+LBP+N-1A组:HEM/HaCaT细胞、上述得到的实验浓度LBP与20 μM N-1A在37 ℃共培养24 h后, 进行UVA照射。
1.2.4 HEM细胞中tyrosinase活性测定 将5组细胞每个浓度设置3个复孔,培养72 h。弃去上清液,DPBS清洗2次,每孔加入含1% TritonX-100的DPBS缓冲液80 μL,迅速置于-80 ℃低温冰箱2 h。取出置于常温融化,37 ℃孵育5 min,加入20 μL质量分数为0.2%的L-dopa,37 ℃反应2 h,于酶标仪测定490 nm的吸光度值。按如下公式计算酶活力:tyrosinase活性=实验组OD值/对照组OD值×100%。
1.2.5 HEM细胞中黑色素含量的测定 上述5组细胞处理后,每组设置3个复孔,培养72 h后,用DPBS清洗2次,消化并收集细胞于离心管中(共2 mL,其中取20 μL稀释一定倍数用于细胞计数),于1 500 r/min的条件下离心10 min,弃去上清液。加入2 mL的DPBS用移液器轻轻吹打制成细胞悬液,加入500 μL乙醇乙醚混合液(体积比1 ∶1),在室温下放置30 min,于3 000 r/min的条件下离心5 min,弃去上清液,加入1 mL含10%DMSO的1 mol/L NaOH溶液,混匀,于80 ℃水浴孵育45 min,测定490 nm吸光度值。黑色素合成总量=实验组OD值/对照组OD×100%。
1.2.6 HaCaT和HEM细胞中α-MSH含量的测定 将5组HaCaT细胞、5组HEM细胞按上述处理后,每个浓度设置3个复孔,培养72 h。用α-MSH ELISA试剂盒检测HaCaT、HEM细胞中的α-MSH的水平,操作步骤按说明书进行。
1.2.7 Western blot检测HEM细胞中黑色素合成相关蛋白表达量 5组HaCaT细胞、5组HEM细胞分别按上述处理后,提取蛋白,BCA法测定总蛋白含量,SDS-PAGE电泳(低压80 V,30 min;高压120 V,60 min),转膜,在含5%脱脂奶粉的TBST中封闭1 h,孵育一抗(抗体比例tyrosinase为1 ∶ 1 000、MITF为1 ∶1 000、TRP1为1 ∶1 000、TRP2为1 ∶1 000),置于4 ℃冰箱过夜,洗膜,孵育二抗,洗膜,显影。采用Image J图像分析软件分析条带灰度值,以目的蛋白条带与相应的内参GAPDH条带的灰度值比值作为其蛋白表达相对表达水平。
1.2.8 统计学处理 使用GraphPad Prism 5软件对实验所得的数据结果进行统计分析,两组间的差异采用独立样本t检验,多组间的差异比较则选用one-way ANOVA检验,两两比较用LSD-t法,P<0.05为差异具有统计学意义。
2 结果
2.1 LBP对HaCaT、HEM细胞增殖的影响
结果显示(图1A、1B),HaCaT细胞经不同浓度LBP(0、20、50、100、200、300、400、500 μg/mL)处理24 h后,与空白组对比,400 μg/mL LBP处理HaCaT细胞后,HaCaT细胞的增殖受到抑制(t=5.57,P=0.011),而300 μg/mL LBP对HaCaT细胞和HEM细胞的增殖均无影响(t=1.89、0.07,P=0.107、0.947)。提示后续试验选择同时对HEM细胞和HaCaT细胞的增殖均无影响的300 μg/mL LBP进行实验。
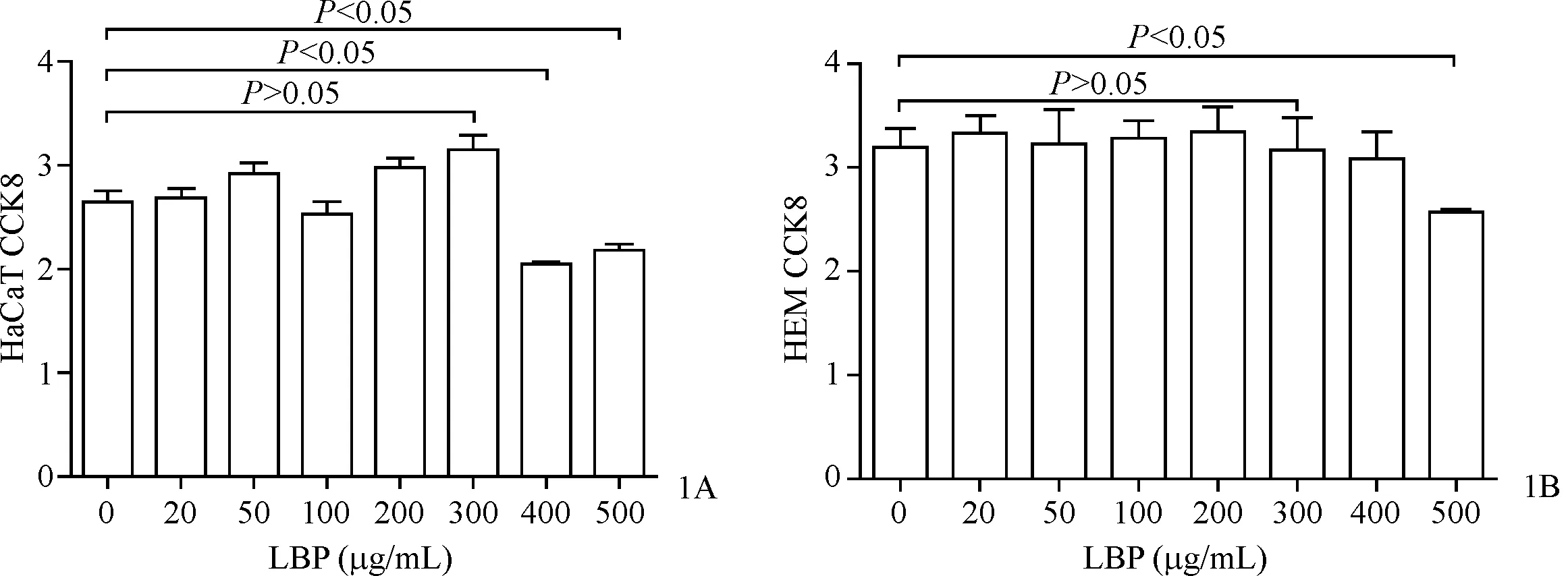
图1 LBP对HaCaT细胞(1A)和HEM细胞(1B)增殖的影响
2.2 LBP对HEM细胞内黑色素生成的影响
由图2A可知,HEM细胞经UVA照射后,细胞黑色素的生成量较空白组明显增加(t=-7.82,P=0.016),提示UVA诱导的黑色素生成增高的细胞模型构建成功。与UVA组相比较,添加LBP、α-MSH拮抗剂N-1A(α-MSH类似物)后均对黑色素生成有抑制效果(t=7.13、7.95,P=0.019、0.015),LBP组的抑制率为33.81%,略低于阳性对照组N-1A(35.13%),但两组间无显著性差异(t=0.16,P=0.885)。显示LBP有显著的抑制黑色素合成的能力。
2.3 LBP对HEM细胞内tyrosinase活性的影响
由图2B可知,HEM细胞经UVA照射后,与空白组对比,tyrosinase活性显著增加(t=-53.51,P<0.01)。LBP和阳性对照N-1A对HEM细胞内tyrosinase活性均呈现出明显的抑制作用(t=33.19、47.46,均P<0.001),表明LBP在一定程度上通过抑制细胞内tyrosinase的活性,但其作用稍弱于N-1A。

图2 LBP对HEM细胞内黑色素生成(2A)和tyrosinase活性(2B)的影响
2.4 LBP对HaCaT、HEM细胞α-MSH水平的影响
为探究LBP是否通过调控α-MSH蛋白水平抑制黑色素生成,采用ELISA法检测HaCaT、HEM细胞内α-MSH的含量,结果显示(图3A、3B),UVA照射后,HaCaT、HEM细胞的α-MSH分泌较空白组明显增多(t=-3.79、-3.41,P=0.043、0.046)。与UVA组对比,当加入LBP处理被UVA照射的细胞后,HaCaT和HEM细胞中的α-MSH含量均出现明显下降(t=3.75、3.41,P=0.044、0.048),而加入N-1A处理后α-MSH含量无明显变化(t=0.21、0.18,P=0.495、0.872)。联合使用LBP和N-1A处理HaCaT和HEM细胞后发现α-MSH的表达均出现下调(t=4.90、3.66,P=0.039、0.047),与单独使用LBP处理细胞无明显差异(t=1.69、-0.66,P=0.232、0.578)。说明LBP可以抑制HaCaT和HEM细胞分泌α-MSH。

图3 LBP对HaCaT(3A)、HEM细胞(3B)α-MSH蛋白水平的影响
2.5 LBP对HEM细胞黑色素生成相关蛋白的水平影响
Western blot结果(图4)显示,HEM细胞经UVA诱导后,细胞内tyrosinase、TRP-1、TRP-2和MITF蛋白的表达明显增加。LBP处理后均能显著抑制UVA或α-MSH诱导HEM细胞中tyrosinase、TRP1、TRP2和MITF等蛋白水平的上调,表明LBP能够通过调控α-MSH水平以抑制细胞内黑色素生成相关蛋白的表达。

图4 LBP对HEM细胞的黑色素生成相关蛋白的水平影响
3 讨论
枸杞子化学成分主要包括多糖、黄酮类、色素类、生物碱等,具有抑制细胞中黑色素生成的作用[11, 13-14]。天然抗氧化剂LBP是枸杞子的主要化学成分,具有提高免疫力、抗氧化、抗肿瘤、调节血糖、降血脂等药理作用,但关于其对皮肤细胞中黑色素的影响仍不明确[15]。在细胞黑色素的形成过程中, tyrosinase起着关键性的催化和调控作用, 是主要的限速酶, 可以决定黑色素合成的速率, 也能阻断酪氨酸转化成为多巴进而形成多巴醌,是治疗皮肤黑色素增生疾病的关键[16-17]。枸杞子水提物对tyrosinase具有显著的抑制能力,而且对tyrosinase的抑制效率随提取物浓度升高而增强[11]。枸杞子中2-O-β-D-葡萄糖基-L-抗坏血酸(AA-2βG)具有显著的抑制黑素细胞的生长、 降低细胞黑色素合成的作用, 在抑制tyrosinase活性方面较抗坏血酸更佳。本研究结果表明,LBP可以抑制UVA诱导的HEM细胞中黑色素水平增加,提示LBP在改善皮肤色素沉着方面发挥一定的作用。进一步检测黑色素合成关键酶tyrosinase的表达变化,发现LBP抑制UVA诱导的tyrosinase表达增加,提示LBP通过调控HEM细胞中tyrosinase表达影响UVA作用后的黑色素生成。
紫外线可以刺激皮肤中的角质形成细胞和黑素细胞分泌α-MSH与黑皮质素受体1结合,并激活下游的小眼转录因子(microphthalmia transcription factor, MITF)表达,MITF通过诱导tyrosinase mRNA的转录,促进tyrosinase相关蛋白酶(tyrosinase-related protein,TRP)1和2的合成,导致皮肤黑色素形成[3, 18]。天然抗氧化剂(金边瑞香、橄榄苦苷、人参提取物、桑白皮多酚等)能够降低α-MSH刺激的细胞内黑色素含量,抑制tyrosinase活性及黑色素生成蛋白的表达[19-21]。N-1A 是一种具有与α-MSH竞争作用的新型肽,可以通过与黑皮质素受体1结合与α-MSH产生竞争作用进而起到抑制黑色素生成的作用。本研究应用α-MSH的拮抗剂(N-1A)进行实验,发现LBP可以明显下调UVA诱导的HEM细胞和HaCaT细胞中的α-MSH表达水平,而N-1A不能抑制HaCaT细胞以及HEM细胞中α-MSH的产生,这表明LBP抑制UVA生成黑色素的作用机制与N-1A不同,LBP可能是通过直接调控α-MSH发挥作用。Western blot结果进一步明确LBP可以抑制由α-MSH诱导的黑色素生成相关蛋白MITF、tyrosinase、TRP1和TRP2的表达,提示LBP对HaCaT和HEM细胞分泌的α-MSH具有直接的调控作用。
综上所述,本研究揭示LBP能够明显抑制UVA诱导细胞黑色素的生成,其机制可能是通过调控α-MSH蛋白的表达,发挥减少色素沉着的积极作用。LBP是一种有效的黑色素合成抑制剂,但关于其治疗黑色素性疾病的安全性和疗效仍需进行大量动物以及临床研究证实。

