梅毒螺旋体诱导巨噬细胞分泌的外泌体对巨噬细胞极化的影响
郑春婵,谢嘉豪,邹锐涛,蔡桂月,罗素君,魏娜,李思锐,陈嵘祎
南方医科大学皮肤病医院,广东 广州 510091
梅毒螺旋体(Treponemapallidum,Tp)侵入人体后机体启动固有免疫反应,巨噬细胞作为人体免疫系统的第一道防线,可通过抗体介导的吞噬作用清除病原体[1]。外泌体是一种直径约40~160 nm的胞外多囊泡体,广泛存在于任何体液中[2],在细胞信息传递中起重要作用[3]。研究发现Tp通过巨噬细胞衍生外泌体可以诱导脐静脉内皮细胞活化,上调细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)、血管细胞黏附分子-1(VCAM-1)的表达,促进单核细胞和白细胞的黏附[4],提示Tp刺激巨噬细胞后分泌的外泌体(EXOTp)可能参与梅毒血管炎的致病过程。为了探究EXOTp对巨噬细胞极化的影响在梅毒发病中的作用,本研究观察Tp诱导巨噬细胞产生的EXOTp刺激后巨噬细胞的极化方向,为阐明梅毒的致病机制提供新思路。
1 材料与方法
1.1 材料
1.1.1 致病菌和细胞系 梅毒螺旋体Nichols株、人单核细胞白血病细胞株(human acute monocytic leukemia cell line,THP-1)均由南方医科大学皮肤病医院提供。
1.1.2 主要仪器与试剂 可调式微量移液器(德国Eppendorf),超高速离心机(美国Beckman),OLYMPUS DP71显微照相系统(日本OLYMPUS),激光扫描共聚焦显微镜(日本OLYMPUS),MasterCycler Gradient PCR仪(德国Eppendorf),LightCycler 480ⅡDNA扩增仪(瑞士Roche),电泳仪、水平电泳槽(美国Bio-Rad),定量光度计(德国Eppendorf),高速低温台式离心机(美国Thermo),电子天平AUY120(日本SHIMADZU),-80 ℃低温冰箱(美国Thermo),电子恒温摇床-MAXQ4000(美国Thermo)。苯甲酸雌二醇油剂(上海通用药业股份有限公司),大豆油(深圳南顺油脂有限公司),澳洲胎牛血清(货号:10099141,美国Gibco),RPMI-1640培养基(美国Gibco),葡萄糖(英国OXOID),兔抗人CD9抗体、兔抗人AILX抗体、兔抗人HSP70抗体、兔抗人Annexin-5抗体、兔抗人TSG101抗体(美国abcam),枸椽酸盐缓冲液、PBS缓冲液(武汉BOSTER),40%甲醛(西陇化工有限公司),BSA(广州化学试剂厂),抗荧光淬灭封片液 (碧云天生物技术研究所),RT试剂盒(编号:DRR037A,大连宝生物公司),PCR试剂盒(编号:DRR820A,大连宝生物公司),Trizol(美国Invitrogen),DEPC(北京金鑫天佑生物科技有限公司)。
1.2 方法
1.2.1 梅毒螺旋体准备 梅毒螺旋体Nichols株经qRT-PCR计数后,于冻存液-80 ℃冻存,使用时直接室温复苏,选用PBS稀释至目的浓度。
1.2.2 巨噬细胞培养 THP-1细胞在RIPM 1640完全培养基中培养至对数增长期时,收集所有THP-1细胞悬液,取10 μL滴于细胞计数板在显微镜下计数,离心弃上清液,将THP-1细胞沉淀在RPMI 1640完全培养基重悬,THP-1细胞悬液5 mL加入60 mm细胞培养皿中,加入PMA(佛波酯)100 ng/mL,5% CO2、37 ℃细胞培养箱中孵育48 h后,细胞贴壁,呈多角形,即分化为巨噬细胞用于后续实验。
1.2.3 外泌体提取 被PMA刺激分化的巨噬细胞在RPMI 1640完全培养基中37 ℃、5% CO2继续孵育24 h。将梅毒螺旋体用PBS稀释,按照30 ∶1的比例(Tp比巨噬细胞)加入接种有巨噬细胞的60 mm培养皿中感染24 h。梅毒螺旋体感染巨噬细胞24 h后,更换不含双抗的RIPM 1640完全培养基。收集其后48 h的细胞培养上清液,经4次高速离心,保留沉淀去除上清液,用100 μL PBS反复吹打沉淀制成外泌体悬液EXOTp,同时提取未经梅毒螺旋体感染的巨噬细胞自身产生的外泌体EXO。
1.2.4 外泌体鉴定 ①透射电镜观察:吸取外泌体悬液15 μL于铜网上静置1 min,用滤纸将铜网上的外泌体悬液吸干,吸取2%的醋酸双氧铀染色液15 μL室温染色1 min,将染色完成的样本放于灯下烤10 min,观察拍照。②Western blot检测,Bradford蛋白测定法检测外泌体蛋白含量。外泌体中加入PRO-PREP®蛋白质提取溶液裂解,SONICS超声波细胞破碎仪超声后,低温高速离心5 min,保留上清去沉淀制成蛋白样本。将制备的蛋白样本混匀,取20 μg样品在60 V恒压电泳30 min,80 V恒压电泳1 h,转膜3 h。丽春红染色验证转膜成功。洗净膜,WB封闭液封闭1 h,TBS-T洗膜,重复3次。加入一抗(工作浓度1 ∶1 000),室温摇床孵育2 h,4 ℃过夜,TBS-T洗膜,重复3次。加二抗(工作浓度1 ∶5 000),室温摇床孵育2 h,TBS-T洗膜,重复3次。配制显影液,在Azure C500多功能分子成像分析设备的曝光室内进行检测及拍照。以上操作均收集3次样本进行重复实验。③纳米颗粒跟踪分析技术定量测定外泌体:用去离子水清洗样本池,聚苯乙烯微球(110 nm)校准仪器,以1×PBS buffer清洗样本池,样本以1×PBS buffer稀释100倍,进行检测。
1.2.5 巨噬细胞对外泌体内化作用观察 用荧光染料PKH67对外泌体避光染色10 min。将巨噬细胞接种至共聚焦小皿,加入染色后的外泌体,孵育4 h。对巨噬细胞进行预处理、固定、血清封闭后加一抗,4 ℃孵育过夜。加荧光二抗光孵育1 h,PBS浸洗后加 DAPI避光孵育5 min对细胞进行染核。封片液封片后激光共聚焦显微镜下观察采集图像。
1.2.6 qRT-PCR检测 将不加入外泌体的M0型巨噬细胞设置为空白对照组;加入EXO的M0型巨噬细胞设置为阴性对照组;加入EXOTp的M0型巨噬细胞设置为实验组。采用qRT-PCR检测3组M1型巨噬细胞表型INOS和可溶性介质IL-10、M2型巨噬细胞表型Arg-1和可溶性介质IL-12和内参GAPDH等mRNA表达水平,用ViiATM7 PCR仪进行扩增,重复检测3次。
1.2.7 流式细胞术检测 每支流式检测管中加入100 μL细胞悬液(5~10)×105细胞/管、适量预稀释好的一抗,空白管中加入与抗体相同量的对照试剂,避光冰浴15 min后洗涤2次,用0.5 mL Cell Staining Buffer 重悬细胞,加入10 μL(0.25 μg)/million 细胞的核染料7-AAD(BioLegend Cat. #420401)以区分活、死细胞,冰上孵育5 min。上机分析,分别检测空白对照组、阴性对照组、实验组在6、12、24 h中M1型巨噬细胞表面抗原(MHC-Ⅱ、CD86)和M2型巨噬细胞表面抗原(CD206、CD209)的表达情况。
1.2.8 统计分析 采用SPSS 22.0软件,各组间INOS、IL-12 mRNA等水平的比较选用方差分析,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 外泌体的鉴定
透射电镜下实验组、阴性对照组外泌体均为直径约40~160 nm的微小囊泡,呈盘状囊泡样结构(图1)。Western blot显示两组外泌体标志蛋白(CD9、ALIX、HSP70、TSG101、Annexin-5)条带清晰,5种标志蛋白中CD9表达量最高(图2)。

图1 透射电镜下观察阴性对照组、实验组的外泌体为直径约40~160 nm的微小囊泡,呈盘状囊泡样结构
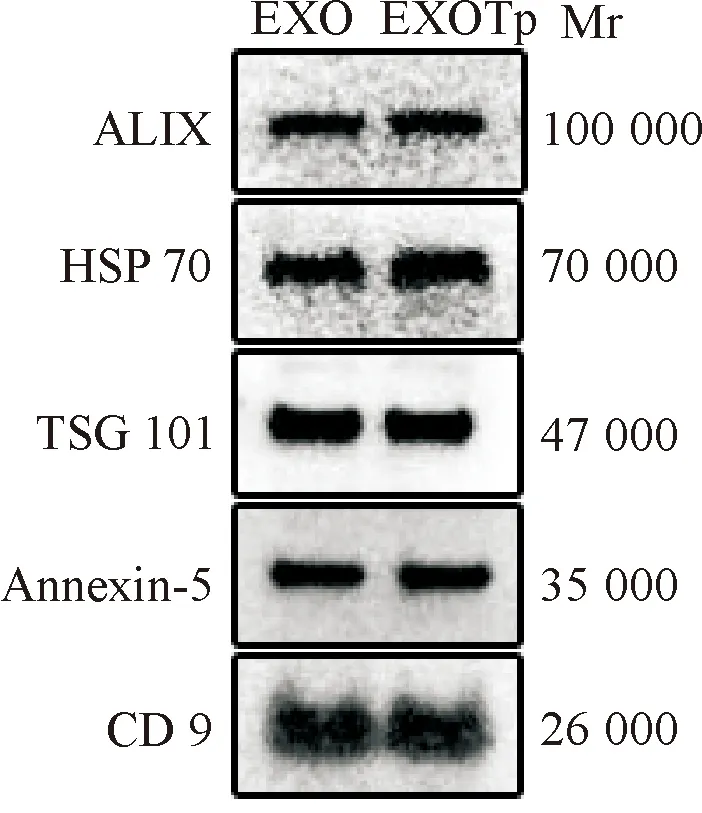
图2 Western blot测定实验组和阴性对照组标志蛋白ALIX、HSP 70、TSG 101、Annexin-5、CD9的表达
2.2 NTA定量测定外泌体
NTA检测实验、阴性对照组外泌体直径40~160 nm,其中阴性对照组外泌体颗粒浓度为5.6×109个/mL,粒径峰值119.6 nm,峰面积占比 91.7%,实测平均粒径大小142.0 nm;实验组外泌体颗粒浓度为7.1×109个/mL,粒径峰值 117.3 nm,峰面积占比 95.0%,实测平均粒径大小 141.3 nm,两组外泌体基本处于 40~160 nm的分布范围(图3A、3B)。

图3 NTA定量测定阴性对照组(3A)、实验组(3B)外泌体,两组外泌体的直径均处于40~160 nm的分布范围
2.3 巨噬细胞对外泌体的内化作用
PKH67染色后的两组外泌体与M0巨噬细胞共培养4 h后激光共聚焦显微镜下观察(图4),PKH67标记的外泌体(绿色荧光)位于CD68抗体标记的细胞膜内(红色荧光),均分布于细胞质内,没有分布在DAPI标记的细胞核区域(蓝色荧光)。

图4 PKH67染色后的两组外泌体与M0巨噬细胞共培养4 h后激光共聚焦显微镜下的内化现象,绿色荧光颗粒为染色后的外泌体,红色荧光颗粒为细胞膜,蓝色荧光颗粒为细胞核区域(1 000×)
2.4 M1/M2型巨噬细胞相关表型鉴定
M0巨噬细胞与实验组、阴性对照组外泌体共培养6、12、24 h,qRT-PCR测定各组M1型相关表型(INOS、IL-12)及M2型相关表型(Arg-1、IL-10 mRNA)的表达情况,结果显示,实验组12、24 h INOS mRNA水平高于同期的空白对照组和阴性对照组,差异有统计学意义(均P<0.05);实验组6、12、24 h IL-12 mRNA水平高于同期的空白对照组和阴性对照组,差异有统计学意义(均P<0.05),且随着共培养时间的延长,INOS、IL-12 mRNA表达量上调更明显;实验组6、12、24 h Arg-1、IL-10表达与同期阴性对照组、空白对照组比较,差异无统计学意义(P>0.05)。6、12、24 h阴性对照组INOS、IL-12、Arg-1、IL-10 mRNA表达均无明显变化(图5)。

图5 qRT-PCR检测M0巨噬细胞被两组外泌体刺激6、12、24 h后INOS、IL-12、Arg-1、IL-10 mRNA的表达情况
2.5 M1/M2型巨噬细胞表面标志物检测
M0巨噬细胞与外泌体共培养6、12、24 h,流式细胞术测定实验、阴性对照及空白对照组M1型巨噬细胞表面标志物(MHC-Ⅱ、CD86)和M2型巨噬细胞表面标志物(CD206、CD209),实验组MHC-Ⅱ阳性,与阴性对照组、空白对照组比较,差异有统计学意义(均P<0.05),3组CD86、CD206、CD209变化无统计学意义(图6);实验组6、12、24 h时点时,CD206-CD209-CD86-MHC-Ⅱ+细胞比率(%)明显上调,与阴性对照组、空白对照组比较,差异有统计学意义(均P<0.01,图7)。

图6 M0巨噬细胞与EXOTp共培养6、12、24 h,流式细胞术测定实验组CD86、MHC-Ⅱ的表达情况

图7 实验组6、12、24 h,CD206-CD209-CD86-MHC-Ⅱ+巨噬细胞百分比比率(%)明显上调
3 讨论
梅毒(syphilis)系由TP感染引起的一种慢性全身性炎症性疾病[5]。Tp侵犯机体后,透过内皮细胞进入血液和组织细胞[6],早期以淋巴细胞浸润为主,致敏的淋巴细胞大量分泌巨噬细胞激活因子激活并募集巨噬细胞,诱导巨噬细胞在M1方向上极化,分泌大量的炎症介质如IL-1β、TNF-α、活性氧等杀伤TP[7-8],防止Tp在体内扩散。巨噬细胞的极化在疾病进展中发挥重要作用。不同组织中的巨噬细胞会根据环境的变化极化成不同的细胞亚型,如经典活化的M1型和选择性活化的M2型巨噬细胞[9]。M1型巨噬细胞高表达CD86、MHC-Ⅱ、iNOS、CD68等,释放IL-1β、IL-6和TNF-α等促炎因子,在感染早期参与清除病原体,防止病原体扩散和持续感染[10-11]。M2型巨噬细胞高表达CD206、CD204、CD163、Arg-1等,分泌IL-10、TGF-β1等多种抗炎因子,在感染控制后参与抗炎反应和修复受损组织[11-12]。M1/M2型巨噬细胞在感染的不同时期可发生再转换[13-14]。
巨噬细胞负责清除感染组织内中的Tp,它的激活模型决定了宿主对Tp攻击的成功或失败[13]。既往研究发现,Tp及其成分脂蛋白皆可引起巨噬细胞极化[8, 14-15],且Tp可诱导巨噬细胞持续分化为M1型巨噬细胞[16]。探讨Tp感染过程中巨噬细胞极化方向及其极化具体分子机制有利于阐明梅毒的致病机制。外泌体在感染性疾病中既可传递病原体分子诱导宿主防御和免疫,也可以充当宿主防御的调节剂和免疫逃避的介质[17-18]。关于Tp感染过程中外泌体对巨噬细胞极化的影响研究较少,本研究在构建Tp体外细胞感染模型的基础上,探讨EXOTp对巨噬细胞极化的影响在梅毒发病中的作用。目前外泌体的鉴定方法包括Western blot、透射电镜、NTA等。既往研究表明,在Tp刺激下,THP-1来源的巨噬细胞分泌的外泌体在形态、大小、浓度上与无Tp刺激巨噬细胞分泌的外泌体相似[19]。本研究中,透射电镜下观察到EXOTp、EXO均为直径约40~160 nm的盘状囊泡样结构。Western blot分析外泌体的蛋白标志物,两组外泌体均高表达CD9、Anexin-5、Hsp70、TSG101及Alix,其中CD9表达量最高。NTA结果提示两组外泌体的粒径和粒径相关的浓度分布无明显差异,基本处于40~160 nm的分布范围。以上结果证明Tp感染THP-1来源的巨噬细胞可产生形态典型的外泌体。外泌体以质膜融合和胞吐作用被靶细胞摄取,是参与细胞间信号交流的基础。本研究将经脂质亲和染料PKH67染色后的两组外泌体与巨噬细胞共培养,分别用CD68、DAPI对巨噬细胞膜、细胞核进行免疫荧光染色,在激光共聚焦显微镜下观察巨噬细胞对两组外泌体的内化现象,结果带绿色荧光的两组外泌体均分布在巨噬细胞胞质内,证实巨噬细胞可以通过质膜融合和胞吞作用摄取外泌体。
利用M1/M2型巨噬细胞相关表型及表面标志物的差异,本研究分别从基因及蛋白层面对外泌体刺激后的巨噬细胞分型进行鉴定。在基因层面上采用qRT-PCR检测INOS、IL-12、Arg-1、IL-10,发现实验组(Tp感染)与阴性对照组(不加Tp感染)和空白对照组相比较,M1型巨噬细胞相关表型INOS和IL-12 mRNA明显上调(P<0.05),且在24 h达到高峰,而M2型相关表型Arg-1、IL-10 mRNA无明显变化。阴性对照组相较于空白对照组,INOS、IL-12、Arg-1、IL-10 mRNA均无明显上调。在蛋白层面上用M1型巨噬细胞表面标志物(MHC-Ⅱ和CD86)和M2型表面标志物(CD206和CD209)进行流式细胞术分析,结果显示各时间点中,CD206-CD209-CD86-MHC-Ⅱ+细胞比率(%)明显上调。以上结果表明,THP-1来源的巨噬细胞分泌的外泌体不能诱导M0巨噬细胞向M1型巨噬细胞极化,而在Tp刺激后,能诱导M0巨噬细胞向M1型巨噬细胞极化。
Tp感染人体后诱导巨噬细胞向M1型极化,激活细胞内多种信号通路,释放大量炎症因子协助吞噬Tp[15],然而仍有部分Tp逃避巨噬细胞的吞噬作用,造成机体持续感染。研究表明,在感染性疾病中,巨噬细胞持续极化为M1型可能会引起局部组织持续的损伤从而造成病原体逃逸[20],若病原体未完全清除,M1型过早转换为M2型巨噬细胞,也会造成病原体逃逸导致机体持续感染。如结核杆菌感染M1型巨噬细胞后,可诱导细胞转换为M2型,引起机体持续感染[21]。因此,探讨EXOTp诱导巨噬细胞极化与Tp免疫逃逸的关系有利于阐明梅毒的致病机制。
综上所述,本研究从功能学上证实了外泌体参与梅毒发病过程,为后续研究EXOTp诱导巨噬细胞极化的具体机制提供了方向,同时也为未来设计研究病原体导致感染性疾病的机制提供了新思路。但受制于Tp在体外的存活时限,本研究仅在体外实验中探索了Tp感染巨噬细胞的早期改变,下一步有必要采用动物模型以延长Tp感染时间探索巨噬细胞在梅毒中晚期的调节作用;此外,本研究对巨噬细胞的极化影响仅局限于现象,未进一步探索分子机制和分子靶点,EXOTp诱导巨噬细胞向M1型巨噬细胞极化的具体机制仍需要进一步探索。

