毛囊间充质干细胞的研究进展
赖惠君,杨岚,游馥榕,马萍萍,郭红卫
1.广东医科大学附属第二医院皮肤科,广东 湛江 524003;2.广东医科大学,广东 湛江 524023;3.广东医科大学附属医院皮肤科,广东 湛江 524000
哺乳动物的皮肤包含三个自我更新的隔室,包括毛囊、皮脂腺和毛囊间表皮,其中含有多种不同类型的多能干细胞[1]。而来源于毛囊隆突和毛乳头的间充质干细胞,具有成骨、成软骨和成脂分化的潜力,称为毛囊间充质干细胞(hair follicle mesenchymal stem cells, HFMSCs)[1]。HFMSCs是一类具有自我再生能力、高度增殖潜能、可多向分化且来源丰富的慢周期标记滞留细胞[2],包括来自毛囊隆突部的毛囊干细胞(hair follicle stem cells, HFSCs)和表皮神经嵴干细胞 (epidermal neural crest stem cells,EPI-NCSCs),来自真皮乳头的毛乳头细胞(dermal papilla cells,DPCs)和皮肤源性前体细胞 (skin-derived precursors,SKPs)[3],黑素细胞干细胞(melanocyte stem cells,McSCs)和角质形成细胞干细胞(keratinocyte stem cells,KSCs),可形成表皮、毛囊和皮脂腺,并有助于损伤后表皮的再生[4]。生理性或病理性脱发是由于以HFSCs和DPCs为代表的两种类型的毛发干细胞的改变,HFSCs和DPCs的激活及再生,为适当的头发恢复和再生提供了条件[5]。
1 HFMSCs种类及特性
1.1 毛囊间充质干细胞(HFSCs)
HFSCs是位于毛囊隆突部的上皮来源的干细胞,表现为未分化的慢周期细胞,可以诱导形成毛囊和皮脂腺等结构,帮助皮肤损伤后表皮再生[6]。HFSCs也可以分化为神经细胞、角质形成细胞、胶质细胞、心肌细胞、平滑肌细胞和黑素细胞[7]。HFSCs表达特异性标志物,包括细胞角蛋白(CK)15、CK19、LGR5、CD34、CD200、巢蛋白(Nestin)和PHLDA1[8]。准确认识它们的功能与定位有助于对HFSCs的识别和筛选(图1)。干细胞的通用标志物巢蛋白(一种中间丝蛋白)既可以作为 HFSCs 的标志物,也可以作为神经干细胞的标志物[9],提示为了提高HFSCs检测的准确性,应联合多种标志物标志鉴定。
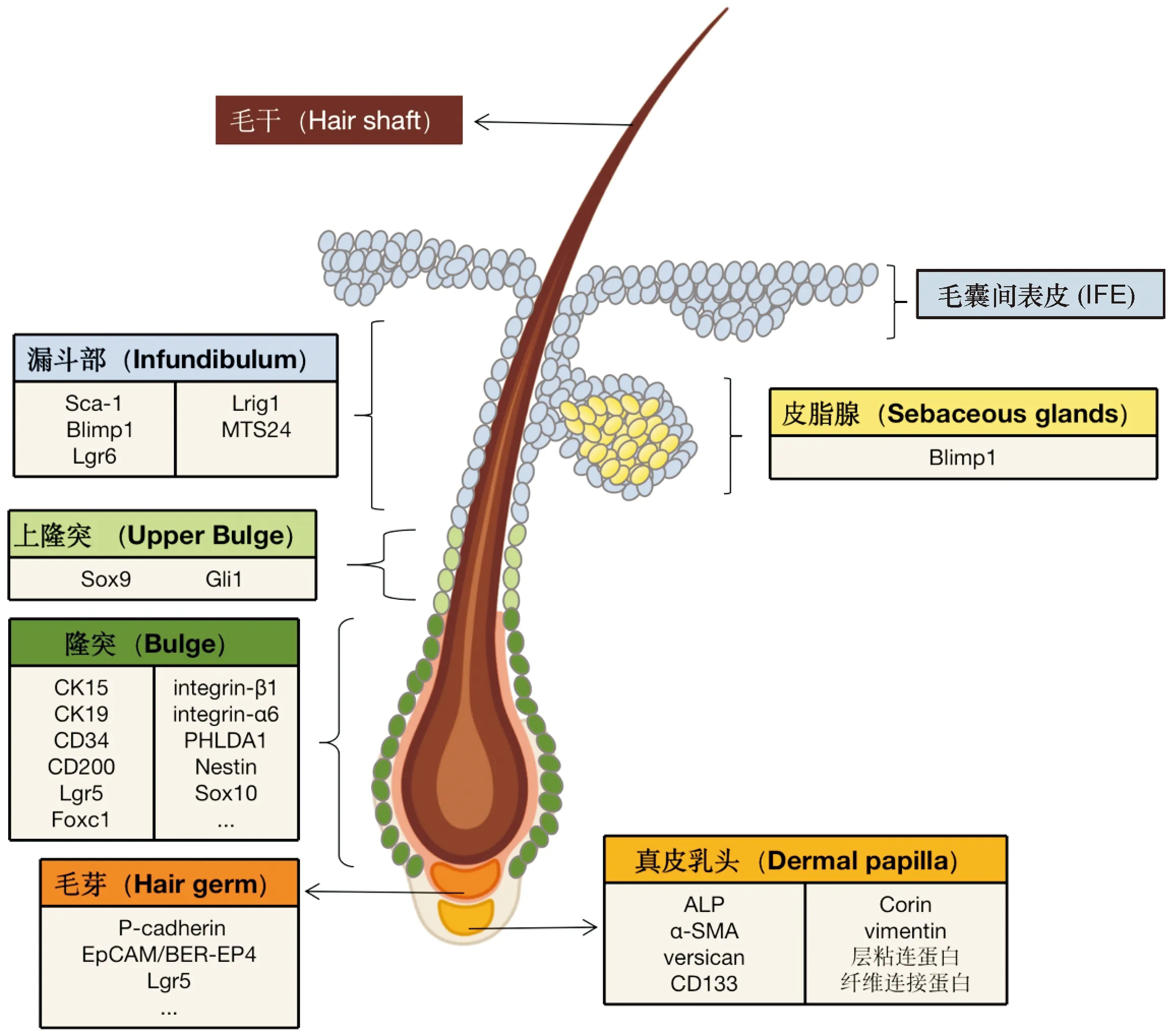
图1 休止期毛囊中干性基因的表达及毛囊间充质干细胞的定位。毛囊间充质干细胞包括来自毛囊隆突部的毛囊干细胞、来自真皮乳头的毛乳头细胞和角质形成细胞干细胞等,可形成表皮、毛囊和皮脂腺,并有助于损伤后表皮的再生。毛囊间充质干细胞位于不同毛囊部位如毛囊间表皮、漏斗部、皮脂腺开口处、毛囊上隆突部、隆突部、毛芽和真皮乳头,表达特异性分子标志物
1.1.1 CK15 CK15被认为是目前人类毛发隆突干细胞最具特异性的标志物之一,它是由外毛根鞘中的一部分角质形成细胞表达的一种Ⅰ型角蛋白[10]。HFSCs在毛发周期的各个阶段都选择性地表达CK15,CK15被广泛用作成体HFSCs的生物标志物。目前最常用于检测CK15的抗体有两个:C8/144B单克隆抗体(最初被提出能针对T细胞蛋白CD8羧基末端肽,后来研究表明能够识别CK15的碱基)和LHK15单克隆抗体(一种针对CK15多肽中最后17个氨基酸的单克隆抗体)[11]。C8/144B单克隆抗体优先染色毛囊隆突的角质形成细胞,而不会染色其他毛囊隆突细胞。而LHK15抗体可以染色毛囊峡部区域以及整个毛囊的外毛根鞘(outer root sheath,ORS),但不识别T细胞。
1.1.2 Lgr5 Lgr5(leucine-rich-repeat-containing G-protein-coupled receptor 5, 也称为Gpr49)是一种富含亮氨酸重复序列的参与Wnt信号通路的G 蛋白偶联受体,已被确定为毛囊干细胞的标志物,它在隆突下部和毛芽中都有表达。Lgr5在毛囊发育早期和整个毛囊形态发生中表达[12],Lgr5+干细胞在毛囊生长期早期增殖活跃,在整个毛囊周期中均有表达,在外毛根鞘和毛球的生长中发挥重要作用。有研究表明Lgr5+HFSCs是响应毛囊生长期起始信号的第一个激活的干细胞群,提示Lgr5足以驱动毛囊再生[13]。
1.1.3 CD34 CD34被视为一个常见的祖细胞标记物,是人类造血干细胞的主要标志物,毛囊干细胞、上皮祖细胞和间充质干细胞等多种细胞也表达CD34。值得注意的是,CD34在小鼠和人类之间的表达有差异,CD34在小鼠隆突细胞中特异性表达,而表达于人类毛囊隆突下部的ORS[14]。提示CD34可以作为小鼠隆突干细胞的特异性标记物,而不适合作为人类隆突部HFSCs的标记物。
1.2 毛乳头细胞(dermal papilla cell,DPCs)
毛囊内诱导和调节毛发生长以及新毛囊形成的另一种干细胞是DPCs。DPCs起源于中胚层,是一种特殊的间充质干细胞,存在于毛囊底部的毛乳头(dermal papilla)中。碱性磷酸酶(ALP)是DPCs独特的标志物,在人类和小鼠毛囊中都有表达,其表达与DPCs活性相关。此外,在DPCs中已观察到α-平滑肌肌动蛋白、层粘连蛋白、纤维连接蛋白、多功能蛋白聚糖(versican)、丝氨酸蛋白酶(corin)和CD133的表达[15](图1)。
当毛囊的下半部分被移除后,毛球不会再生[16]。位于毛囊下部的DPCs和真皮鞘细胞在适宜的环境条件下可以诱导毛球的发生。提示DPCs信号系统可以诱导角质形成细胞来源的隆突干细胞(主要为HFSCs)增殖和随后启动生长期毛囊生长[16]。HFSCs与DPCs在体外可大量扩增,均显示出良好的自我增生能力,它们相互作用还能够促进毛囊再生和新生,这表明HFSCs与DPCs是产生完整毛囊结构的理想的“种子细胞”[16],是毛发再生细胞工程和细胞替代治疗的潜力候选者。
1.3 表皮神经嵴干细胞 (EPI-NCSCs)和皮肤源性前体细胞(SKPs)
成人毛囊的表皮含有多能神经嵴干细胞,起源于胚胎神经嵴并存在于毛囊隆突中,称为表皮神经嵴干细胞 (epidermal neural crest stem cells,EPI-NCSCs)[17]。EPI-NCSCs代表了一种新型的多能成体干细胞,是一种通过体外不对称细胞分裂进行自我更新的标记物保留细胞。表达巢蛋白、Sox10和未成熟的神经嵴细胞标志物,具有定向分化为神经元、施旺细胞、黑素细胞、平滑肌细胞和软骨细胞的能力[17]。EPI-NCSCs分化的细胞表达神经元特异性标志物β-Ⅲ微管蛋白、GABA能神经元标记物谷氨酸脱羧酶 67 (GAD67)、少突胶质细胞标记物RIP 或髓鞘碱性蛋白 (MBP) 。不仅如此,EPI-NCSCs及其后代细胞可永久性表达β-半乳糖苷酶,因此β-半乳糖苷酶被认为是神经嵴细胞的遗传性标志[17]。
与此同时,有研究报道了来自面部皮肤和胡须毛囊的真皮乳头的另一种神经嵴起源的细胞群[18],称为皮肤源性前体细胞 (skin-derived precursors,SKPs)。与来自毛囊隆突部的EPI-NCSCs不同,SKPs的Sox10和p75表达阴性,而表达其他特征性神经嵴标记物如巢蛋白、纤连蛋白、波形蛋白、多功能蛋白聚糖和神经嵴干细胞的三种特定转录因子(Pax3、Snail和Slug)。与EPI-NCSCs相似,SKPs也可以分化为神经元细胞、神经胶质细胞、平滑肌细胞、成纤维细胞和脂肪细胞,而且还可以诱导毛囊形态发生。这提示来源于皮肤的EPI-NCSCs和SKPs可以潜能地为神经系统疾病(如脊髓损伤)提供一种可获得的、丰富的、多能的来源。然而,从生理环境中提取的SKPs,它们产生功能性毛囊的能力会随着时间的推移而降低,同时维持SKPs特性、自我更新和增殖所必需的关键信号通路仍不清楚[19]。
1.4 黑素细胞干细胞(McSCs)
McSCs是一类起源于神经嵴的不成熟的自我更新的干细胞,McSCs存在于休止期毛囊的 CD34+的隆突部和 CD34-的毛芽区域。CD34-的McSCs更有效地产生色素沉着,而 CD34+的McSCs 选择性地表现出髓鞘化神经元的能力。McSCs通常处于静止状态,但会随着毛发周期循环激活或分化并迁移,随后分化为成熟的黑素细胞,为毛囊提供黑色素。最近的研究表明,生理性白发是McSCs逐渐丧失的结果,急性应激诱导、交感神经驱动McSCs过度或者加速增殖[20],提示体干细胞的维持直接受到生物体整体生理状态的影响。
1.5 角质形成细胞干细胞(KSCs)
Barrandon和Green通过克隆分析证明了人KSCs的存在,并发现具有不同增殖能力的三种克隆类型的角质形成细胞,即KSCs(全克隆,具有很高的增殖能力,且表达高水平的干细胞标志物,如β1整合素和K14)、瞬时扩增细胞(部分克隆,具有中等增殖能力)和分化细胞(副克隆,具有非常有限的有丝分裂潜力,并表达高水平的终末分化标志物,如 Inv)。这表明KSCs在维持表皮更新和表皮稳态上起着关键作用[21]。
表皮中有三个KSCs池,分别是毛囊间表皮的基底层、毛囊隆突部ORS以及皮脂腺。在毛囊间表皮的基底层,KSCs被其直接后代瞬时扩增细胞包围,瞬时扩增细胞由KSCs的不对称分裂产生。应用KSCs的α6整合素高表达和转铁蛋白受体CD71低表达的特性,利用流式细胞仪或者细胞黏附法可以快速分选富集KSCs[22]。与HFSCs的多向分化不同,KSCs仅分化为角质形成细胞。
2 HFMSCs的活化
HFMSCs在其生命的绝大多数时间内都处于静止期,而毛发周期可以驱动活化它们。毛发周期贯穿毛囊的一生,包括生长期、退行期和休止期。在生长期,隆突部的干细胞保持在其生态位内自我再生(多次分裂),从而扩大干细胞池。而毛基质中的干细胞分裂旺盛,分化为毛囊表皮祖细胞,向上迁移形成毛囊内毛根鞘并产生成熟的毛干。进入退行期,毛基质细胞发生凋亡,隆突部的干细胞向下移动到毛基质区域,这些细胞增殖分化形成新的毛基质。在退行期结束时,这些新的毛基质于发干周围形成另一个新的隆突,在旧的隆突下形成另一个生发基质——毛芽[23]。毛芽是一组从隆突延伸出来并位于隆突下方的P-钙粘蛋白阳性角质细胞来源的细胞,它在形态上与胚胎毛芽相似,因此得名。
毛芽和HFSCs是下一个毛囊产生的必要元素。毛芽接收来自真皮乳头的DPCs的细胞信号,在休止期被激活,隆突部干细胞HFSCs的活化发生在毛芽活化之后。HFSCs在休止期保持静止状态,在休止期向生长期过渡时,干细胞活化或者移动,形成生发骨架细胞池[24]。即隆突部的HFSCs在生长期开始增殖,并再生新的下一级毛囊,而在其他时期均保持静止状态。HFSCs 作为皮肤及其毛囊组织中心,通过信号传导组织其周围生态位,在成人皮肤及毛囊稳态的各个阶段为生态位重塑提供丰富的信号输出[24]。
3 调节毛囊间充质干细胞活化的生物分子途径
真皮乳头、毛芽和隆突之间的分子相互作用是偶发毛囊再生的核心。毛囊形态的发生取决于Wnt、Shh、Notch以及骨形成蛋白(BMP)在表皮形成细胞与间充质细胞之间的相互作用。成人表皮中经典Wnt途径的持续激活会诱导现有毛囊的生长以及新毛囊的形成,BMP信号参与毛囊形态发生和HFSCs的循环再生,Shh信号控制毛囊的再生和晚期分化,而Notch信号则决定干细胞命运。 这表明Wnt与Shh、Notch及BMP等信号通路之间的协同和拮抗作用在干细胞稳态调节、表皮发育和毛囊再生过程中发挥至关重要的作用,这些途径的失调可能导致毛发生长异常(如雄激素性脱发和斑秃)或者皮肤肿瘤的发生。
3.1 Wnt/β-catenin信号通路
Wnt/β-catenin信号传导是促进HFSCs活化并维持毛囊生长的重要调控途径之一,它可以控制组织形态的发育,并充当调节细胞增殖、分化、迁移和极性等过程的生长因子。研究表明,Wnt10b可以通过 Wnt/β-catenin 信号通路促进毛囊生长和DPCs增殖[25],而Wnt 配体减少或 Wnt 拮抗剂表达增加会诱导鼠毛囊周期的失调并导致脱发[26]。HFSCs中的自分泌Wnt信号传导是维持其干细胞功能所必需的,Wnt/β-catenin通路是毛囊形态发生过程中的中枢信号通路。
3.2 BMP信号通路
成熟毛囊中,HFSCs保持静息状态受到BMP信号的严格控制。休止期,隆突内部的外毛根鞘细胞分泌高水平的BMP6和成纤维细胞生长因子18(FGF18),真皮成纤维细胞表达BMP4,皮下成熟脂肪细胞表达BMP2,这些均作为抑制信号,使HFSCs保持静息状态[27]。而在接近休止期末期时,真皮宏观环境会降低BMP的表达,分泌头蛋白(Noggin,是BMP信号传导的有效抑制剂,拮抗BMP介导的β-catenin抑制作用)、FGF-7、FGF-10和TGF-β2,下调BMP4和BMP2;DPCs关闭HFSCs中的BMP信号传导,开放Wnt/β-catenin信号传导,促进生长期的发生。如果隆突相邻的毛乳头细胞消融,则静止期毛囊不会再次进入毛发周期[28],提示毛乳头细胞在毛囊干细胞激活及毛发再生中的必要性。
在表皮发育过程中,Wnt信号传导独立或协同其它信号传导途径,激活HFSCs并启动毛囊的循环再生。而BMP抑制经典Wnt激活途径, Wnt-BMP信号交互作用是基底层角质形成细胞发育和毛囊生长周期维持必需的调节轴[29]。
3.3 Shh(sonic hedgehog)信号通路
Shh信号传导是Wnt/β-catenin信号传导的下游通路,Shh可通过上调真皮头蛋白的表达促进毛囊生长期发生。毛囊DPCs与外毛根鞘细胞在生长期表达Gli2(glioma-associated oncogene) 因子,Gli2作为Shh信号通路的中间转录因子[30],控制细胞周期调节因子的转录以促进增殖,在上皮稳态及皮肤毛囊发育中起着关键作用,Shh信号通路的激活可诱导静止干细胞增殖和毛发形态发生[31]。近期研究发现皮肤立毛肌和交感神经形成一个双组分生态位,调节HFSCs活动,HFSCs子代细胞分泌Shh信号调节这种立毛肌-交感神经生态位的形成,控制成人毛囊的再生[28],提示Shh信号可以调节HFSCs的交感神经支配,维持这种神经-干细胞相互作用。
3.4 Notch信号通路
真皮Wnt途径上调Notch表达,Notch 信号在多种发育和稳态过程中发挥作用,包括干细胞自我更新和决定细胞命运[32]。在毛囊间表皮(IFE)中,仅在一些增殖的基底层细胞检测到核β-catenin,而Notch1主要在分化的基底上层中表达。Notch受体与其配体结合后激活HFSCs,促进毛囊从静止期向生长期转化, 参与毛发周期调节[32]。Notch1 对于胚胎发生过程中及出生后的毛囊发育后期及毛发稳态维持至关重要,消融毛囊中的Notch1会导致生长期缩短和过早进入退行期[32]。Notch1耗竭会引起毛囊间表皮中Wnt/β-catenin信号上调,将Wnt/β-catenin信号激活限制在表皮基底层。因此,Notch1也可以抑制Wnt/β-catenin信号通路,Wnt和Notch信号之间的协同和拮抗作用似乎决定了皮肤表皮细胞的命运[33]。
4 结语及展望
利用患者自身细胞的可用性和安全性,避免了昂贵的体外细胞控制和细胞扩增,以及符合良好生产规范(GMP)设施的需求,因此,对于毛囊间充质干细胞治疗的研究成为热点。理解毛囊中各类间充质干细胞如何参与毛发生长是阐明脱发疾病机制的先决条件;认识HFSCs生物分子途径在毛发再生中的作用机制,有利于为脱发疾病治疗提供新的线索。然而,由于目前HFSCs的制备技术仍不成熟,其标记物仍缺乏特异性,各种细胞信号途径在不同类型脱发中的作用机制尚未完全阐明,培养的人毛囊间充质干细胞能否确实在人脱发头皮中生成新的毛囊尚不稳定,因此HFSCs在促进毛发再生的临床应用中一直没有令人满意的结果。但基于干细胞的无限自我更新能力和多谱系差异潜力,随着细胞治疗、基因治疗和组织工程的深入研究,相信干细胞在脱发治疗中的应用指日可待。

