微针注射纳米脂肪治疗兔耳增生性瘢痕的初步探讨
卢焱纯 张凯 牛强 丛丙峰 李云鹏 陆斌 张浚睿
增生性瘢痕是由于真皮组织损伤后胶原蛋白异常沉积和重塑而形成[1],常伴随表面皮肤纹理异常及色素沉着,不仅影响美观,还给患者造成社交障碍及心理影响[2]。目前增生性瘢痕的治疗选择包括皮质类固醇治疗、激光治疗和手术切除等,但这些治疗方法未能有效消除多余的瘢痕组织,并再生健康的真皮组织[3]。
近年来自体脂肪在瘢痕治疗中的应用逐渐成为研究热点[4-5]。2013 年,比利时学者Tonnard等[6]提出了纳米脂肪(Nanofat)移植技术,将其注射在真皮浅层可以达到改善瘢痕质地和外观的作用。但其注射方式依旧依靠传统的单针单点多次注射,存在操作时间长,注射层次不均匀等不足[7-10],新的治疗手段亟待开发。
微针作为皮肤科常用的一种给药途径[11-13]。可以穿透表皮屏障,将药液均匀注射于真皮浅层,具有操作时间短,注射层次均匀,患者疼痛不明显等特点[14-15]。本研究旨在将纳米脂肪移植技术和微针治疗的优势相结合,将纳米脂肪通过定深矩阵微针的方式均匀注射于瘢痕内,观察该方法对于增生性瘢痕质地和外观的改善作用,为后续临床应用提供参考。
1 材料与方法
1.1 主要材料及试剂
3 月龄体重约4 kg的雄性新西兰大白兔(空军军医大学第三附属医院实验动物中心提供);新型微针E-Zinjector(广州铂朗公司); qRT-PCR反应试剂盒(Takara公司,日本);Masson三色染色试剂盒(南京森贝伽有限公司);自动细胞计数仪(Beckman Coulter公司, 美国);Real-time PCR仪(Bio-rad公司,美国)。
1.2 方法
1.2.1 细胞活性分析 使用自动细胞计数仪分析纳米脂肪中脂肪干细胞(adipose stem cells,ADSCs)的数量与活性。将微针仪器E-Zinjector和1 mL注射器装载过的纳米脂肪分别装入自动细胞计数仪所配备的量杯内,台盼蓝染料染色,利用自动细胞计数仪检测ADSCs的即刻活细胞数与活细胞率。
1.2.2 建立兔耳瘢痕模型 将8 只新西兰大白兔静脉麻醉后,用手术刀去除耳部表面皮肤、软骨膜等,用纱布及电凝笔止血后暴露创面,并及时清理分泌物,每耳制备直径约为1.5 cm的圆形缺损区2 个,即在同一只兔上建立4 个瘢痕模型。术后肌注青霉素10 万U/kg进行抗炎治疗,每日观测术区瘢痕愈合情况。
1.2.3 制作兔纳米脂肪 将兔麻醉后,在背部做一纵行切口,提取脂肪。将取得的脂肪剪碎后放入注射器内,采用将2 个注射器反复推注30 次的方式,使脂肪充分机械乳化,得到兔纳米脂肪,以供进一步实验使用(图 1)。
1.2.4 瘢痕治疗实验 待创面完全上皮化后,每只兔建立的4 个兔耳瘢痕分别随机采用:微针仪器注射生理盐水(0.9%NaCl+E-Zinjector)、1 mL注射器注射生理盐水(0.9%NaCl+Injector)、1 mL注射器注射纳米脂肪 (Nanofat+Injector)、微针仪器注射纳米脂肪(Nanofat+E-Zinjector)这4 种治疗方法,均等量注射0.2 mL。在使用注射器注射时从瘢痕边缘进针至中间手动缓慢推注。在使用微针仪器注射时,将机器调整为定量注射模式并设定为0.2 mL,然后将微针针头固定在瘢痕正上方,按键即可实现机器自动注射,按照实验分组,分别注射各组预定注射液。

图 1 动物实验流程
1.2.5 兔耳瘢痕取材及组织学检测 瘢痕治疗2 周后取材,将其置于4%多聚甲醛中固定后进行石蜡包埋。通过HE染色,镜下观察拍照来计算瘢痕抬高指数(scar elevation index,SEI),并通过Masson三色染色法来观察瘢痕组织中胶原的增生及排列情况。
1.2.6 实时荧光定量PCR检测 兔耳瘢痕组织取材放入液氮冷冻后,提取组织总RNA, 并测量各组样本RNA的浓度和纯度。采用β-actin为内参,本实验检测的基因序列如表 1。
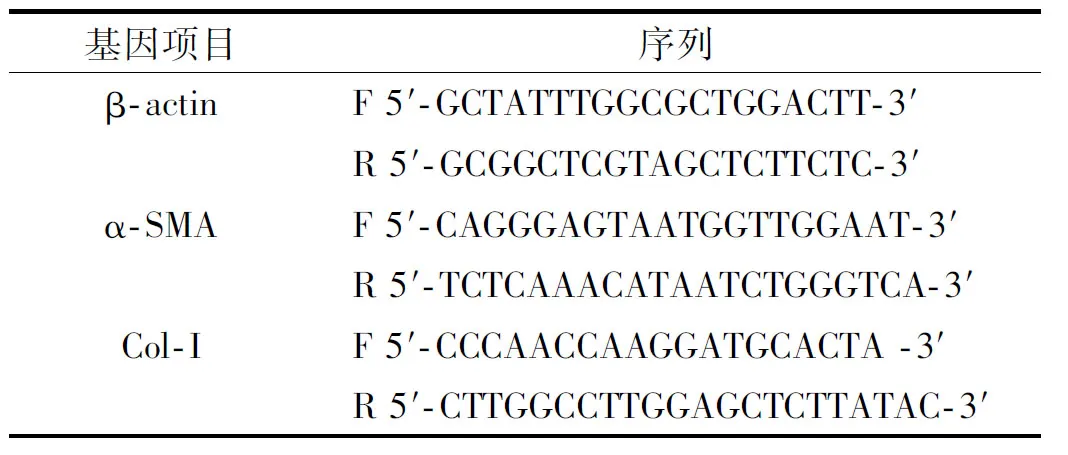
表 1 引物序列
1.3 统计学分析
采用Graphpad Prism 8软件对实验结果进行统计学分析,采用两独立样本t检验进行活细胞数与活细胞率的组间比较,采用随机区组设计方差分析与LSD事后检验进行SEI的组间比较,采用单因素方差分析与LSD事后检验进行基因表达的组间比较。以P<0.05为差异具有统计学意义。
2 结 果
2.1 微针(E-Zinjector)负载的方式对纳米脂肪中ADSCs的活性没有影响
使用自动细胞计数仪检测ADSCs的即刻活细胞数与活细胞率,结果显示(图 2), Nanofat+E-Zinjector组与Nanofat+Injector组的即刻活细胞计数与活细胞率并无显著性差异(P>0.05)。表明微针的负载方式对纳米脂肪中的ADSCs活性无明显影响,因此可以使用E-Zinjector负载纳米脂肪。

图 2 不同负载方式的注射剂即刻活细胞数与活细胞率
2.2 纳米脂肪可有效抑制瘢痕组织增生
兔耳瘢痕模型构建3 周后,肉眼观察可见所有伤口均完全重新上皮化,形成增生性瘢痕。在采用4 种不同治疗方法治疗2 周后,可见0.9%NaCl+E-Zinjector组和0.9%NaCl+Injector组的瘢痕较厚、明显突出于周围正常组织,表面不平整,存在瘢痕挛缩的现象,触摸较为僵硬。而Nanofat+Injector组和Nanofat+E-Zinjector组瘢痕较为平整,质地柔软并逐渐与周围正常组织相似(图 3)。

图 3 兔耳瘢痕治疗前后瘢痕形态
对术区组织进行取材,HE组织学染色结果表明,0.9%NaCl+E-Zinjector组和0.9%NaCl+Injector组瘢痕显著增厚,而Nanofat+Injector组和Nanofat+E-Zinjector组瘢痕类似正常组织厚度,且表面较平坦。通过计算比较SEI值发现,Nanofat+Injector组的SEI值显著低于0.9%NaCl+Injector组(1.28±0.14vs1.62±0.18,P<0.01,n=8),Nanofat+E-Zinjector组SEI值显著低于0.9%NaCl+E-Zinjector组(1.12±0.13vs1.57±0.17,P<0.001,n=8)。此外,Nanofat+E-Zinjector组的SEI值明显低于Nanofat+Injector组(1.12±0.13vs1.28±0.14,P<0.05,n=8),说明使用微针注射纳米脂肪对瘢痕的治疗效果最佳(图 4)。
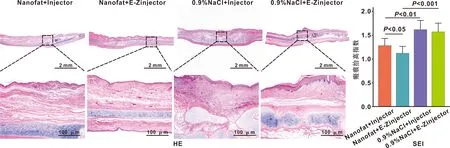
图 4 兔耳瘢痕治疗后的组织学检测结果
采用Masson染色观察胶原增生及排列,可见Nanofat+Injector组和Nanofat+E-Zinjector组胶原较为稀疏且排列整齐有序,而0.9%NaCl+E-Zinjector组和0.9%NaCl+Injector组胶原致密,排列杂乱(图 5)。

图 5 兔耳瘢痕治疗后的组织学(Masson染色)
2.3 纳米脂肪可使瘢痕相关基因表达水平显著下调
qRT-PCR结果显示Nanofat+E-Zinjector组较0.9%NaCl+E-Zinjector组的α-SMA的mRNA表达水平显著降低(P<0.01), 及I型胶原的mRNA表达水平显著降低(P<0.001)。此外Nanofat+E-Zinjector较Nanofat+Injector组的α-SMA的mRNA与I型胶原的mRNA表达水平存在显著性差异(P<0.05),提示微针注射Nanofat的方法更有利于下调瘢痕相关基因的表达水平(图 6)。
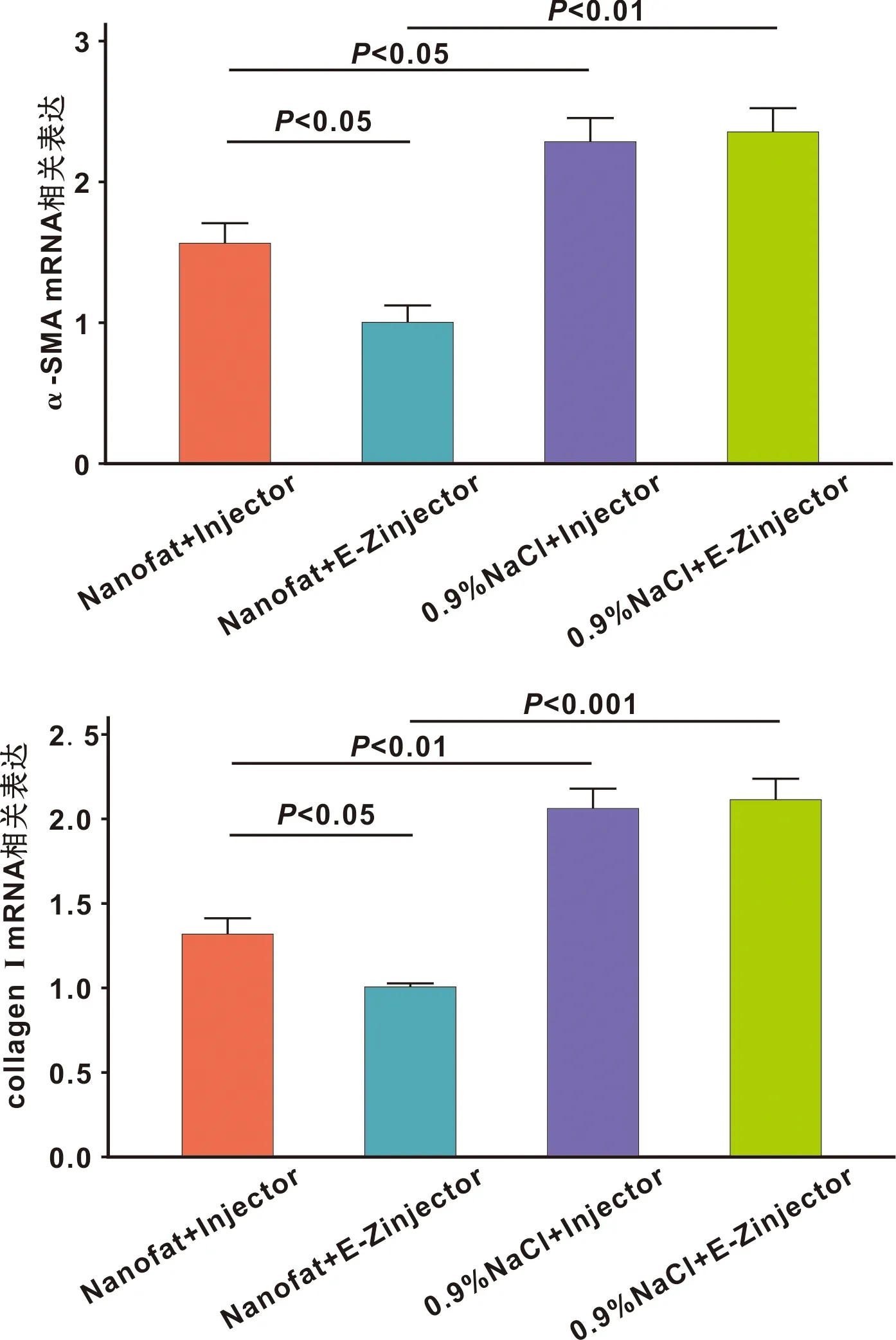
图 6 各组α-SMA及I型胶原mRNA表达
3 讨 论
增生性瘢痕常见于深度创伤、严重烧伤或大创伤手术后, 大多数患者遭受神经性疼痛和瘙痒等症状,预后较差。现有的治疗方案不能满足患者和医生对预后的诉求,临床诊治中迫切需要治疗增生性瘢痕的有效方法[16]。目前纳米脂肪移植在增生性瘢痕中的作用的相关研究较少,具有很大的研究价值。本研究通过构建兔耳增生性瘢痕模型,旨在探究纳米脂肪通过微针注射对增生性瘢痕的治疗效果。研究结果表明,微针的负载方式对纳米脂肪中的ADSCs活性无影响,使用微针E-Zinjector负载纳米脂肪安全可靠,并且微针E-Zinjector及1 mL注射器注射纳米脂肪均能有效抑制瘢痕增生,使瘢痕组织的厚度减少,胶原纤维排列有序,同时瘢痕相关基因α-SMA及I型胶原mRNA表达水平下调,能够促使瘢痕组织向正常组织形态转化。
已有研究表明,纳米脂肪中没有活性的成熟脂肪细胞及正常的脂肪组织结构,但含有大量的ADSCs[17],瘢痕组织的特点是微血管密度低,氧气含量低,慢性缺氧下产生的活性氧(reactive oxygen species,ROS)增强TGF-β1/Smad途径的激活和胶原蛋白的沉积[18-19],而ADSCs分泌的蛋白能保护人类真皮乳头细胞免受ROS引起的细胞毒性损伤[20]。ADSCs还可以通过促进血管生成,诱导常驻组织细胞有丝分裂,并重塑细胞外基质(extracellular matrix,ECM)来抑制纤维化[21-22]。因此,本研究推测纳米脂肪中的ADSCs能够显著改善瘢痕的形成。
基于上述理论基础,本研究还发现,Nanofat+E-Zinjector组的SEI值低于Nanofat+Injector组,并且Nanofat+E-Zinjector组的α-SMA和I型胶原的mRNA表达量较Nanofat+Injector组更低,提示使用微针仪器装载纳米脂肪注射比使用1 mL注射器皮内注射对瘢痕的改善效果更显著。其主要原因在于微针作为一种有效的经皮给药系统(transdermal drug delivery systems,TDDS) 能够直接穿透皮肤并以更少的创伤创建微通道[14],在对纳米脂肪进行注射时,微针仪器可以调节注射速度,使纳米脂肪中的ADSCs以一定量的液体运动速度注入皮肤瘢痕,产生的液流是层流为主而不是湍流[23],在这种情况下细胞所受的压力、剪切力较小,不会发生裂解,使得纳米脂肪能够得到充分利用。其次因为微针仪器有多个定深且呈矩阵状排列的细针头,可以使纳米脂肪注射于增生性瘢痕后,呈均匀分布,增强其治疗效果。已有研究证明将曲安奈德(TA)和5-氟尿嘧啶(5-FU)制成双相溶解微针来治疗增生性瘢痕比这两种药物的混悬剂皮内多次注射的效果好,且患者痛苦少,依从性高[24]。因此本研究将纳米脂肪装载于微针仪器中进行瘢痕治疗实验,能够更有效地减少瘢痕组织形成,促进正常组织再生。
另外,微针注射的方式在实际临床治疗中具有良好的可行性和操作便利性。相较于传统注射器注射,其优势在于操作时间短,还可以根据医生的需求进行定量及定速输注,同时注射时阻力小,患者疼痛程度减轻。
综上所述,利用E-Zinjector负载纳米脂肪能够有效结合微针递送和纳米脂肪再生的优势,有效抑制增生性瘢痕,具有临床应用价值。

