骨髓间充质干细胞分泌细胞外囊泡对大鼠软骨细胞影响的初步研究
袁平平 吕守印 马晓婷 程雯 吴炜 韶波
头颈部因外伤、先天性畸形和肿瘤切除造成的软骨缺损重建仍然是一个临床挑战。自体软骨移植虽然是一种常见且成功的治疗方法,但对患者有伤害,手术中也难免要牺牲部分软骨组织保证形态[1]。因此建立一种可替代的移植方法是非常必要的。随着组织工程技术的发展,使用体外扩增细胞重建软骨成为可行的方法[2]。间充质干细胞(mesenchymal stem cells, MSCs)是一种多能干细胞,具有自我复制、多向分化和免疫调控等特点,且拥有取材方便、易体外扩增的优点。大量研究表明,间充质干细胞的再生作用可能是由其来源的囊泡(extracellular vesicles derived from mesenchymal stem cells,MSCs-EVs)介导的旁分泌作用完成的[3]。MSCs-EVs可能通过受体-配体相互作用,传递表面受体、信号分子、生物活性脂质、miRNAs、mRNA等至靶细胞,从而调控靶细胞的功能[4]。多项研究表明,MSCs-EVs具有与MSCs相似的功能,并可作为MSCs的替代品,用于多种炎症性疾病、视网膜缺血再灌注损伤和骨缺损的治疗[5-7]。
组织工程化软骨移植物的构建中,种子细胞的选择是至关重要的。在本研究中,发现BMSCs-EVs通过其携带的miRNA可以增强共培养软骨细胞(chondrocytes,CHs)的增殖和迁移能力。这有望为软骨组织工程提供新的思路,改善组织工程化软骨移植物的培养方式。
1 材料与方法
1.1 主要试剂和仪器
α-MEM培养基、DMEM培养基、青霉素链霉素、胰蛋白酶、磷酸盐缓冲液(PBS)(HyClone公司,美国);胎牛血清(Gibco公司,美国);II型胶原酶(Worthington公司,美国);成脂诱导培养基、成骨诱导培养基和成软骨诱导培养基(赛业生物科技有限公司);DAPI(北京索莱宝科技有限公司);TruSeqTMRNA样品制备试剂盒(Illumina公司,美国);共聚焦激光扫描显微镜、光学显微镜、透射电镜(Olympus,日本);超速离心机(Beckman公司,美国);凝胶电泳系统(Bio-Rad,美国);BCA蛋白浓度定量试剂盒(上海碧云天)。
1.2 细胞来源和鉴定
原代BMSCs取自3 周雄性SD大鼠,麻醉处死后无菌环境下取出股骨并切断两端骨骺,用培养基将骨髓冲出,细胞传至P3代后使用。显微镜下观察细胞形态,流式细胞仪检测细胞表面标志物。分别使用成脂诱导培养基、成骨诱导培养基和成软骨诱导培养基(cyagen biosciences)培养BMSCs, 21 d后分别进行油红O染色、茜素红染色和阿利新蓝染色,评价BMSCs向脂肪细胞、骨细胞和软骨细胞的分化能力。
CHs取自3周雄性SD大鼠,麻醉处死后取膝关节,无菌条件下分离周围组织,剥下软骨剪碎,II型胶原酶(worthington)消化后培养,细胞传至P3代后使用。
1.3 BMSCs-EVs的分离及鉴定
利用超速离心法进行BMSCs-EVs的分离,BMSCs培养24 h后收集上清,4 ℃,1 500 g离心10 min清除死亡细胞和细胞碎片,离心后取上清,4 ℃,5 000 g离心15 min,取上清100 000 g离心30 min,取上清140 000 g离心60 min,弃上清, 5 mL PBS重悬后140 000 g离心60 min,弃上清,加入200 μL PBS重悬得到纯化的BMSCs-EVs,-80 ℃保存。
形态学分析:将纯化后的BMSCs-EVs滴在铜网上,利用透射电镜(JEM-1230,JEOL)对BMSCs-EVs进行观测并拍照。
纳米颗粒追踪分析(NTA):用粒子矩阵ZetaView PMX 110在405 nm 发射光下将分离得到的BMSCs-EVs进行浓度测定。
表面特征标志物分析:用蛋白质印记法检测CD63(1∶1 000,Abcam), CD9(1∶1 000,Abcam),TSG101(1∶5 000,Abcam)外泌体标志蛋白。
1.4 CHs增殖检测
用BMSCs-EVs(20 μg, 40 μg)处理CHs,以无血清培养基培养CHs作为空白对照组。培养24 h后,CHs在4%多聚甲醛中固定30 min,5%Triton 100通透20 min, 10%的山羊血清(Boster)封闭60 min,然后4 ℃条件下孵育Ki67(1∶200, Abcam)过夜。PBS洗涤3 次后37 ℃避光孵育二抗(1∶500)30 min。DAPI(Solarbio)染细胞核5 min。用共聚焦激光扫描显微镜(FV1000, Olympus)观察并拍照。
1.5 CHs迁移能力检测
划痕实验:将CHs接种于6 孔板中,培养至100%融合, 用1 mL移液器枪头垂直于孔板划痕,用PBS清洗划痕过程中脱落的细胞,并用光学显微镜(IX71, Olympus)拍照记录0 h痕迹。加BMSCs-EVs(20 μg, 40 μg)和无血清培养基(Hyclone), 24 h后记录同一划痕位置下宽度的变化,并计算划痕愈合率。
Transwell实验:在24 孔板中加BMSCs-EVs(20 μg,40 μg)和无血清培养基, 将软骨细胞接种于Transwell上室, 24 h后取出上室,加入4%多聚甲醛固定30 min, 0.1%结晶紫染色20 min,将小室置于光学显微镜下,拍照并计算穿过小室膜的细胞数目。
1.6 蛋白质印记法(Western blot,WB)
使用WB检测增殖相关蛋白的表达水平,将CHs接种于6 孔板中,用BMSCs-EVs(20 μg, 40 μg)处理CHs 24 h,以无血清培养基培养CHs作为空白对照组。提取CHs蛋白,蛋白通过凝胶电泳(Bio-Rad)被分离,然后移至PVDF膜上,室温下用5%的脱脂牛奶封闭膜60 min,TBST清洗后加入Cyclin D1(1∶5 000)、Axin 2(1∶1 000)、 β-actin(1∶5 000,Abcam)孵育过夜,TBST清洗3 次,二抗孵育60 min,TBST清洗3 次, 增强型化学发光剂显色,Image J(1.52a)检测灰度值。
1.7 BMSCs-EVs的miRNA测序(miRNA-seq)
使用TruSeqTMRNA样品制备试剂盒(Illumina)提总RNA,按照TruSeqTMRNA样品制备指南合成双末端文库。然后用PCR对产物进行纯化和富集,以创建最终的cDNA文库。纯化文库通过Qubit®2.0荧光计(Life Technologies,美国)进行定量,并通过Agilent 2100生物分析仪(Agilent Technologie,美国)进行验证,以确认插入物大小并计算摩尔浓度。用cBot生成聚类,稀释至10 pmol/L,然后在Illumina NovaSeq 6000上进行测序。
利用miRDB数据库对高表达的top20 个miRNA进行靶基因预测,然后用R包clusterProfiler、enrichplot、ggplot2对靶基因进行基因本体分析(gene ontology,GO)和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。
1.8 统计学分析
使用Prism 9软件(GraphPad Prism)进行数据分析, Student-t检验进行统计学分析,当P<0.05结果被认为具有统计学意义。
2 结 果
2.1 BMSCs形态学观察及鉴定结果
原代的BMSCs呈长梭形,集落性生长(图 1A)。经过诱导后具有向成骨(图 1B)、成脂(图 1C)及成软骨分化的能力(图 1D)。流式细胞鉴定结果表明,表达 CD29、CD44 的细胞分别占总细胞数的96.1%、95.4%,表达 CD34、CD45的细胞总细胞数占比分别为3.5%、1.8%(图 1E),该结果说明实验所提取原代BMSCs具有干细胞特性。

图 1 体外培养的大鼠BMSCs的鉴定
2.2 BMSCs-EVs的鉴定及内吞观察
透射电镜结果显示,BMSCs-EVs具有典型的双层膜结构,大小均匀,直径约150 nm(图 2A)。囊泡特征标记蛋白CD9、CD63和TSG101均有表达(图 2B)。NTA提示BMSCs-EVs直径在175 nm左右(图 2C),均符合细胞外囊泡鉴定标准。将BMSCs-EVs与CHs共培养, 24 h后显示EVs被CHs内吞,并分布于细胞核周围,证明EVs可成功进入CHs内(图 2D)。
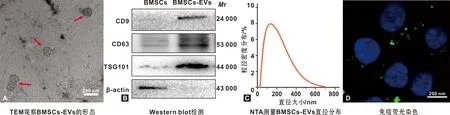
图 2 BMSCs-EVs的鉴定
2.3 BMSCs-EVs对CHs增殖的影响
用BMSCs-EVs(20 μg, 40 μg)处理CHs, 24 h后用Ki67免疫荧光染色法检测BMSCs-EVs对CHs增殖的影响。结果如图 3A示BMSCs-EVs组 CHs增殖数量较无血清培养组均明显增加,并且40 μg BMSCs-EVs组CHs染色阳性高于20 μg BMSCs-EVs组,结果具有统计学意义(P<0.01)(图 3B)。WB结果表明:与无血清培养组相比增殖相关蛋白Cyclin D1,Axin2表达水平在BMSCs-EVs组均升高(P<0.01)(图 3C~D),说明BMSCs-EVs可以促进CHs的增殖。
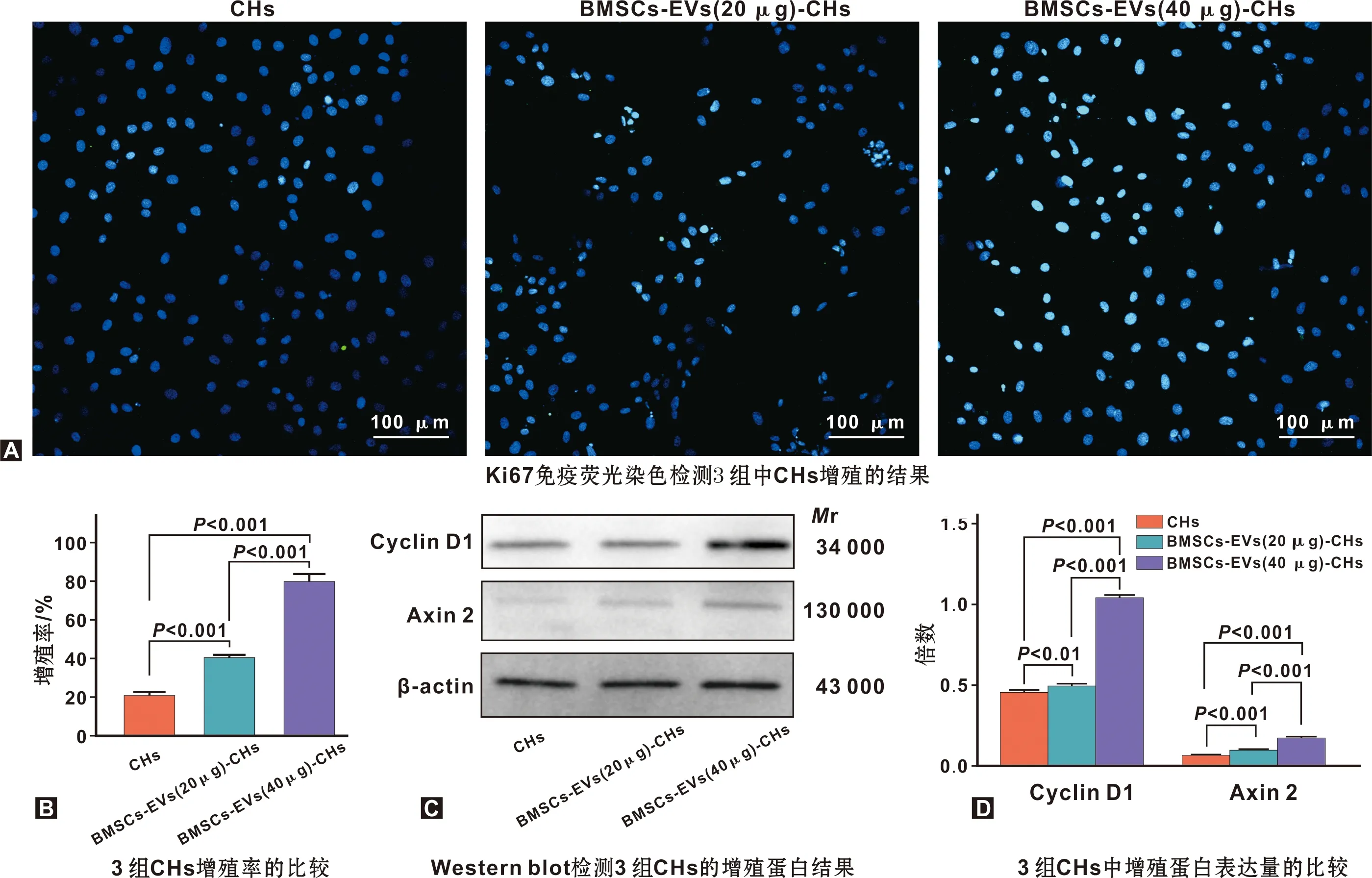
图 3 CHs增殖活性检测
2.4 BMSCs-EVs对CHs迁移的影响
用划痕愈合实验检测BMSCs-EVs(20 μg, 40 μg)对CHs迁移的影响。 24 h 后20 μg BMSCs-EVs组CHs的划痕愈合率为85.31%±2.89%, 40 μg BMSCs-EVs组的划痕愈合率为98.29%±0.70%,无血清培养组的划痕愈合率为59.83%±2.79%,明显低于BMSCs-EVs组,差异具有统计学意义(P<0.01)(图 4A~B)。
使用Transwell法检测BMSCs-EVs对CHs迁移能力的影响。结晶紫染色结果(图 4C)显示,与无血清培养组相比,BMSCs-EVs(20 μg, 40 μg)处理CHs,CHs迁移能力增强,差异具有统计学意义(P<0.01)(图 4D)。
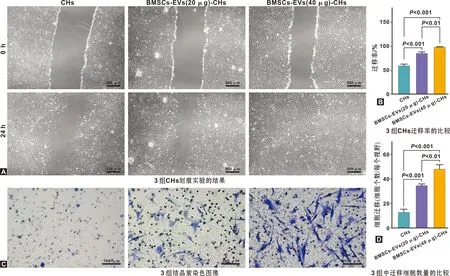
图 4 各组CHs迁移能力比较
2.5 BMSCs-EVs的miRNA分析及生物信息学分析
miRNA-seq结果显示了BMSCs-EVs中总计数最高的20 个高丰度miRNAs(图 5A),并对其靶基因进行了功能富集分析,KEGG结果表明基因富集在Wnt信号通路、细胞黏附和细胞周期相关信号通路上(图 5B)。GO分析显示在生物过程中参与形态发生的发育生长、肌动蛋白细胞骨架组织的调节显著(图 5C)。总之,这些结果表明来自BMSCs-EVs的miRNAs可能参与调控软骨细胞增殖与迁移。
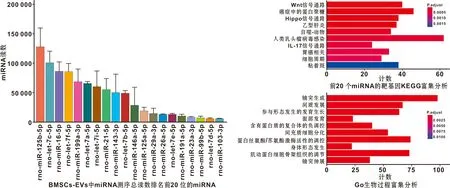
图 5 BMSCs-EVs的miRNA分析及生物信息分析
3 讨 论
在软骨组织修复中,单独使用自体CHs,单独使用BMSCs或两种细胞共同培养作为种子细胞都有过报道[8]。然而,CHs属于增殖能力较弱的终末细胞传代能力受限;而MSCs定向分化比较复杂且不稳定,分化后的CHs易出现退化和衰老。两种细胞共培养目前仍存在一些问题, 共培养的方法、时间及两种细胞的比例均会影响最终软骨修复的效果[9]。
MSCs在各种疾病中的治疗应用拓宽了人们对MSCs-EVs的认识。与其亲代细胞相比,MSCs-EVs对受体组织再生、免疫调节和炎症控制体现了其对MSCs的功能替代性,而低免疫原性和安全储存性则赋予它更好的临床应用前景。EVs通过把携带的内容物传递给受体细胞,进而影响细胞的微环境并调节相关蛋白的表达[10-11]。已有文献报道牙龈间充质干细胞分泌的微囊泡调节TGF-β1与JAK2-STAT1信号通路的交互作用发挥了抗炎和免疫调节作用[12]。角质形成细胞分泌囊泡可以促进成纤维细胞迁移和增殖,从而促进伤口愈合[13]。然而BMSCs-EVs是否对CHs也有同样积极的作用是解决干细胞/软骨细胞培养缺点的关键。在本研究中通过内吞实验证明BMSCs-EVs可以被CHs内化摄取。免疫荧光染色,蛋白印记分析证实了BMSCs-EVs与CHs共培养后,CHs的增殖能力增强,通过划痕实验和迁移实验证明CHs迁移增强并呈剂量依赖性。miRNA-seq结果展示BMSCs-EVs携带大量miRNA,对这些miRNA靶基因功能富集分析后KEGG结果表明基因富集在Wnt信号通路。而Wnt信号通路是影响细胞增殖的重要通路[14]。本研究结果表明,BMSCs-EVs可能通过释放miRNA调节CHs的迁移和增殖。但目前尚不清楚哪些miRNA发挥了核心作用。后续要进一步明确BMSCs-EVs促进CHs迁移和增殖的具体信号通路和明确的分子靶点,并增加动物模型进行验证。
综上所述,BMSCs-EVs可促进CHs的增殖与迁移,进而可能有利于共移植软骨细胞及组织的再生,有望为组织工程软骨再生提供新思路。

