身上联合身下型加温毯在胸腔镜肺癌根治术患者术中的应用效果
陈晓晶 陈韡 吴秋庭
福建省莆田市第一医院手术室,福建莆田 351100
胸腔镜肺癌根治术往往手术复杂,故手术时间较长,在此过程中,由于手术室内温度较低,且患者体表、体腔暴露,短时间大量输入液体等原因引起患者出现术中低体温[1]。研究表明,低体温可减慢麻醉药物代谢速度延长苏醒时间,同时增加手术应激反应,加重伤口感染,影响患者恢复[2]。目前临床上可采用身上或身下加温毯进行加温,但在胸腔镜肺癌根治术中患者采取侧卧位,体表皮肤暴露多,接触面积小,常导致加温毯子覆盖不彻底,加温效果不佳[3]。而身上联合身下型加温毯可最大程度地对患者实施保温,可全面缩小患者皮肤表面温差,减少散热,可能有助于改善胸腔镜肺癌根治术中患者低体温症状。基于此,莆田市第一医院手术室进行探讨身上联合身下型加温毯在胸腔镜肺癌根治术患者术中维持体温的应用效果。
1 资料与方法
1.1 一般资料
选取莆田市第一医院2020年8月至2021年6月收治的165例胸腔镜肺癌根治术患者作为研究对象,按照随机数字表法分为A组(n=55)、B组(n=55)和C组(n=55)。A组中,男31例,女24例;年龄40~65岁,平均(55.36±6.43)岁;核心体温36.0~37.0℃,平均(36.57±0.36)℃;美国麻醉医师协会(American Association of Anesthesiologists,ASA)[4]:Ⅱ级29例,Ⅲ级26例;手术时间210~270 min,平均(244.52±26.73)min。B组中,男30例,女25例;年龄40~65岁,平均(55.27±6.37)岁;核心体温36.0~37.0℃,平均(36.59±0.29)℃;ASA分级:Ⅱ级28例,Ⅲ级27例;手术时间210~270 min,平均(245.19±25.96)min。C组中,男32例,女23例;年龄40~65岁,平均(55.45±6.56)岁;核心体温36.0~37.0℃,平均(36.58±0.34)℃;ASA分级:Ⅱ级30例,Ⅲ级25例;手术时间210~270 min,平均(245.26±26.47)min。三组患者基线资料比较,差异无统计学意义(P>0.05),具有可比性。本研究已取得医院伦理委员会批准(伦理号:2020-017),患者及家属同意并签署知情同意书。
纳入标准:①均行胸腔镜肺癌根治术;②术前核心体温为36.0~37.5℃;③手术时间180~270 min;④ASA分级为Ⅱ~Ⅲ级。
排除标准:①急诊手术;②术前服用过影响体温的药物,如β-受体阻滞剂;③机体代谢功能异常。
1.2 方法
三组患者入室时室温为22~24℃,湿度为55%~60%,身上覆盖棉被或毯子,静脉输液温度维持在36~38℃,体腔冲洗液温度维持在37~40℃。三组患者术中进行不同的加温方式,密切监测患者核心体温,若核心体温>37.5℃时,需暂停加温仪,若核心体温<36℃时,需调节加温仪至高档(41℃)。在手术过程中,对患者进行深静脉穿刺、导尿或改变体位时,可将加温毯下移至髋关节部位或暂停,避免妨碍手术操作。
A组予以身上型加温毯(上海寰熙医疗,型号ASTOPAD),即患者入室后于身上全部覆盖加温毯,并调节加温仪至中档(38℃),若无异常维持至手术结束。
B组予以身下型加温毯(上海寰熙医疗,型号DUO120),即患者进入手术前5 min,在手术床上铺以加温毯,并调节加温仪至中档(38℃)进行预热,若无异常维持至手术结束。
C组予以身上联合身下型加温毯,即同时采用A组及B组的干预措施,进行两个部位的术中加温。
三组患者均观察至出院。
1.3 观察指标和评价标准
观察三组患者不同时间节点核心体温变化、手术及复苏指标以及不良反应。①不同时间节点核心体温变化:采用一次性医用鼻咽温探头检测三组患者入室时、手术开始时、手术开始90 min、手术开始180 min以及手术结束时的核心体温。②手术及复苏指标:记录三组患者术中出血量、拔管时间(手术结束至呼唤患者能睁眼,且恢复自主呼吸,潮气量≥7 ml/kg,可进行拔管操作)以及完全清醒时间(手术结束至患者可送出复苏室)。③不良反应:术中及术后观察三组患者低体温、寒战、躁动及手术部位感染发生情况。
1.4 统计学方法
采用SPSS 22.0统计学软件进行数据分析,计量资料采用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;等级资料采用秩和检验;计数资料采用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。计数资料组间两两比较采用Bonferroni法进行比较,以P<0.0167为差异有统计学意义。
2 结果
2.1 三组患者不同时间节点核心体温变化的比较
入室时,三组患者的核心体温比较,差异无统计学意义(P>0.05)。手术开始至手术结束时不同时间节点三组患者的核心体温比较,差异有统计学意义(P<0.05)。手术开始至手术结束时不同时间节点C组核心体温均高于A组和B组,差异有统计学意义(P<0.05)(表1)。
表1 三组患者不同时间节点核心体温变化的比较(℃,±s)
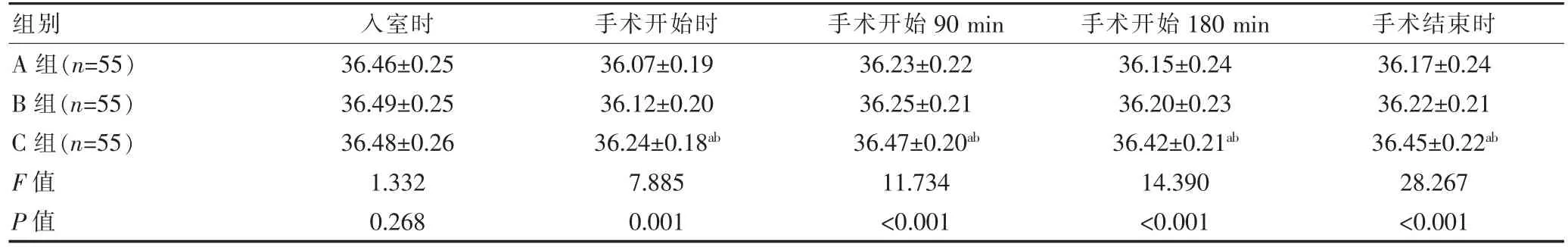
表1 三组患者不同时间节点核心体温变化的比较(℃,±s)
注与A组比较,aP<0.05;与B组比较,bP<0.05
组别入室时手术开始时手术开始90 min手术开始180 min手术结束时A组(n=55)B组(n=55)C组(n=55)F值P值36.46±0.25 36.49±0.25 36.48±0.26 1.332 0.268 36.07±0.19 36.12±0.20 36.24±0.18ab 7.885 0.001 36.23±0.22 36.25±0.21 36.47±0.20ab 11.734<0.001 36.15±0.24 36.20±0.23 36.42±0.21ab 14.390<0.001 36.17±0.24 36.22±0.21 36.45±0.22ab 28.267<0.001
2.2 三组患者手术及复苏指标的比较
三组患者术中出血量、拔管时间、完全清醒时间比较,差异有统计学意义(P<0.05)。且C组术中出血量少于A组和B组,C组术中拔管时间、完全清醒时间短于A组和B组,差异有统计学意义(P<0.05)(表2)。
表2 三组患者手术及复苏指标的比较(±s)
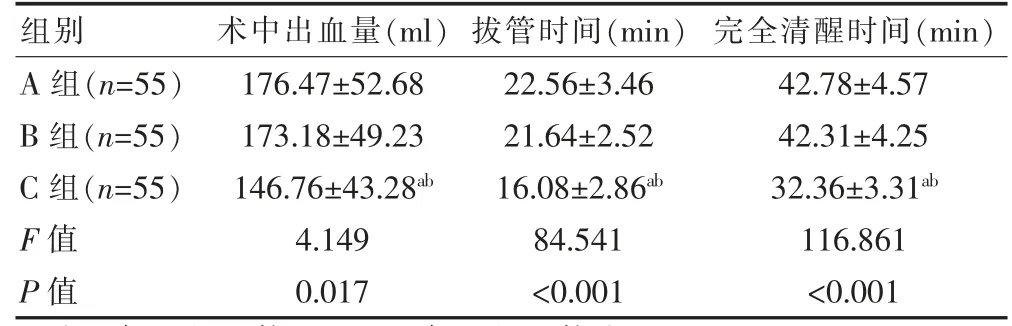
表2 三组患者手术及复苏指标的比较(±s)
注与A组比较,aP<0.05;与B组比较,bP<0.05
组别术中出血量(ml)拔管时间(min)完全清醒时间(min)A组(n=55)B组(n=55)C组(n=55)F值P值176.47±52.68 173.18±49.23 146.76±43.28ab 4.149 0.017 22.56±3.46 21.64±2.52 16.08±2.86ab 84.541<0.001 42.78±4.57 42.31±4.25 32.36±3.31ab 116.861<0.001
2.3 三组患者不良反应的比较
三组患者不良反应总发生率比较,差异有统计学意义(P<0.05)。C组不良反应总发生率低于A组和B组,差异有统计学意义(P<0.016 7)(表3)。
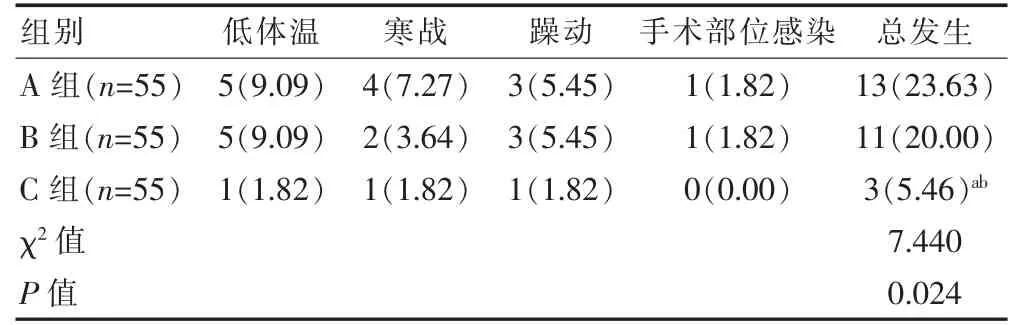
表3 三组患者不良反应的比较[n(%)]
3 讨论
胸腔镜肺癌根治术患者由于麻醉药物的使用、体表皮肤暴露过多、室温输液及冲洗液等因素,导致机体体温调节机制受损,从而使机体热量重新分布,产热减少、散热增加,进而发生术中低体温[5]。而术中低体温会引起机体外周血管收缩,组织氧供减少,免疫力降低等,增加手术风险,不利于术后麻醉苏醒[6]。因此,为预防术中低体温发生,可采用身上或身下加温毯加温法,可在一定程度上减少热量丢失,但由于术中患者消毒暴露、体温转换等原因,导致单一进行加温毯加温时无法有效维持体温恒定[7]。而身上联合身下加温毯可同时利用热空气对流的原理进行身上及身下两大区域的加温,可能对胸腔镜肺癌根治术患者术中维持体温恒定效果更好。
在本研究中,手术开始至手术结束时不同时间节点内,C组核心体温均高于A组和B组,差异有统计学意义(P<0.05),提示身上联合身下型加温毯用于胸腔镜肺癌根治术患者术中可有效维持体温恒定。可能的原因是在胸腔镜肺癌根治术中,麻醉药物的使用会影响中枢神经调节外周血管及全身体温调节机制,从而使机体体温进行再分布,引起全身体温下降[8-9],而身上联合身下型加温毯可通过提前预热床单位,加温身体表面等操作,隔断机体内热量向外环境扩散,有效减少体温下降幅度。胸腔镜肺癌根治术中开胸时,患者体位为侧卧位,此时体表与床单的接触面积较小,同时其上半身大部分处于消毒区域,热量流失较多,且身上型毯无法对患者上半身加温,而身上联合身下型加温毯可避免此类情况,其覆盖面积较大,不仅可以对双下肢及足部加温,减少体内热量流失,还可以确保患者与身下床单位接触面的加温,有效提高皮肤温度,维持体温上升。在柏艳芳等[10]的研究中也指出,上下联合保温治疗可维持全腔镜三切口食管癌根治术患者术中体温恒定,可证实上下联合保温治疗的效果。
在本研究中,C组术中出血量少于A组和B组,C组术中拔管时间、完全清醒时间短于A组和B组,差异有统计学意义(P<0.05),提示身上联合身下型加温毯用于胸腔镜肺癌根治术患者术中可减少术中出血量,缩短患者苏醒时间。可能的原因是胸腔镜肺癌根治术中患者体温过低不仅会引起机体代谢速率变慢,抑制肝酶活性,影响麻醉药物代谢,延长患者苏醒时间,而且还会产生各种手术应激反应,影响患者肾上腺素、血小板等水平,从而使血流动力学改变[11-13]。而身上联合身下型加温毯可协同升温,为机体提供有效的热传递,减少体内热量流失,从而降低机体应激反应,改善血小板形态,减少出血;同时可加快生理代谢,提高麻醉药物代谢速率,缩短患者术后苏醒时间,改善苏醒质量[14-15]。
胸腔镜肺癌根治术中,因使用麻醉药、外科手术皮肤暴露、手术室环境温度和大量输液等因素,引起机体产热减少,散热增加,从而出现轻度低体温,其中寒战是抵抗低温的保护性反射,可增加机体产热[16]。同时研究显示[17],术中低体温可使手术部位感染概率增加。在本研究中,C组不良反应总发生率低于A组和B组,差异有统计学意义(P<0.016 7),提示身上联合身下型加温毯用于胸腔镜肺癌根治术患者术中可降低不良反应发生率。可能的原因是身上联合身下型加温毯在患者身上加温毯与身下加温毯之间形成热空气环绕于身体未暴露区域,不仅可以使其周围局部空气温度升高,通过辐射、对流的方式将热量传递于患者体表,还可以隔绝手术室的冷空气,降低热量消耗,进而维持体温或升温,从而避免低体温、寒战、伤口感染等不良反应发生。
综上所述,身上联合身下型加温毯用于胸腔镜肺癌根治术患者术中可有效维持体温恒定,减少术中出血量,缩短患者苏醒时间,且不良反应发生率更低,值得推广。但本研究方法对其他疾病手术患者术中体温的影响,还需进一步进行研究验证。

