赤芍酒制前后化学成分差异及镇痛作用研究Δ
胡锦华,翁丽丽,武艳雪,陈天丽(长春中医药大学药学院,长春 130117)
赤芍为毛茛科植物芍药Paeonia lactifloraPall.或川赤芍P.veitchiiLynch的干燥根,具有清热凉血、散瘀镇痛的功效,是临床治疗妇女痛经的常用药[1]。赤芍苦辛,性微寒,入肝经,善于凉血活血。清朝汪昂的《本草备要》曰:“酒炒用(制其寒)。妇人血分醋炒,下痢后重不炒”。从炮制作用来看,酒赤芍可以缓和药性,令寒转温,也可活血化瘀,引药上行[2]。现代药理学研究表明,赤芍含有单萜及其糖苷类、三萜类、黄酮类、鞣质类、酚酸类等化学成分,对原发性痛经模型大鼠有较好的镇痛作用[3]。现代医学认为痛经的发病机制与雌激素及机体内炎症因子等的水平有关,西医临床药物通常通过抑制前列腺素来缓解痛经症状,但都有不同程度的不良反应和临床应用的局限性[4]。因此临床上常采用中西医结合的方法或联合疗法治疗痛经,赤芍作为痛经要药具有重要的研究意义。
目前,有关赤芍酒制后活性成分及药理作用的变化缺乏系统研究,本试验采用超高效液相色谱-四极杆飞行时间质谱(UPLC-Q-TOF-MS)技术进行系统的定性定量分析,对比赤芍酒制前后化学成分及含量差异;同时以痛经模型大鼠为研究对象,采用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法检测其子宫组织匀浆中前列腺素F2α(prostaglandin F2α,PGF2α)、孕酮、一氧化氮(nitric oxide,NO)、β-内啡肽的含量,旨在探讨赤芍生品和酒制品镇痛作用的差异,为酒赤芍的临床应用提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括Q-TOF SYNAPT G2 HDMS型Waters Acquity UPLC仪(美国Waters公司)、JA2603B型千分之一电子天平(上海天美天平仪器有限公司)、FA1004B型万分之一电子天平(上海佑科仪器仪表有限公司)、Multiskan Sky型全波长酶标仪(美国Thermo Fisher Scientific公司)、Legend Micro型离心机(德国Eppendorf公司)等。
1.2 主要药品与试剂
赤芍饮片(批号HML20190722-03)购自吉林国安药业有限公司,经长春中医药大学中药鉴定教研室翁丽丽教授鉴定为毛茛科植物芍药P.lactifloraPall.的干燥根。大鼠PGF2α、孕酮、β-内啡肽ELISA试剂盒(批号均为202106)均购自江苏酶免实业有限公司;NO测定试剂盒(批号A013-2-1)购自南京建成生物工程研究所;苯甲酸雌二醇注射液(批号20210201,规格2 mL∶4 mg)购自宁波第二激素厂;缩宫素(批号20210407,规格2 mL∶10单位)购自吉林省华牧动物保健品有限公司;布洛芬缓释胶囊(阳性对照药物,批号2003241,规格0.3 g)购自中美天津史克制药有限公司;乌来糖(批号BSF210509)购自合肥巴斯夫生物科技有限公司;黄酒购自吉林省大洋酒业有限公司;水为蒸馏水。
1.3 动物
SPF级Wistar雌性大鼠42只,8周龄,体质量230~250 g,购自辽宁长生生物技术股份有限公司,实验动物生产许可证号为SCXK(辽)2020-0001。动物实验经长春中医药大学实验动物伦理委员会批准,批准编号为2021218。
2 方法与结果
2.1 酒赤芍的制备
参照课题组前期研究工艺[5],取赤芍饮片,加黄酒拌匀(每100 g赤芍用黄酒14 g),闷润35 min,再于120 ℃下炒制20 min,即得酒赤芍。
2.2 赤芍酒制前后化学成分的分析
2.2.1 供试品溶液的制备 将赤芍饮片和酒赤芍饮片粉碎成粗粉,各取约0.5 g,精密称定,分别置于具塞锥形瓶中,精密加入甲醇25 mL,称质量后浸泡4 h,超声(功率250 W,频率40 kHz)处理20 min,放冷,再称质量后用甲醇补足减失的质量,摇匀,滤过,即得赤芍供试品溶液和酒赤芍供试品溶液,置于4 ℃保存备用。
2.2.2 UPLC-Q-TOF-MS分析条件 色谱条件如下:以Nano ChromCore 120 C18(2.1 mm×50 mm,1.8 μm)为色谱柱,以乙腈为流动相A、0.1%甲酸溶液为流动相B进行梯度洗脱(0~5 min,8%A;5~10 min,8%A→15%A;10~15 min,15%A→22%A;15~20 min,22%A→30%A;20~25 min,30%A→60%A;25~30 min,60%A→80%A;30~35 min,80%A→100%A;35~40 min,100%A;40~41 min,100%A→8%A;41~50 min,8%A);流速为0.3 mL/min;柱温为25 ℃;进样量为5 μL。质谱条件如下:采用正、负离子检测模式,电离源温度为80 ℃,去溶剂气温度为150 ℃;锥孔气和去溶剂气均为氮气,流速分别为40、500 L/h;毛细管电压为3.0 kV,锥孔电压为40 V,提取锥孔电压为5.0 V;扫描范围为100~1 000 amu,扫描时间为0.2 s。利用甲酸钠建立质量轴标准曲线,以亮氨酸脑啡肽进行质量校正以确保质量精度和重现性。使用串联方法进行分析时,使用氩气作碰撞气,低碰撞能为10 eV,高碰撞能为30 eV。
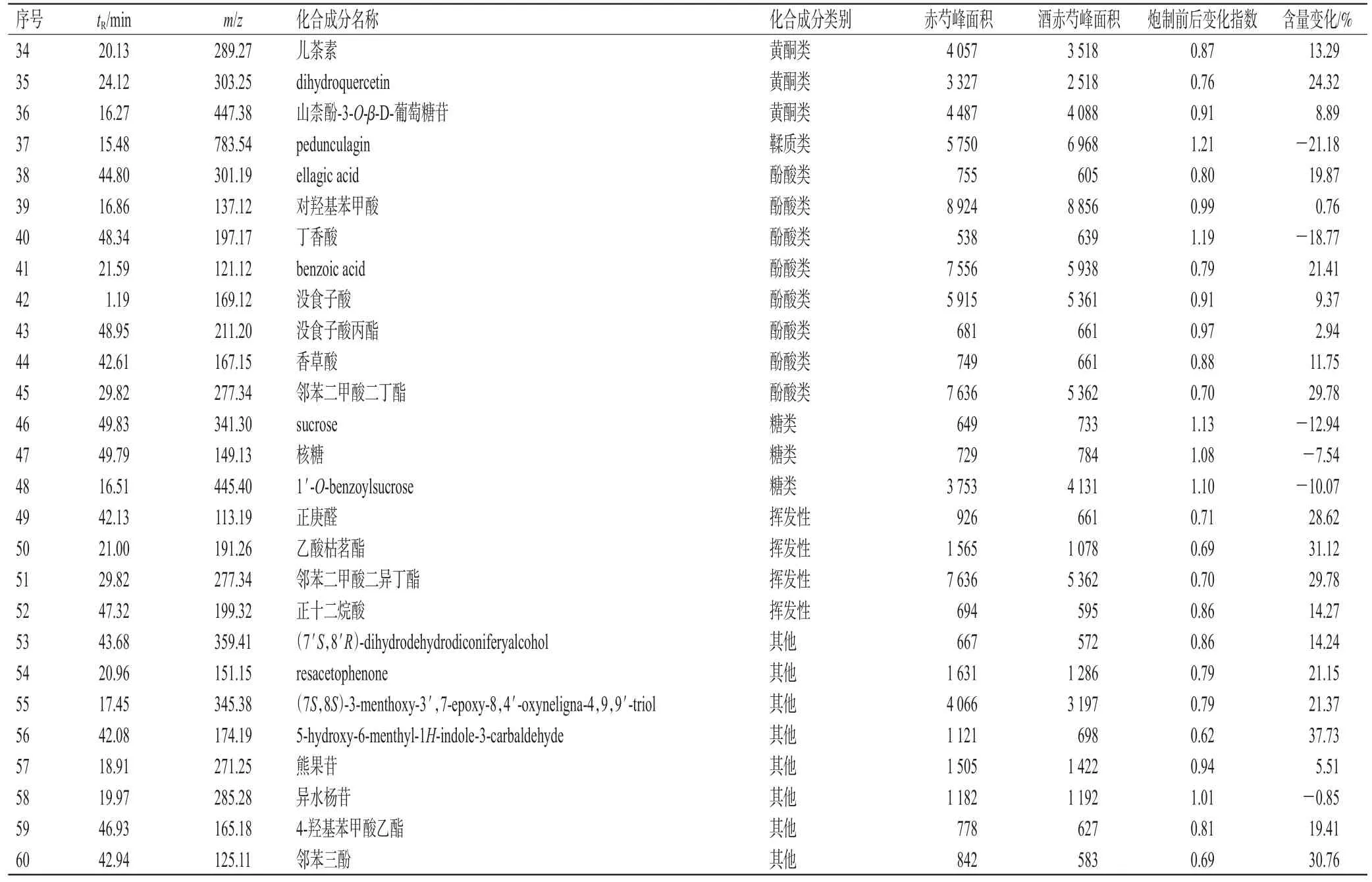
2.2.3 赤芍酒制前后化学成分的分离鉴定 应用UPLC-Q-TOF-MS技术,按“2.2.2”项下条件对赤芍与酒赤芍进行检测,总离子流图(图1)显示,在正、负离子模式下,赤芍和酒赤芍中各化学成分的分离度均较好、响应均较高。基于UNIFI科学信息系统,结合文献数据和在线数据库对比,赤芍与酒赤芍在正、负离子模式下均鉴定出60个化学成分(表1),其中,在正离子模式下均分离鉴定出6个化学成分,包括2个鞣质类成分,1个三萜类成分,3个挥发性成分;在负离子模式下均分离鉴定出54个化学成分,包括24个单萜及其糖苷类成分,3个三萜类成分,3个黄酮类成分,1个鞣质类成分,8个酚酸类成分,3个糖类成分,4个挥发性成分,8个其他类成分。

表1 赤芍酒制前后化学成分含量差异分析结果
续表1
2.2.4 赤芍酒制前后化学成分含量差异的分析 按以下公式计算“2.2.3”项下鉴定出的60个化学成分的炮制前后变化指数(表1),炮制前后的变化指数=酒赤芍离子峰面积/对应保留时间的赤芍离子峰面积。该值接近1表示此离子峰对应的化学成分炮制前后含量相近,该值大于1表示此离子峰对应的化学成分炮制后含量增加,该值小于1表示此离子峰对应的化学成分炮制后含量减少[6]。结果显示,赤芍酒制后,除芳樟醇、peduncula‐gin、丁香酸、sucrose、核糖、1′-O-benzoylsucrose、异水杨苷7个成分含量增加以外,其他成分含量均有所降低。炮制后总相对含量[(酒赤芍峰面积-赤芍峰面积)/赤芍峰面积×100%]增加最多的为糖类成分,增加了10.08%;总相对含量降低最多的为三萜类成分,降低了33.02%,降低最少的为单萜及其糖苷类成分,降低了11.44%。
2.3 赤芍酒制前后对痛经模型大鼠的镇痛作用考察
2.3.1 赤芍和酒赤芍药液的制备 取赤芍饮片或酒赤芍饮片适量,分别加6或8倍(mL/g)水煮2次,每次1 h,过滤,合并滤液,制成质量浓度为1、0.25 g/mL(以生药量计)的药液,置于4 ℃保存备用。
2.3.2 阳性对照药液的制备 取布洛芬缓释胶囊内容物适量,加水充分混匀,配制成质量浓度为0.6 mg/mL的混悬液,即得。
2.3.3 统计学方法 采用SPSS 21.0软件对数据进行统计分析,数据用±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
2.3.4 动物分组、造模与给药 将42只大鼠随机分为空白组、模型组、阳性对照组(布洛芬0.072 mg/g[7])和赤芍低、高剂量组(0.005、0.01 mg/g,以生药量计[8])以及酒赤芍低、高剂量组(0.005、0.01 mg/g,以生药量计[8]),每组6只。实验开始前所有大鼠适应性饲养5 d。本实验通过苯甲酸雌二醇联合缩宫素复制大鼠痛经模型[9]。模型组和给药组大鼠连续皮下注射苯甲酸雌二醇14 d,第1天和第14天注射剂量为1 mL/100 g,其余12 d注射剂量为0.5 mL/100 g,每日1次;空白组大鼠同法皮下注射等体积生理盐水。从注射苯甲酸雌二醇第5天开始,空白组和模型组大鼠灌胃蒸馏水,给药组大鼠分别灌胃相应药液,每日1次,连续11 d。各组大鼠于末次注射苯甲酸雌二醇24 h后干预给药,再过30 min后,每只大鼠腹腔注射缩宫素2 μg,完成痛经模型的复制。
2.3.5 大鼠体质量的变化 记录各组大鼠实验期间的体质量。结果显示,与空白组比较,模型组大鼠体质量呈逐渐下降的趋势,至第15天体质量下降22%;各给药组大鼠体质量呈先下降后升高的趋势,从第5天开始体质量下降趋势变小,且均高于模型组。
2.3.6 大鼠扭体潜伏期的变化 记录各组大鼠注射缩宫素后的扭体潜伏期(腹部收缩内凹,伸展后肢)。结果(图2)显示,与空白组比较,模型组大鼠的扭体潜伏期显著缩短(P<0.05)。与模型组比较,各给药组大鼠的扭体潜伏期(除赤芍低剂量组外)均显著延长(P<0.05),其中赤芍高剂量组和酒赤芍低剂量组大鼠的扭体潜伏期与阳性对照组接近。2.3.7 大鼠子宫组织匀浆中镇痛相关指标的变化 扭体潜伏期记录后,各组大鼠腹腔注射20%乌来糖(0.6 mL/100 g),待麻醉后剥离出子宫,洗去血渍,用滤纸吸干。取子宫组织0.3 g,加3 mL冰冷生理盐水,制备成10%子宫组织匀浆,置于-80 ℃冷藏保存备用。按照试剂盒说明书测定各组大鼠子宫组织匀浆中PGF2α、孕酮、NO、β-内啡肽的含量。结果(图3)显示,与空白组比较,模型组大鼠子宫组织匀浆中PGF2α含量显著升高(P<0.05),孕酮、NO、β-内啡肽含量均显著降低(P<0.05)。与模型组比较,各给药组大鼠子宫组织匀浆中PGF2α(除赤芍低剂量组外)均显著降低,孕酮(除赤芍低、高剂量组外)、NO(除赤芍低、高剂量组外)、β-内啡肽含量均显著升高(P<0.05)。
3 讨论
本研究运用UPLC-Q-TOF-MS技术采集质谱数据,分析化学成分信息得出,赤芍与酒赤芍中化学成分种类相同(均为60个),但是含量有差异。赤芍酒制后,萜类、黄酮类成分均有所减少,其中指标性成分芍药苷含量降低4.93%。赤芍味苦微寒,根据中医药基础理论,赤芍具有的清热凉血作用与苦味中药“能泄、能燥、能坚”作用相符,而中药的苦味与其所含的生物碱类、萜类、黄酮类等成分有关[10]。儿茶素是赤芍苦涩味的来源之一,酒制后儿茶素含量减少13.29%,这与炮制理论中酒赤芍清热凉血力稍缓、炮制改变药性相一致[11]。酒制后糖类成分有所增加,其中sucrose增加最多。其他类成分中的芳樟醇、pedunculagin、丁香酸、异水杨苷含量均有所升高。
痛经本质在于气血变化,而病机的关键在瘀,祛瘀则病症消[12]。痛经的发病机制与前列腺素、NO等变化有关。NO对痛经具有双向调节作用,含量升高可抑制子宫收缩,含量降低则可加重子宫收缩[13]。本研究通过考察赤芍酒制前后对痛经模型大鼠镇痛作用的影响,发现与模型组比较,赤芍高剂量组和酒赤芍低、高剂量组大鼠的扭体潜伏期均显著延长,子宫组织匀浆中PGF2α均显著降低,β-内啡肽含量均显著升高;酒赤芍低、高剂量组大鼠子宫组织匀浆中孕酮、NO含量均显著升高。由此可见,酒赤芍的镇痛作用较赤芍效果好。结合赤芍酒制前后化学成分变化推测,酒赤芍镇痛作用较赤芍效果更好,这可能与芳樟醇、pedunculagin、丁香酸、su‐crose、核糖、1′-O-benzoylsucrose、异水杨苷含量变化有关。
综上所述,本研究发现酒赤芍对痛经模型大鼠的镇痛效果优于赤芍生品,这可能与赤芍酒制后芳樟醇、pe‐dunculagin、丁香酸等7个成分的含量升高有关。

