桃核承气汤化瘀泻热“性-效”相关物质基础研究Δ
舒万芬,刘文,宋信莉,刘兴德,张甘纯,秦琴,王洪鑫(.贵州中医药大学药学院,贵阳 55005;.贵州医科大学药学院,贵阳 55005)
中药药性理论是中药的核心理论之一,也是中医药研究的基础[1]。药性的“四气”“五味”是中医药理论对人体生物效应的总体概括和对药物功能属性的抽象描述,可通过“组分-机体状态-效应”表征[2]。历代医家都遵循中药药性理论来指导临床遣方用药,“寒者热之,热者寒之,辛以散之,苦则泻之”理论是中医临床辨证论治的重要依据。随着研究思路的创新和研究方法的进步,越来越多的学者基于中药药性“可拆分、可组合”的思想[3],利用现代技术对中药成分进行拆分和解析以明确其药性属性[4―5],但由于缺少药效学指标与药性的关联性分析,因此尚无法揭示发挥生物效应的物质与中药药性功效之间的关系。
桃核承气汤出自汉代张仲景的《伤寒论》,由大黄、芒硝、桃仁、桂枝、甘草5味中药组成,主治瘀热互结于下焦之蓄血证,为现代中医临床常用的活血化瘀经典方剂。本研究基于中药药性“可拆分、可组合”的思想,以经典名方桃核承气汤为例,将中药复方按其单味药药性进行拆分组合,通过药效学指标来表征其药性相关生物效应;随后,采用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱(ultra-performance liquid chromatographyquadrupole-orbitrap high-resolution mass spectrometry,UPLC-Q-Exactive-MS)法对优势药性组成分进行鉴定,并借助AutoDock工具进行分子对接,对中药复方“性-效”相关物质基础进行分析,为中药药性理论的现代研究提供新思路。
1 材料
1.1 主要仪器
本研究所用主要仪器包括Sysmex CS5100-2型全自动凝血分析仪(希森美康生物科技有限公司)、Multshan Sky型多功能酶标仪(新加坡Life Technologies公司)、BSC-250型恒温培养箱(上海博迅实业有限公司医疗设备厂)、Q ExactiveTM型UPLC-Q-Exactive-MS仪(美国Thermo Fisher Scientific公司)、Pannoramic 250型数字切片扫描仪(匈牙利3DHISTECH公司)等。
1.2 主要药品与试剂
大黄、桃仁、桂枝、甘草、芒硝饮片(批号分别为20121401、20200108、201001、200801、191201)均购自北京同仁堂贵阳药店有限公司,经贵州中医药大学药学院孙庆文教授鉴定均为真品,且符合2020年版《中国药典》(一部)的相关要求[6]。
脂多糖(LPS)原料药(批号408Z036,纯度≥98%)购自北京索莱宝科技有限公司;肿瘤坏死因子α(tumor ne‐crosis factor-α,TNF-α)、C反应蛋白(C reactive protein,CRP)、内皮素1(endothelin-1,ET-1)试剂盒(货号分别为ZC-37624、ZC-36085、ZC-37024)均购自上海茁彩生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号20220317)购自南京建成生物工程研究所;甲醇、乙腈、甲酸为色谱纯,其余试剂均为分析纯,水为蒸馏水。
1.3 实验动物
本实验使用SPF级雄性SD大鼠,6~7周龄,体质量为(220±10)g,购自辽宁长生生物技术股份有限公司,动物生产许可证号为SCXK(辽)2020-0001。所有大鼠均被饲养于约25 ℃且通风良好的饲养间内,自由摄食、饮水。大鼠适应性饲养1周后,进行后续实验(取材前禁食、不禁水24 h)。实验方案遵循贵州中医药大学有关实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 基于蓄血证模型的动物实验
2.1.1 分组与造模 将54只大鼠随机分为空白组、模型组、全方组、苦寒组、辛温组、甘平组,每组9只。除空白组外,其余各组大鼠遵循Shwartzman反应原理,按2.5 mL/kg的剂量,以尾静脉注射LPS溶液(以生理盐水为溶剂,质量浓度为20 mg/L)2次(间隔24 h)的方式复制蓄血证大鼠模型[7―8]。
2.1.2 给药 根据2020年版《中国药典》(一部)中各单味药的药性[6],对桃核承气汤进行药性拆分,将大黄和芒硝归为苦寒组,将甘草归为甘平组,将桂枝归为辛温组。参阅古代医籍,《千金食治》曰桃仁“味苦甘辛无毒”,《本草通玄》载桃仁“甘辛微温”,《日华子本草》提出桃仁性“热”,《黄帝内经》云“治寒以热,治热以寒,桃仁为活血化瘀药,用于经闭痛经,症瘕痞块……血得温则行,得寒则凝。”可见,古人认为桃仁的药性为温热性。结合2020年版《中国药典》(一部)内容和桃仁的现代药理作用研究[6,9―10],本研究将桃仁归为辛温组。
本课题组通过前期研究得桃核承气汤的物质基准处方量为17.29 g/kg(大黄-芒硝-桃仁-桂枝-甘草质量比为4∶2∶1∶2∶2)[11]。遵循“经典名方基于原方”的原则,根据其物质基准的制备方法,按上述质量比称取大黄、芒硝、桃仁、桂枝、甘草饮片细粉,加12倍量水回流提取1 h×3次,低温减压浓缩至适当浓度后冷冻干燥(每1 g全方组、苦寒组、辛温组、甘平组干燥物分别相当于生药总量0.48、0.51、0.23、0.50 g)。灌胃前,用水稀释,制成相应灌胃药液。各药物组大鼠灌胃相应药液(全方组、苦寒组、辛温组、甘平组的给药剂量分别为17.29、9.43、4.71、3.14 g/kg,均以生药量计;剂量按物质基准的临床剂量换算),空白组和模型组大鼠灌胃生理盐水,灌胃体积均为10 mL/kg。各组大鼠均预干预7 d,再分别于第1次造模前2 h、第1次造模后12 h、第2次造模前2 h、第2次造模后0.5 h灌胃相应药液或生理盐水。
2.1.3 肝组织病理观察 为了检验模型是否建立成功(即肝细胞形态结构是否完整正常、静脉内皮细胞是否完整、有无炎症细胞浸润或坏死、肝窦有无明显扩张、是否瘀血等[12]),取造模后各组大鼠的肝组织(空白组大鼠取相同部位肝组织)适量,以生理盐水洗涤后用4%多聚甲醛溶液固定,常规修剪、脱水、包埋、切片,以苏木精-伊红(HE)染色,封片后进行镜检,观察其肝组织病理变化。
结果(图1)显示,与空白组大鼠比较,模型组大鼠肝组织门管区及肝窦可见轻微的炎症细胞浸润,并可见局部门管区轻微扩张和淋巴细胞或中性粒细胞聚集,提示该组大鼠肝组织微血管处于反应性紊乱失调状态,蓄血证模型建立成功。与模型组比较,除甘平组外,其余各药物组大鼠肝组织上述病理学异常均有一定程度改善,具体表现为淋巴细胞或中性粒细胞聚集减少,局部门管区扩张不明显或无扩张。
2.1.4 凝血指标检测 根据文献报道,各项凝血、炎症指标在第2次注射LPS后2 h左右到达峰值[13]。基于此,本研究于第2次注射LPS 2 h后,深度麻醉大鼠(每组随机选6只),于其腹主动脉取血4 mL,置于枸橼酸钠抗凝管中,分离上层血浆,采用固定法以全自动凝血分析仪检测凝血酶原时间(prothrombin time,PT)、凝血酶原活动度(prothrombin activity,PTA)、活化部分凝血活酶时间(activated partial thrombin time,APTT)、纤维蛋白原(fibrinogen,FIB)、凝血酶时间(thrombin time,TT)。同时,在同一时间点于大鼠腹主动脉取血5 mL,置于普通采血管中,分离上层血清,采用酶联免疫吸附测定(ELISA)法以全自动酶标仪于450 nm波长下检测血清ET-1含量。上述实验均严格按相应试剂盒说明书操作。实验数据以±s表示,采用SPSS 26.0软件进行单因素方差分析,检验水准α=0.05(统计学方法下同)。
结果(表1)显示,与空白组比较,模型组大鼠PT、ET-1含量均显著延长或升高(P<0.01),PTA、APTT、FIB、TT均显著缩短或降低(P<0.01)。与模型组比较,全方组、苦寒组、辛温组大鼠PT和全方组、辛温组、甘平组大鼠ET-1含量均显著缩短或降低(P<0.05或P<0.01);全方组、苦寒组、辛温组大鼠PTA,全方组、辛温组大鼠APTT,以及各药物组大鼠FIB、TT均显著延长或升高(P<0.05或P<0.01)。可见,全方组和辛温组大鼠各凝血指标均显著改善,提示全方发挥抗凝化瘀作用可能与方中辛温药材的相关程度最高。
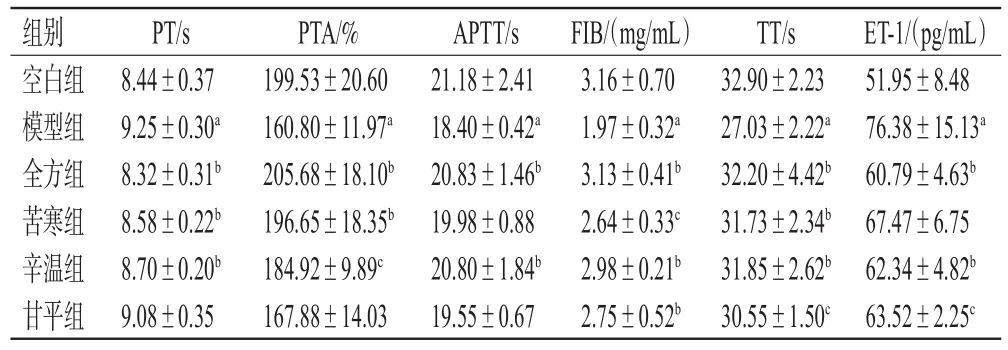
表1 桃核承气汤及其药性拆分成分对模型大鼠凝血指标的影响(x±s,n=6)
2.1.5 炎症指标检测 在“2.1.4”项下同一时间点于大鼠腹主动脉取血5 mL,置于普通采血管中,分离上层血清,采用ELISA法以全自动酶标仪于450 nm波长下检测各组大鼠血清中CRP、TNF-α含量和SOD抑制率。上述实验均严格按相应试剂盒说明书操作。
结果(表2)显示,与空白组比较,模型组大鼠血清CRP、TNF-α含量均显著增高(P<0.01),SOD抑制率显著降低(P<0.01)。与模型组比较,全方组和苦寒组大鼠血清CRP、TNF-α含量均显著降低(P<0.05或P<0.01),SOD抑制率均显著升高(P<0.05或P<0.01);此外,甘平组大鼠TNF-α含量和SOD抑制率也均有显著改善(P<0.05或P<0.01)。可见,该方的抗炎泻热作用主要来源于方中的苦寒药材。
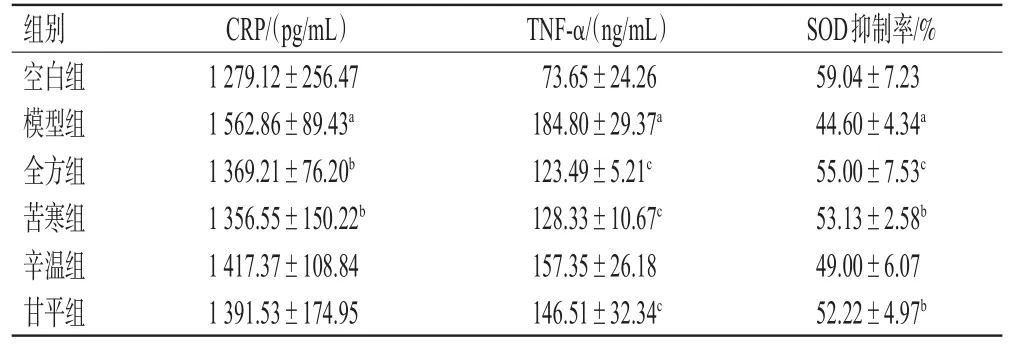
表2 桃核承气汤及其药性拆分成分对模型大鼠炎症指标的影响(x±s,n=6)
2.1.6 凝血、炎症指标分析 利用SIMCA-P软件对凝血、炎症指标数据进行标准化处理,随后以空白组和模型组为基准,以药性拆分组与基准组之间的距离为主要因素,以药性拆分组图形离散程度为次要因素,进行离散度趋势分布分析和偏最小二乘法-判别分析(partial least squares-discriminant analysis,PLS-DA)。结果见图2、图3。基于越接近空白组、越远离模型组则该组的性质越趋于空白组的原则,可得出各给药组的化瘀药效依次为全方组>辛温组>苦寒组>甘平组,泻热药效依次为全方组>苦寒组>甘平组>辛温组,即辛温组的抗凝作用较好,苦寒组的抗炎作用较好,两者为优势药性组。
2.2 优势药性组的成分鉴定
2.2.1 供试品溶液的制备 根据药性拆分组的生物效应研究结果,取优势药性组(辛温组、苦寒组)各单味药细粉,按“2.1.2”项下方法制备相应提取物。取上述提取物各1 g,置于25 mL容量瓶中,加甲醇溶解并定容,制成相应供试品溶液,经0.22 μm微孔滤膜滤过,备用。
2.2.2 色谱条件 以 ACQUITY UPLC BEH C18(2.1 mm×50 mm,1.7 μm)为色谱柱,以0.1%甲酸溶液(B)-乙腈(C)为流动相进行梯度洗脱(0~20.0 min,5%C→40%C,20.0~33.0 min,40%C→90%C;33.0~35.0 min,90%C;35.0~35.1 min,90%C→5%C;35.1~40.0 min,5%C);流速为0.2 mL/min;柱温为30 ℃;进样量为2 μL。
2.2.3 质谱条件 采用电喷雾离子源(electrospray ionization,ESI)进行正、负离子模式切换扫描;鞘气为氮气,流速为10.5 L/min;辅助气为氮气,流速为3.0 L/min;毛细管温度为550 ℃;喷雾电压为3.5 kV;离子扫描范围为m/z120~1 000。
2.2.4 成分鉴定 取“2.2.1”项下各供试品溶液适量,按“2.2.2”“2.2.3”项下条件进行 UPLC-Q-Exactive-MS分析,得总离子流图(图略)。利用Xcalibur软件在质量偏差<5 ppm的范围内提取各成分的元素组成并进行一级、二级质谱解析,通过参考相关文献[14―18],从辛温组样品图谱中共鉴定出32个活性成分,包括木兰花碱、羟基酪醇、脱落酸、苦杏仁苷、草夹竹桃苷、白果内酯、球腺糖苷A、甘草苷、对羟基肉桂酸、原花青素B1、原儿茶酸、右旋奎宁酸、二氢槲皮素等;从苦寒组样品图谱中共鉴定出35个化学成分,包括7-甲氧基-4-甲基香豆素、芦荟大黄素、黄芩素、香豆素、紫花前胡醇、去甲蟛蜞菊内酯、大黄素、大黄素甲醚、尼泊金乙、松柏醛、刺芒柄花素、黄豆黄素、羟基芫花素、淫羊藿素、L-苯丙氨酸、L-酪氨酸、原儿茶醛等。
2.3 靶点获取与分子对接
2.3.1 “化瘀”和“泻热”相关靶点的获取 为使所获靶点能与“2.1”项下药效学研究结果互证,本研究以“pro‐thrombin”“thrombin”“fibrinogen”“endothelin-1”“C reac‐tive protein”“tumor necrosis factor-α”“superoxide dis‐mutase”为关键词,在 UniProt数据库(https://www.uni‐prot.org/)中检索与凝血指标(PT、PTA、APTT、FIB、TT、ET-1)、炎症指标(CRP、TNF-α、SOD)密切相关的蛋白,并在RCSB PDB数据库(https://www.rcsb.org/)中筛选出与上述药效指标相对应的基因,随后选取该基因的低分辨率构象作为对接受体。按上述方法筛选,共得到凝血指标相关靶点6个,分别为F2(PT)、F9(PTA)、F11(TT)、AT3(TT)、FGA(FIB)、EDN1(ET-1),构象分别为5NHU、3KCG、7MBO、2B5T、1FZD、1T7H;共得到炎症相关靶点5个,分别为CRP(CRP)、LITAF(TNF-α)、TNF(TNF-α)、SOD1(SOD)、SOD2(SOD),构象分别为3PVN、AF-Q99732-F1-model-v2、2E7A、2XJK、1PL4。
2.3.2 活性化合物的准备及分子对接 以“2.2.4”项下鉴定出的辛温组、苦寒组药材成分为目标成分,将其CAS号输入TCMSP数据库(https://tcmsp-e.com)和Swiss Target Prediction数据库(http://www.swisstargetpredic‐tion.ch/),以口服生物利用度≥30%为标准[19],分别从辛温组、苦寒组药材成分中筛选出可作为对接配体的成分13、17个。
利用Pymol软件获取“2.3.1”项下受体的对接口袋信息,使用AutoDock Vina软件进行对接并使用TBtools软件和Pymol软件绘制对接结果热图。结果(图4)显示,配体与受体结合较好(即结合能≤-5.0 kcal/mol,1 kcal=4.186 kJ)[20]的辛温组成分有10个,苦寒组成分有13个。
使用Pymol软件绘制出对接结合能最小的“成分-靶点”空间构象。以辛温组药材成分脱落酸(图5A)为例,其与凝血指标相关靶点FGA活性位点(1FZD构象)的氨基酸残基PHE-769之间存在疏水作用,与氨基酸残基TRY-816、GLU-782、ASN-667之间存在氢键。以苦寒组药材成分黄芩素(图5B)为例,其与炎症指标相关靶点CRP活性位点(3PVN构象)的氨基酸残基RPO-206之间存在π-π共轭,与氨基酸残基TRP-205、GLN-203之间存在氢键。
3 讨论
《伤寒论》中将外邪入血称作蓄血证,其病机一则为瘀,二则为热,是太阳表邪不解,邪气入里化热,继而由各种原因引起的瘀血与邪热互结的临床证候的统称。目前,研究者多采用细菌或细菌内毒素(如LPS,属于中医的热邪、毒邪)干预的方法来复制蓄血证动物模型。研究表明,蓄血证与凝血功能、炎症反应密切相关,故这两项指标的检测是蓄血证诊断的重要依据[21]。
本研究复制了瘀热互结的蓄血证大鼠模型,病理观察结果显示,模型组大鼠肝组织表现出局部血液凝集的瘀热互结现象。给予桃核承气汤及其药性拆分成分干预后,全方组和辛温组大鼠的凝血指标(PT、PTA、APTT、FIB、TT、ET-1)全部得到明显改善,全方组和苦寒组大鼠炎症因子(CRP、TNF-α、SOD)的释放得到明显抑制;结合离散度趋势分布分析和PLS-DA结果发现,该方化瘀的物质基础来自辛温组药材,泻热的物质基础来自苦寒组药材,即辛温组、苦寒组为优势药性组。
有研究指出,辛温之性药材可温经通脉以助化瘀,能使血液流变学及血流动力学异常得以改善,是化瘀作用的表现;苦寒之性药材大多为疏下之药,既能清除里热,又能下瘀,使热随大便而出,是泻热效应的表现[22―23]。为进一步明确辛温组化瘀和苦寒组泻热的物质基础,本研究采用UPLC-Q-Exactive MS技术从辛温组中鉴定出32个化合物,从苦寒组中鉴定出35个化合物。随后,利用分子对接技术,最终筛选出结合能≤-5.0 kcal/mol的辛温组成分10个(脱落酸、羟基酪醇、原花青素B1等)、苦寒组成分13个(黄芩素、芦荟大黄素、去甲蟛蜞菊内酯等),提示上述成分分别为两组“性-效”相关的关键物质。
笔者在研究中还发现,甘平组药物也显示出仅次于苦寒组的抗炎泻热效应。中医认为,平性药是药性平和、作用力和缓、功效及应用范围比较广泛的一类药物;现代研究认为,该类药物含有黄酮类、萜类、甾体类、糖类等成分,具有“双向适用,条件显性”的药性特点[24]。但本研究仅结合药效学结果对优势药性组的成分进行了分析,并未考虑甘平组药材,也未考虑全方共煎的成分变化,故有待后续研究予以完善,以进行更深层次的药性与药效物质基础研究。

