加速溶剂萃取-气相色谱-串联质谱法同时测定种植土壤中6种广谱杀菌类农药的残留量
路瑞娟 ,孙志洪 ,张 丽 ,郭伟伟
(1.沧州市生态环境保护科学研究院,沧州 061000;2.河北省沧州生态环境监测中心,沧州 061000;3.沧州市生态环境监控中心,沧州 061000)
农作物在培育、种植期间,常受到各种病虫害的影响,导致农作物产量降低甚至颗粒无收,给种植户带来较大经济损失。因此,在农作物种植期间,常通过施用农药来预防病虫害[1-2]。具有广谱杀菌性能的农药主要有吡唑醚菌酯、戊唑醇、氟硅唑、氟菌唑、肟菌酯和百菌清等,这类农药杀菌效果好、药效持久,在农作物种植过程中使用频率较高。在施用农药时,大部分农药会残留在土壤中,破坏土壤微生物系统,进而影响生态环境安全[3-6]。为有效保护环境和保障人饮食安全,有必要监控土壤中农药的残留量[7-9]。相关检测方法较多,如文献[10]研究了吡唑醚菌酯在杨梅和土壤中的残留及消解动态,文献[11]以超高效液相色谱-串联质谱法测定肟菌酯和戊唑醇在稻田土中的残留量。但是涉及的广谱杀菌类农药种类较单一,不能较好地反映当地土壤中广谱杀菌类农药的残留水平。鉴于此,本工作以加速溶剂萃取法提取种植土壤中6种广谱杀菌类农药(吡唑醚菌酯、戊唑醇、氟硅唑、氟菌唑、肟菌酯和百菌清),以气相色谱-串联质谱法(GC-MS/MS)测定其含量,可为了解当地土壤环境污染情况提供技术参考。
1 试验部分
1.1 仪器与试剂
GCMS-TQ 8030型质谱仪:GC-2010型气相色谱仪,配AOC-20i自动进样器;Dionex ASE 350型加速溶剂萃取仪:M32 型氮吹仪;弗罗里硅土固相萃取柱(1 g/6 mL)。
吡唑醚菌酯(SB05-293-2015)、戊唑醇[GBW(E)083263]、氟硅唑[GBW(E)081710]、氟菌唑(SB05-353-2016)、肟菌酯[GBW(E)082952]、百菌清[GBW(E)083175]的单标准溶液:质量浓度均为100 mg·L-1。
混合标准储备溶液:10 mg·L-1,取100 mg·L-1的吡唑醚菌酯、戊唑醇、氟硅唑、氟菌唑、肟菌酯和百菌清的单标准溶液各1 mL,用正己烷定容至10 mL容量瓶中,摇匀备用。
混合标准溶液系列:取适量混合标准储备溶液,用正己烷逐级稀释,配制成质量浓度分别为0.05,0.1,0.5,1.0,2.0 mg·L-1的混合标准溶液系列。测定前,各取1 mL 与已氮吹至近干的空白样品溶液混合,摇匀,即得基质匹配混合标准溶液系列。
乙腈、丙酮、正己烷均为色谱纯;无水硫酸钠和硅藻土为分析纯。
1.2 仪器工作条件
1.2.1 色谱条件
Rtx-5MS色谱柱(30 m×0.25 mm,0.25μm);进样口温度240 ℃;进样量1μL;载气为氦气,纯度99.999%;载气流量1.5 mL·min-1;脉冲不分流进样,2.0 min后打开分流阀和隔垫吹扫阀。柱升温程序:初始温度为50 ℃,保持1.0 min;以25 ℃·min-1升 温 至150 ℃,保 持1.0 min;以15 ℃·min-1升温至280 ℃,保持15.0 min。
1.2.2 质谱条件
电子轰击离子(EI)源;轰击能量70 eV;接口温度280 ℃,离子源温度250 ℃;碰撞气为氩气,纯度99.999%;多反应监测(MRM)模式;溶剂延迟时间3.0 min。其他质谱参数见表1。
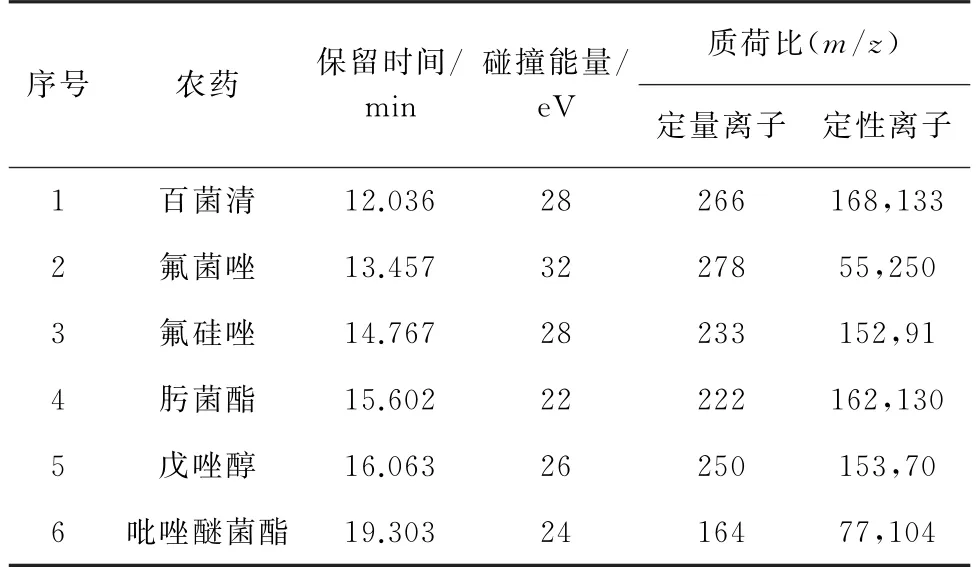
表1 质谱参数Tab.1 MS parameters
1.3 试验方法
随机采集约1 000 g土壤样品,去除植物根茎、石块等杂物,于室温下自然风干。将土壤样品反复研磨并全部通过65目(0.25 mm)筛,所得样品放入洁净的密闭容器中。分取10 g,加入硅藻土5 g,置于研钵中研磨均匀,转移至加速溶剂萃取池中,加入50 mL 萃取剂(体积比1∶2 的甲醇-乙腈混合溶液),设置萃取温度为70 ℃,萃取压力为10 k Pa,萃取时间为8 min,循环次数为3 次,冲洗体积为35 mL,静置萃取时间为6 min,氮气吹扫时间为2 min。用体积比1∶1 的丙酮-正己烷混合溶液5.0 mL活化弗罗里硅土固相萃取柱,将上述萃取液过柱,洗脱液全部收集于15 mL试管中,在70 ℃水浴中用氮气吹至近干,用正己烷溶解残渣,并定容至1 mL,所得溶液即为供试品溶液,按照仪器工作条件测定。
2 结果与讨论
2.1 质谱条件的选择
以10 mg·L-1混合标准储备溶液为待测对象,先通过Q3SCAN 全扫描模式确定目标农药的前体离子和保留时间,再用输入产物离子(碎片离子)模式扫描,根据保留时间选择分组扫描模式并适当调节结束时间,以确保6种农药前体离子和其对应的碎片离子均能扫描到。根据扫描结果,选择丰度较高的离子进行定量和定性。输入碰撞能量范围(3~45 eV)和能量间隔(3 eV),自动优化碰撞能量,优化的质谱参数见表1。
在优化的仪器工作条件下,10 mg·L-1混合标准储备溶液中的6种农药可在20 min内完成基线分离,所得色谱图见图1。
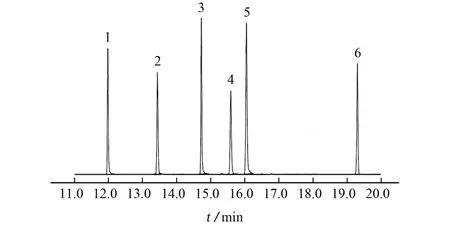
图1 混合标准储备溶液的色谱图Fig.1 Chromatogram of the mixed standard stock solution
2.2 萃取温度的选择
较高的萃取温度有助于增加溶剂对目标物的溶解能力以及加快溶剂的转移,从而缩短萃取时间。然而,过高的萃取温度会加快热稳定性差的农药分解,导致回收率降低。因此,试验考察了萃取温度分别为50,60,70,80,90 ℃时对6种农药回收率的影响,结果见表2。
由表2可知:随着萃取温度的升高,6种农药回收率呈上升趋势;当萃取温度为70 ℃时,回收率均较高;继续升高温度,氟菌唑和氟硅唑回收率降低,其余4种农药回收率变化不大。因此,试验选择的萃取温度为70 ℃。

表2 萃取温度对6种农药回收率影响Tab.2 Effect of extraction temperature on the recovery of the 6 pesticides
2.3 基质效应
土壤样品含有大量的硅酸盐、金属氧化物、有机物等,基质比较复杂,可能影响目标农药的测定。分别用基质匹配混合标准溶液系列和混合标准溶液系列制作标准曲线,考察了基质匹配法定量前后加标样品中6种农药的回收率,结果见表3。

表3 基质匹配法定量前后的回收率Tab.3 Recoveries before and after quantification with matrix matching method
由表3可知,采用基质匹配法定量后所得的回收率较高,因此试验选择以基质匹配法制作标准曲线。
2.4 标准曲线和检出限
按照试验方法测定基质匹配混合标准溶液系列,以各农药的质量浓度为横坐标,其对应的峰面积为纵坐标绘制标准曲线。结果显示,各农药标准曲线的线性范围均为0.05~2.0 mg·L-1,其他线性参数见表4。
以空白样品加标的方法进行试验,以3倍信噪比(S/N)对应的加标量作为检出限(3S/N),结果见表4。

表4 线性参数和检出限Tab.4 Linearity parameters and detection limits
2.5 精密度和回收试验
按照试验方法对空白样品进行3 个浓度水平的加标回收试验,每个浓度水平重复进样6 次,计算回收率和测定值的相对标准偏差(RSD),结果见表5。
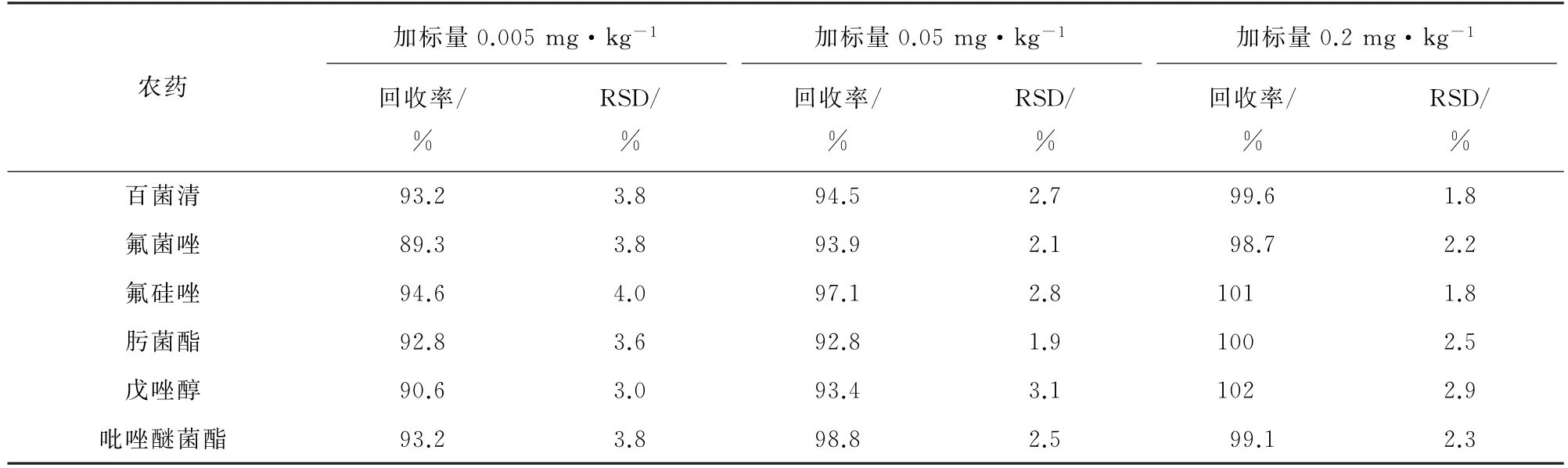
表5 精密度和回收试验结果(n=6)Tab.5 Results of tests for precision and recovery(n=6)
2.6 样品分析
为验证该方法的可行性,随机采集当地草莓、包菜和柑橘种植基地的土壤样品,按照试验方法分析,6种目标农药均未检出。
本工作采用加速溶剂萃取法萃取种植土壤样品中6种农药,以GC-MS/MS测定其含量,该方法萃取溶剂用量少、自动化程度高,结合串联质谱法检测,结果准确性较高。

