锂离子电池磷酸钛锂材料的研究进展
郭子祥,解玉龙,刘士钰,秦 学
(1.青海民族大学化学化工学院青藏高原资源化学与生态环境保护国家民委重点实验室,青海西宁 810007;2.天津大学理学院化学系,天津 300350)
在目前的商品化电池中,锂离子电池与传统的充放电电池相比具有明显的优势,能量密度高、自放电小、无记忆效应和绿色无污染等优点都使锂离子电池向多行业发展,为确保锂离子电池长远发展,优化电极材料性能必不可少,使Li+快速持续地在正/负极材料中脱嵌工作是材料改性的重点,这将更好地助力电化学储能行业的发展[1]。ATi2(PO4)3(A=Li,Na)是一种聚阴离子型化合物,并且具有高离子导电能力,其中LiTi2(PO4)3属于NASICON 结构的快离子导体[2],被认为是未来很有发展潜力的电极材料之一。但是LiTi2(PO4)3材料的电子电导率普遍低于10-9S/cm,远小于LiMn2O4[3](~10-3S/cm)、LiCoO2[4](~10-5S/cm)等材料的电导率,使其在大倍率充放电时电池容量低。为解决导电性差的问题,研究人员已经采用多种方法对其改性,包括包覆、元素掺杂等。本文主要对LiTi2(PO4)3材料的晶体结构、制备方法、改性方法等进行了简单总结,并对其未来的发展和应用前景进行了展望。
1 磷酸钛锂的结构和性能特点
LiTi2(PO4)3属于六方晶系,空间群为R-3C,两个TiO6八面体和三个PO4四面体通过多面体共用顶点的氧原子连接,而形成三维刚性骨架,晶格中的P-O-Ti 键有较大的键能,使得充放电时保证了晶体结构的稳定性。LiTi2(PO4)3中存在两个储锂位点(M1 和M2),在沿C轴方向上两个相邻的TiO6八面体间存在M1 位点,在O3TiO3M1O3TiO3M1…O3TiO3M1 空腔与八个氧原子键合形成的导电转弯处存在M2 位点,如图1 所示[5-7]。Delmas 等[6]研究表明在初始状态下,当M1 位点被Li+完全占据时,M2 处于空腔状态,则在放电过程中,来自负极的Li+嵌入LiTi2(PO4)3的M2 位点形成Li3Ti2(PO4)3相,同时为保持电荷平衡Ti4+被还原为Ti3+,产生一个2.5 V 左右的放电平台,但当M1 位点存在锂空位时,嵌入的Li+首先占据M1 位点,随后占据M2 位点,Li+迁移路径为M1→M2→M1,在M1和M2 的协同迁移作用下最终形成Li3Ti2(PO4)3相。所以先在2.8 V 产生一个小的放电平台,然后在2.5 V 产生一个宽的放电平台,此时发生两步嵌锂过程,提升了材料的放电比容量,此过程仅涉及储锂位点的重排[7],而晶格体积基本不发生改变,从而保证了材料的稳定性及循环使用率。因此,基于晶体的三维骨架以及存在的两个储锂位点,LiTi2(PO4)3材料表现出高离子电导率,稳定且宽的放电平台,其理论比容量可达138 mAh/g。

图1 LiTi2(PO4)3晶体结构示意图[7]
2 磷酸钛锂的制备方法
2.1 高温固相法
高温固相法是最传统、简便的制备方法,即将Li2CO3、TiO2和NH4H2PO4等原料按照一定的化学计量比均匀混合后,在马弗炉中一定的高温条件下进行煅烧,之后经球磨得到所需粉体。高温固相法最大优点是制备简单、易于产业化等,缺点在于煅烧温度高、团聚现象严重、产物颗粒尺寸大、形貌不易控制等。
Wang 等[8]以Li2CO3、TiO2和NH4H2PO4为原料用高温二次煅烧方法制备样品。先将混合物在900 ℃下预煅烧12 h 生成Li2CO3和NH4H2PO4,然后经降温研磨后在1 250 ℃下恒温24 h,制备出LiTi2(PO4)3样品。经电化学阻抗谱分析和计算,DLi+取值范围在1.4×10-11~1.2×10-9m2/s,表明材料有很高的离子扩散率。郑威等[9]用TiO2、LiH2PO4和NH4H2PO4为原料在950 ℃下煅烧12 h,成功制备了纯相LiTi2(PO4)3,并采用X-射线粉末衍射(非原位)和热重-差热分析法简单探究了合成机理,涉及的化学反应过程如下:
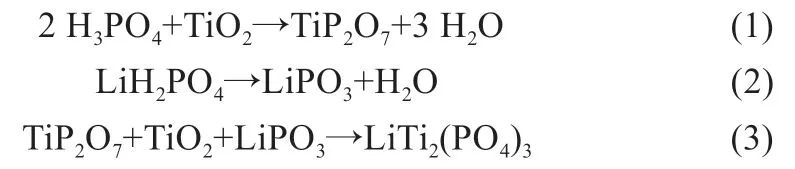
2.2 溶胶凝胶法
溶胶凝胶法是将锂源、钛源和磷源溶于有机溶剂,形成均一稳定的溶胶,经过脱水聚合作用变成凝胶,然后干燥制得前驱体,最后在一定温度下煅烧得到白色产物[10]。该法的优点是煅烧温度低、产物粒径均匀、结晶度高、可得纳米级颗粒,但溶胶凝胶法制备时步骤复杂,反应周期长,企业难以扩大生产。
袁铮等[11]先将聚乙烯醇(PVA)溶于水中,再加入Li2CO3、TiO2和NH4H2PO4,混合溶液在80 ℃持续搅拌形成胶状物,然后在烘箱中干燥24 h,最终将研磨后的前驱体在Ar 气氛下900 ℃煅烧12 h 得到LiTi2(PO4)3/C 样品。充放电结果显示,在一定倍率下,其首次放电比容量为144 mAh/g,采用EIS 测试对LiTi2(PO4)3/C 复合材料初次嵌锂过程进行研究,并计算了DLi+在充放电过程中嵌入/脱出时分别为2.40×10-5和1.07×10-5cm2/s。
He 等[12]将实验室自制的聚苯胺作为氮源和碳源,结合溶胶-凝胶法,将制得的前驱体在750 ℃时惰性气体下煅烧5 h,得到LiTi2(PO4)3@C-N 复合材料,其合成路线如图2 所示。充放电结果显示,在0.2C、10C、20C倍率下,其放电比容量分别为122.4、105.8 和95.3 mAh/g,在2C倍率下循环1 000 次后,容量保持率仍为82.1%。氮掺杂提升了碳层的缺陷,增强了碳层的导电性,加速了Li+和电子向碳层的转移,展现出了复合材料优异的电化学性能。
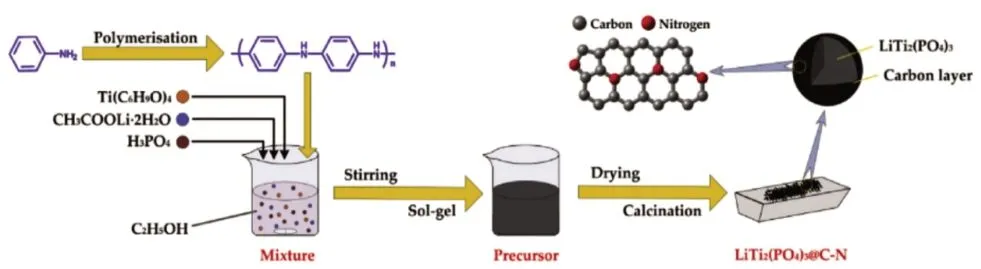
图2 LiTi2(PO4)3@C-N复合材料制备流程[12]
2.3 水/溶剂热法
水/溶剂热法利用反应釜在高温、高压条件下实现晶粒生长,将原料按化学计量比溶于水或有机溶剂中,在反应釜中经过后续恒温处理得到所需产物。该法简单易操作,制备的颗粒尺寸较小且分布均匀,是实验室常用的方法之一。
Yue 等[13]用Li2O、TiO2和P2O5为原料,首次用水热法在250 ℃保温5~7 d制备出了约50 μm 的长方形LiTi2(PO4)3晶体。Liang 等[14]在钽片为基板,用LiOH、H3PO4和钛粉为原料在220 ℃保温24 h 合成了无晶须群立方型LiTi2(PO4)3晶体。
Li 等[15]在此基础上采用溶剂热法对产物进行了深入的电化学探究,以CH3COOLi·2 H2O、Ti(C4H9O)4和NH4H2PO4为制备原料,在水热釜中180 ℃保温12 h,将水热产物加入一定量乙醇均匀搅拌,并在80 ℃下持续搅拌蒸发溶剂,最后得到LiTi2(PO4)3/C 复合材料。电化学结果显示,复合材料在仅有0.495%(质量分数)碳包覆量时,在0.5C倍率下初始放电比容量可达109.8 mAh/g,在10C倍率下经2 000 次充放电循环后容量保持率仍为85%,如图3(a)所示。在循环伏安曲线图中,LTP/C 复合材料相比于LTP 材料有更小的极化现象和更好的电化学可逆性,也表明了薄的碳层可以提高锂离子扩散速率和电子电导率,如图3(b)所示。
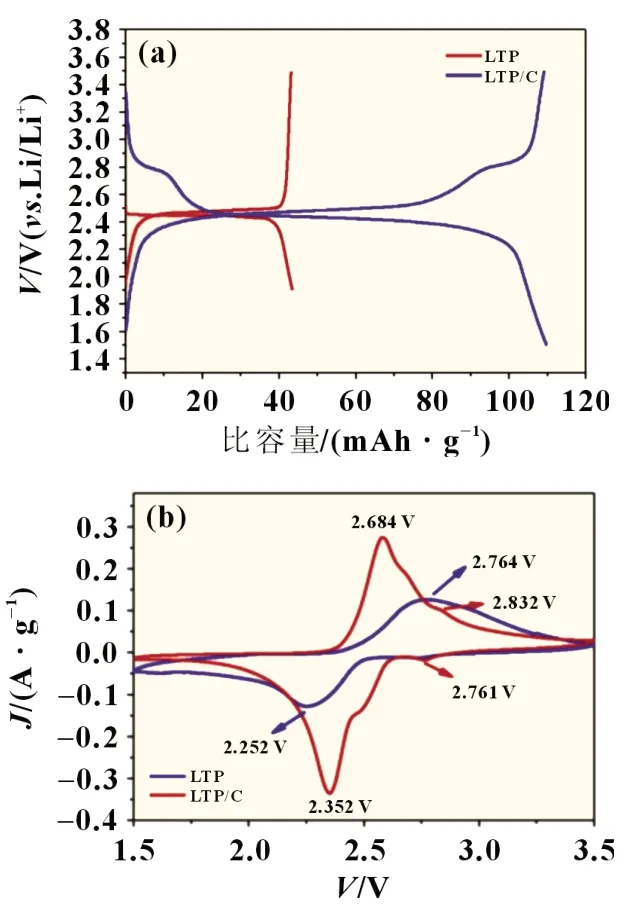
图3 (a)0.5 C下LTP和LTP/C首次充放电曲线;(b)扫描速率0.5 mV/s时LTP和LTP/C循环伏安图[15]
2.4 共沉淀法
将制备前驱体所需的原料分散在溶剂中形成均相溶液,加入沉淀剂后,可得到组分均一的产物。共沉淀法有利于制备超细颗粒和组分均一的产物,但是沉淀剂的种类和用量都会对前驱体的团聚和分布产生影响。
Sun 等[16]通过共沉淀法合成了纳米LiTi2(PO4)3/C 复合材料,在丁醇和乙醇(体积比为1∶1)的混合溶液中滴加几滴钛酸四丁酯,之后滴加预先溶解的LiOH 和C6H18O24P6混合溶液,磁力搅拌2 h 后进行抽滤、干燥等后处理过程,在750 ℃下保温4 h 获得纳米晶体,分别在5C和20C倍率下循环1 000 次后,容量保持率分别为94.4%和80.4%,放电比容量仍为116.9 和80.4 mAh/g。其全电池体系LiTi2(PO4)3/C‖LiMn2O4,以1 mol/L的Li2SO4为电解质溶液,在1.37C倍率下经1 000 次循环后容量保持率为71.5%。
除了上述制备方法,近几年兴起的流变相法[17]、模板法[18]、静电纺丝法[19]、喷雾干燥法[20]等,基本需要结合固相法或者溶胶凝胶法等进行制备,所得复合材料都能显示出优异的放电比容量。
3 磷酸钛锂的改性
虽然LiTi2(PO4)3具有锂离子扩散速度快、三维结构稳定等优点,但由于聚阴离子PO4四面体分隔了TiO6基团,使其无法形成三维的导电网络,导致材料电导率低下。为解决此问题,科研工作者主要采用包覆、元素掺杂以及设计特殊形貌来提高材料导电性,提升材料在大倍率放电时的电化学性能。
3.1 包覆
Ye 等[21]将β-环糊精作为碳源,采用溶胶凝胶法把LiTi2-(PO4)3粉末分散在含有β-环糊精的溶液中,80 ℃下干燥12 h,得到的前驱体在Ar 气氛下800 ℃煅烧2 h 后形成LTP/C 复合材料,在0.2C、0.5C、1C、2C、5C、10C和20C倍率下,3.13%(质量分数)碳包覆的LiTi2(PO4)3复合材料的放电比容量分别为133.1、125.6、121.8、118.7、115.4、106.7 和90.5 mAh/g。
Zhou 等[22]先将GO 分散在水/乙醇混合溶液(体积比为1∶19)中,将H3PO4、Ti(C4H9O)4、CH3COOLi 和酚醛树脂溶解在乙醇中备用,再将GO 分散液缓慢加入到上述混合溶液中,将混合溶液密封55 ℃加热3 h,最后把所得前驱体在700 ℃下H2/Ar 混合气(体积比为5∶95)煅烧5 h 制备出LiTi2(PO4)3@carbon/graphene(LCG)复合材料。充放电结果显示,在5C倍率下,循环1 000 次后,容量保持率为77.2%,在10C、20C倍率下也表现出高达80.8 和62.1 mAh/g 的放电比容量。
夏宗梅等[23]采用溶胶凝胶法,成功制备出了Mn 掺杂的LiTi2(PO4)3/C 复合材料,先将L-酒石酸和Ti(OC4H9)4均匀分散在乙醇中,然后将LiCH3COO 和Mn(CH3COO)2加入到混合溶液中,并缓慢滴加NH4H2PO4溶液,加热搅拌至溶剂完全挥发。待真空干燥后,在Ar 气氛下700 ℃煅烧10 h,得到灰黑色产物。0.1C倍率下循环150 次后放电比容量达145 mAh/g,5C倍率下首次放电比容量也达到了132 mAh/g。Mn4+掺杂和碳层的存在,不仅减少了电荷阻抗Rct,还增加了正极材料的DLi+值,两者的协同效应共同提高了传质动力学和电化学性能。
3.2 元素掺杂
LiTi2(PO4)3材料的低导电率,制约其在大倍率下的容量发挥,而离子掺杂能够适当改变晶体结构,扩宽Li+迁移通道,提高Li+扩散速度,进而提升电化学性能。阳离子掺杂占据Li 位和Ti位。
Liu 等[24]以酚醛树脂为碳源,制备出了原位碳包覆Na+掺杂的Li0.97Na0.03Ti2(PO4)3/C 复合材料。在全电池Li0.97Na0.03Ti2-(PO4)3/C‖LiMn2O4体系中,2C倍率下循环300 次后,放电容量保持率为90.4%。材料表征和电化学测试结果表明,Na 在Li位上的掺杂并没有破坏LiTi2(PO4)3的晶体结构,反而增加了晶格体积,拓宽了扩散通道,DLi+为8.9×10-8cm2/s,降低了电荷转移阻抗,提升了放电比容量。
常见的还有Al3+掺杂合成的LATP 复合材料,杨程响等[25]采用共沉淀法制备Li1.3Al0.3Ti1.7(PO4)3粉体材料,以正丙醇钛为钛源,当pH 调节为7 时,材料离子电导率达1.97×10-3S/cm,还测试了不同温度下LATP 材料的总离子电导率,在室温下总离子电导率达到相对最佳值2.55×10-4S/cm。目前已报道掺杂的阳离子还有K+、Nb5+、Sn4+等。
阴离子掺杂主要占据晶格中的阴离子位点,目前文献中报道的掺杂阴离子较少,Wang 等[26]以LiF 为氟源,通过溶胶凝胶法合成了F 掺杂碳包覆的LiTi2(PO4)2.88F0.12复合材料,以LiMn2O4为正极的全电池体系下,在2C、10C、20C倍率下首次放电比容量分别为117.2、111.8 和104.2 mAh/g,特别是在40C倍率下,仍能保持在86.0 mAh/g,F 掺杂后提升了本征电导率和Li+扩散系数,突显了水系电池中负极材料优异的倍率性能(图4)。
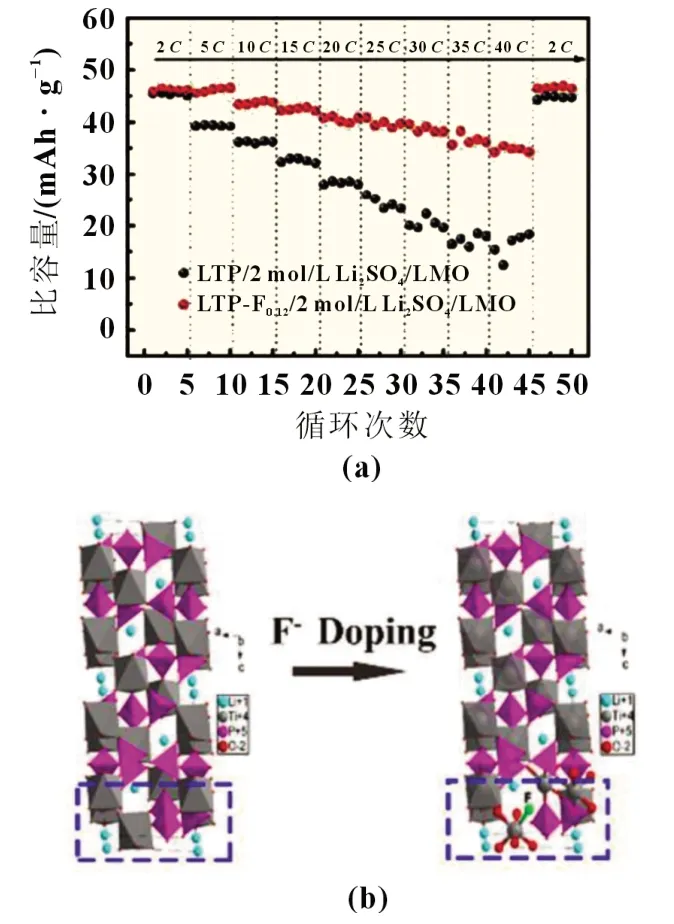
图4 (a)不同电流密度下的放电比容量;(b)F掺杂结构示意图[26]
另外报道的还有CI-、Br-等元素掺杂制备的LiTi2-(PO4)3-xCl3x/C 和LiTi2(PO4)2.82Br0.18/C 复合材料,都显示出了优异的电化学性能。
3.3 形貌调控
形貌调控是提高材料电化学性能的另一种改性方式。特殊的形貌设计可以增大与电解液接触面积,增加化学反应活性位点,减少倍率循环时粉化程度,提升材料循环寿命。
Li 等[27]采用聚合-包覆相结合的方式制备出了核-壳结构的LiTi2(PO4)3/C 复合材料(PDA-cLTP),以聚多巴胺(PDA)为碳氮源,利用PDA 粘附效应,使团聚颗粒经煅烧后表面包覆一层均匀碳层。充放电结果显示,在1C倍率下首次放电比容量约为120 mAh/g,循环200 次后容量保持率高达86%,当电流密度从0.5C增加到10C,复合材料放电比容量仅衰减17 mAh/g,展示了核-壳结构复合材料优异的电化学性能。
4 总结与展望
基于NASICON 结构的众多优势,LiTi2(PO4)3材料将越来越有应用价值。LiTi2(PO4)3具有适宜的嵌锂电位(vs.Li/Li+约2.5 V)、稳定的三维骨架以及较大的比容量,且环境友好,使得越来越多的研究者应用于水系电池负极[28],是非常有发展前景的电极材料之一。基于LiTi2(PO4)3材料的高离子电导率,也常作为三元电极材料的包覆层或者二者的相互结合[29],不仅确保充放电过程中的Li+快速传导,也减少活性材料与LiPF6等有机电解液的直接接触,进一步提升了放电比容量,众多研究者将其应用于电极材料表面包覆等。
LiTi2(PO4)3材料的低导电性,限制了其在电化学储能行业的发展,掺杂包覆、材料纳米化以及形貌设计等是解决问题的关键过程,特别是将元素基本性质与第一性原理计算等理论相结合,可以更好地优选出实验条件,进一步优化电极材料性能,有利于开发具有优异电化学性能的新型电池材料[30],这将有望成为今后的研究重点和方向。综合改性后的LiTi2(PO4)3则更易应用于柔性电极材料、水系电池负极材料以及二次充电电池材料表面修饰等电化学储能材料,更好地发挥锂离子导体的作用,将LiTi2(PO4)3材料的应用价值最大化,市场发展前景十分广阔。

