密码子优化的人溶菌酶基因在毕赤酵母中的分泌表达及抗菌活性分析
徐艳艳,廖志银,王珍,王首锋,3*
(1.浙江大学 基础医学系,浙江 杭州 310058;2.绿城农科检测技术有限公司,浙江 杭州 310052;3.浙江省微生物生化与代谢工程省级重点实验室,浙江杭州 310058)
20 世纪40~80 年代是抗生素的黄金时期,多种抗生素的发现和使用在给人们带来健康的同时出现了耐药性问题[1]。抗生素除用于临床治疗,还用于养殖业、食品加工业,耐药基因在食物链中的传递加速了耐药菌株的进化和传播。公共卫生观念的提高,抗生素的规范使用,溶菌酶、抗菌肽、乳铁蛋白、Nisin 等天然抗菌药物的挖掘和应用缓解了抗生素使用的必要性。溶菌酶(lysozyme)最早被发现于人鼻涕黏液中,随后在人的组织、分泌物,如乳汁、鼻涕、唾液、眼泪、血液中被检测到,且溶菌酶类似物在其他动物、植物、海洋生物中被分离出[2]。溶菌酶具有肽聚糖水解酶活性,能够特异性识别水解细胞壁肽聚糖层,是一种典型的阳离子、疏水的两性蛋白,可利用静电作用吸附至细菌细胞壁、用疏水作用打开磷脂双分子膜层裂解细胞壁,因此缺乏酶活性的溶菌酶仍具有部分抗菌性。
人溶菌酶(human lysozyme,hLYZ)基因位于人体12q15 染色体,用于编码人溶菌酶蛋白(EC 3.2.1.17),天然的hLYZ 含量少、收集难、成本高。鸡蛋白溶菌酶(hen egg white lysozyme,HEWL)来源广泛,鲜蛋白含量高、抗菌效果好,最早被作为食品、饲料添加剂。hLYZ的生物活性是HEWL的3倍[3],热稳定性高,应用于人体不会产生过敏反应,hLYZ 在医学治疗、食品加工、饲料生产的前景较HEWL 好。研究发现,将溶菌酶阿拉伯树胶联合作为一种天然防腐剂和乳化剂,对蛋黄酱的保鲜效果很好[4];重组hLYZ 对口腔疾病致病菌,如变形链球菌、白色念珠菌、牙龈卟啉单胞菌的体外抗菌实验发现,重组hLYZ的抗菌效果优于鸡蛋清溶菌酶[5]。hLYZ 通过基因工程技术在细菌[6]、酵母[7-8]、水稻[9]、动物[10-12]中成功构建了生物反应器,用于大规模工业生产。其中巴斯德毕赤酵母(Pichia pastoris)作为真核微生物优势明显,其生长周期短,具有独特的真核蛋白合成途径和蛋白翻译修饰功能,包括二硫键的形成、糖基化的修饰[13]。同时P.pastoris的醇氧化物酶基因AOX1 启动子可控制外源基因表达蛋白,通过添加甲醇诱导表达,较大肠杆菌表达添加的异丙基-β-D 硫代半乳糖苷(IPTG)成本低,因此P.pastoris是生产重组蛋白、疫苗的优良宿主。
在蛋白质合成翻译时,物种不同、基因不同的氨基酸使用同义密码子的频率亦不同,具有这些偏好表达的密码子称为最优密码子[14]。根据表达宿主选择目的基因最优密码子,能提高目的蛋白异源表达水平,获得高效表达。张赛南[15]通过对鸡蛋清溶菌酶密码子的优化重组,得到一株对G418 具有高抗性的毕赤酵母。
基于hLYZ的工业化生产需求,选择毕赤酵母GS115 染色体,通过优化hlyz的密码子序列提高异源表达水平,获得产量高、活性好的hLYZ。先利用基因工程技术,将优化后的溶菌酶基因连接在pPIC9K上,然后导入毕赤酵母GS115 染色体,筛选出高效表达的重组毕赤酵母GS115-pPIC9K-hlyz(G-P-hlyz)。
1 材料和方法
1.1 材料
1.1.1 菌株和质粒
大肠埃希菌TOP10、毕赤酵母GS115、溶壁微球菌(Micrococcus luteus,ATCC 4698)、pPIC9K 质粒均于−20 ℃保存。金黄葡萄球菌(Staphylococcus aureus,ATCC 6538)、侧孢芽孢杆菌(Brevibacillus laterosporus,ATCC 4517)、无乳链球菌(Streptococcus agalactiae,ATCC BAA-611)、铜绿假单胞菌(Pseudomonas aeruginosa,ATCC 15442)、大肠杆菌(Escherichia coli,ATCC 11229)、肺炎克雷伯菌(Klebsiella Pneumoniae,ATCC 13883)均在实验室储藏保存。鼠伤寒沙门氏杆菌(Salmonella typhimurium,ATCC 14028)由杭州市公共卫生中心提供。
1.1.2 试剂
Prime STAR Max DNA Polymerase,ClonExpressTMⅡ重组克隆试剂盒,限制性内切酶SanB Ⅰ、NotⅠ、SalⅠ,Ex Taq DNA Polymerase,PCR 微生物裂解缓冲液(购于宝日医生物技术有限公司),蛋白非预染MarkerⅡ中分子质量范围(由上海生工生物工程有限公司合成),人乳溶菌酶标准品≥100 000 U·mg−1(Sigma L1667),鸡蛋清溶菌酶标准品≥40 000 U·mg−1(Sigma L6876),Sephadex-G50(Siama),LB 液体培养液,LB 固体培养基,YPD酵母培养基,G418 遗传霉素,含甘油的BMGY 培养基,含甲醇的BMMY 培养基。
1.1.3 引物
特异性引物hlyz-F:5′-AGGCTGAAGCTT ACGTAATGAAGGTTTTCGAAAGAT-3′,SanBⅠ;
特异性引物hlyz-R:5′-TTAATTCGCGG CCGCTTAAACACCACAACCTTGAAC-3′,NotⅠ;
通用引物3′AOX:5′-GCAAATGGCATTCT GACATCC-3′;
通用引物α-Factor:5′-TACTATTGCCAGC ATTGCTGC-3′。
1.2 方法
1.2.1hlyz基因密码子优化及重组载体构建
氨基酸由多种密码子编码,在不同基因、不同物种间,相同氨基酸的密码子出现频率不同,这与不同细胞中tRNA的浓度高低有关。为提高异源基因在宿主中的蛋白表达水平,需对基因密码子进行优化[14]。优化策略包括替换稀有密码子以降低翻译错误,更换偏好密码子以提高翻译效率、提高密码子适应指数(codon adaptation index,CAI),优化GC 值以提高基因合成稳定性等。因此,对从美国国家生物信息技术中心(National Center for Biotechnology Information,NCBI)下载的hlyz基因根据毕赤酵母宿主特点进行密码子优化,并由上海生工生物工程公司化学合成连接至pUC57-hlyz质粒。如图1 所示,以hlyz-F和hlyz-R 为引物、pUC57-hlyz为模板做PCR 扩增,扩增条件为98 ℃5 min,98 ℃5 s,58 ℃5 s,72 ℃10 s,重复30 次步骤2~步骤4,于4 ℃保温。参照胶回收试剂盒说明书,对PCR 产物进行纯化,回收hlyz基因片段。准备线性化质粒,将pPIC9K 质粒分别进行SanBⅠ、NotⅠ双酶切,参照一步克隆试剂盒说明书,将hlyz基因重组连接至pPIC9K 质粒,将pPIC9K-hlyz转化至E.coil-TOP10,在Kan 抗性平板上筛选。用牙签挑出平板上的单克隆,做菌落PCR 鉴定并进行测序。

图1 重组hLYZ 异源表达策略Fig.1 Construction and expression of human lysozyme
1.2.2 重组毕赤酵母的转化构建
制备感受态毕赤酵母GS115,取OD600=1.3~1.5的GS115 菌液50 mL,离心弃上清,用50 mL 冰水重悬2次,弃上清加入20 mL 冰山梨醇,洗涤后离心,取250 μL 浓度为1 mol·L−1的冰山梨醇重悬,分装成每管80 μL的感受态细胞。将SalⅠ酶切线性化pPIC9K-hlyz电转化感受态毕赤酵母。将80 μL感受态细胞和10 ng 线性质粒混合,加入电转杯冰浴5 min,15 kV电击4~6 s,立即加入1 mL 浓度为1 mol·L−1的冰山梨醇,30 ℃孵育2 h 后取100 μL 菌液涂抹于MD 平板,30 ℃培养2 d。进一步筛选遗传霉素,将MD 平板上的菌落洗涤稀释,涂抹于含6.0 mg·mL−1G418的YPD 平板,30 ℃培养2~3 d。对生长的单菌落做PCR 扩增,挑取菌落并将其溶解于50 μL 裂解液,80 ℃加热5 min,低速离心,取1~2 μL 上清为模板添加至20 μL的PCR 体系,扩增条件为95 ℃5 min,95 ℃30 s,55 ℃30 s,72 ℃1 min,重复30 次步骤2~步骤4,于4 ℃保温。
1.2.3 瓶摇发酵表达和蛋白鉴定
根据毕赤酵母表达说明书,将G-P-hlyz单菌落接种于25 mL BMGY 培养基,在30 ℃,250 r·min−1条件下培养,当OD600=2时,4 500 r·min−1离心10 min,收集沉淀菌体,用250 mL 甲醇诱导BMMY 培养基重悬,继续摇瓶令其发酵表达。每间隔24 h 加入1%甲醇诱导,取2 mL 样品用于后续分析鉴定,诱导144 h 后终止发酵,6 000 r·min−1离心收集上清。
考虑发酵液上清经三氟乙酸(Trichloroacetic acid,TCA)沉淀法除盐处理后进行聚丙烯酰胺凝胶电泳(SDS-PAGE)的效果更好,取800 μL 上清加入100 μL 100%的TCA中,摇匀,−20 ℃处理12 h,离心弃上清,然后用冰丙酮除去TCA 残留液,加PBS 重悬,取样,再加入等体积2×蛋白上样缓冲液,100 ℃加热5 min,制备好电泳样品。将15%分离胶的聚丙烯酰胺凝胶组装后上样,每个泳道10 μL,先80 V 电泳30 min,再120 V 电泳100 min。随后用考马斯亮蓝染色,用脱色液洗涤,拍照观察。
按照Bradford 蛋白浓度检测试剂盒上的操作说明,测定发酵液上清的总蛋白浓度,将100 μL 不同稀释浓度的标准样品加入1 mL Bradford 工作液,室温反应5 min 后测定595 nm 处的吸光度(OD595)。上清样品测定方法相同,代入标准曲线测得蛋白浓度。
1.2.4 重组hLYZ 酶活测定
hLYZ的活性检测方法较成熟,常用的有比浊法,利用溶菌酶对溶壁微球菌的杀伤作用,根据紫外吸光度的变化情况测定酶活。先将hLYZ 标准品(100 000 U·mg−1)稀释至50,100,150,200,250 U·mL−1,再用0.1 mol·L−1磷酸盐缓冲液将溶壁微球菌稀释至OD450=0.7±0.1,在室温下,取2.8 mL底物检测菌溶液,将其加至200 μL 稀释样品中,混合,记录3 min 内OD450变化情况,将反应2 min 时的读数记为A1,反应3 min 时的读数记为A2,变化值ΔE=A1−A2,以酶活为纵坐标,ΔE为横坐标作标准曲线。上清样品实验操作相同,记录ΔE,注意样品每分钟内吸光度的下降值控制在0.03~0.08内,根据标准曲线计算酶活。
1.2.5 体外抗菌谱测定
为检测表达的hLYZ 对不同致病细菌的抑制和杀灭能力,用溶菌酶标准品、发酵液样品测定酶活,然后测定样品的最低抑菌酶活,根据最低抑菌浓度(minimal inhibitory concentration,MIC)实验方法[16]修改。选择8 种常见的致病菌(革兰氏阳性菌、革兰氏阴性菌各4 种)作为体外抑菌实验的被检测菌株,如表1 所示。首先,取8 支10 mL 玻璃试管,高温灭菌后均加入2 mL LB 培养液,编号。然后,管1 加入2 mL 样品,摇匀,管2 加入4 mL 样品,摇匀,依次2倍稀释至管7,管8 为空白对照,不加样品。最后,加入菌液至浓度为0.5个麦氏比浊,摇匀后于37 ℃静置过夜培养。肉眼观察试管溶液的浑浊度,管1 由澄清变浑浊,其样品浓度为最低抑菌酶活。

表1 MIC 实验指示菌株Table 1 Tested bacteria of MIC
1.2.6 Sephadex G50 分离纯化
通过葡聚糖凝胶(Sephadex)G50 实现蛋白分离,同时达到脱盐的效果。根据hLYZ的分子质量选择Sephadex G50,将Sephadex G50 粉末加水溶胀24 h 后装柱,用20 mmol·L−1的Tris-HCl,pH 8.0 平衡洗脱至基线,加入2 mL 发酵液上清,流速为0.4 mL·min−1,继续用平衡缓冲液洗脱15 h。收集洗脱峰,真空冷冻干燥机浓缩冻干。
2 结果与分析
2.1 密码子优化
密码子优化前后对比如图2 所示,优化后序列的GC值为43.43%,CAI 从0.095升至0.950,且可替换毕赤酵母偏好性密码子,如用精氨酸(Arg)偏好密码子AGA、亮氨酸(Leu)偏好密码子TTG 替换。这些优化策略提高了hlyz基因在毕赤酵母中的转录表达水平。

图2 hlyz 基因密码子优化前后对比Fig.2 Alignment of hlyz sequence and optimized gene ori 为原始基因序列,opt 为优化后基因序列。
2.2 pPIC9K-hlyz 载体构建结果
双酶切线性化的pPIC9K和hlyz基因片段通过同源臂重组连接,及pPIC9K 质粒上的氨苄抗性基因赋予阳性菌落氨苄抗性,重组质粒pPIC9K-hlyz的构建结果如图3 所示。由图3知,菌落PCR 在396 bp 处的条带与目的蛋白条带一致,重组质粒测序峰图正常,与目的序列一致,pPIC9K-hlyz构建完成。

图3 重组质粒pPIC9K-hlyz的构建结果Fig.3 Construction results of pPIC9K-hlyz
2.3 G-P-hlyz的构建和鉴定
将重组质粒pPIC9K-hlyz电转化为同源重组毕赤酵母染色体,经过营养缺陷组氨酸的MD 平板、浓度梯度的遗传霉素G418 筛选,对筛选菌落做PCR,鉴定结果如图4 所示。特异性引物扩增条带在396 bp 处与hlyz基因一致,通用引物扩增条带在896 bp 处与hlyz基因和通用引物扩增基因之和一致。

图4 重组毕赤酵母的菌落PCRFig.4 PCR product of Pichia pastoris
2.4 G-P-hlyz的发酵表达
毕赤酵母是一种甲醇营养型好氧菌。在摇瓶表达时,将250 mL BMMY 培养基置于1 L 锥形瓶中,间隔取样,记录其生长特点和蛋白酶活变化。SDS-PAGE结果(图5)显示,14.7 kDa 处的条带与目的蛋白条带一致。如图6 所示,菌液的OD600与酶活变化曲线一致,两者均随诱导时间逐步上升,且在120 h 时达最高,菌液的酶活为(2 414.9±108.1)U·mL−1,蛋白浓度为166.7 μg·mL−1。
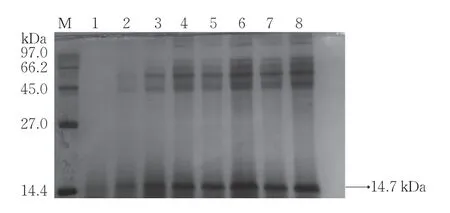
图5 摇瓶发酵表达G-P-hlyz的SDS-PAGE 结果Fig.5 SDS-PAGE results of G-P-hlyz fermentation

图6 发酵过程中菌体生长曲线及酶活变化Fig.6 Bacterial growth curve and lysozyme activity of supernatant
2.5 体外抗菌谱测定结果
以hLYZ 和HEWL 标准品为阳性对照,灭菌培养基为空白对照,分别对已知酶活的重组hLYZ 样品、hLYZ 标准品、HEWL 标准品进行体外抗菌谱测定实验,结果如表2 所示。3 种样品对不同属性致病菌的抗菌效果为革兰氏阳性菌>革兰氏阴性菌;对8 种致病菌的最低抑菌酶活为重组hLYZ 样品 表2 对8 种细菌的最低抑菌酶活结果Table 2 Minimum antibacterial enzyme activity results 发酵液中人溶菌酶蛋白与其他杂蛋白的分子质量差别较大。Sephadex G50 适合分子质量为5~15 kDa 物质的分离纯化,结果如图7 所示。通过分子筛选得到的分离效果较好,在第二个洗脱峰(泳道3)收集到大小一致的粗纯品hLYZ。 图7 Sephadex G50 纯化的SDS-PAGE 结果Fig.7 SDS-PAGE results after Sephadex G50 purification 溶菌酶的发现距今已有一个世纪,其来源广泛,不易产生耐药性,工业化生产效率高、成本低,溶菌酶的衍生产品已应用于食品、药品、动物饲料等领域。现代生物表达技术在工业生产中具有较大优势,其中酵母真核表达系统具有周期短、构建表达成熟、分离纯化简单等优点,尤其是真核蛋白经蛋白翻译后可进行修饰。毕赤酵母是分子生物学中最受欢迎的重组蛋白表达系统之一,其成功表达了多种干扰素、胰岛素、人表皮生长因子、溶菌酶等,并作为商品大量生产出售。 对hlyz进行密码子优化,能在不改变蛋白序列、增强基因在毕赤酵母中适应性的情况下达到高效表达。优化前,溶菌酶的酶活仅为812 U·mL−1,经摇瓶发酵,重组蛋白的酶活达(2 414.9±108.1)U·mL−1,提高了约3 倍。WEI等[17]构建的毕赤酵母重组hLYZ的酶活仅为533 U·mL−1,基因优化后的酶活较其提高了4 倍;李学优等[18]构建的SMD1168-pPIC9k-HLZ 菌株溶菌酶的酶活约1 901 U·mL−1,基因优化后的酶活较其提高25%。比较已有的重组溶菌酶酶活发现,通过密码子优化,筛选了高效表达菌株,酶活表达得到了很大提高。 本研究获得的重组hLYZ 酶活虽有较大提高,但仍较低,目前有研究通过增加基因拷贝数、串联表达分子伴侣等方法进一步提高了异源表达水平,如HE等[19]构建了6个拷贝hlyz基因、共表达分子伴侣Ero1 或Pdi1,其酶活分别提高了1.5倍和2.3倍,最高达到(21 200±400)U·mL−1。另外,对发酵条件的响应面进行优化亦可进一步提高毕赤酵母重组蛋白的高效表达,如YU等[7]利用Placket-Burman 设计和响应面分析(RSD)优化毕赤酵母SMD1168 发酵条件(温度、pH、接种量、体积、氧气浓度),hLYZ酶活最终提高了2.2倍,达3 301 U·mL−1。毕赤酵母在发酵罐中的高密度培养能提高表达效率,在15 L 发酵罐中产物的酶活可达47 680 U·mL−1,提高了30 倍。本研究hLYZ的体外抑菌实验结果显示,hLYZ 对革兰氏阳性菌的杀伤效果优于革兰氏阴性菌,hLYZ 在500 U·mL−1酶活下对大多数致病菌有很好的抑制作用,抗菌效果是hLYZ 标准品的10~20 倍。 通过对hlyz基因进行密码子优化,成功构建了重组毕赤酵母GS115-pPIC9K-hlyz,高效表达了hLYZ,抗菌效果好,对革兰氏阳性菌杀伤力强,纯化方法简单,具有很好的工业生产前景。
2.6 Sephadex G50 分离纯化

3 讨论
4 结论

