牛膝甾酮介导Notch通路影响成牙骨质细胞成骨效应*
韦 敏 顾春梅 王育新 管燕华
骨由来自细胞外基质(ECM)的钙化基质和骨细胞(分化自成骨细胞)组成,细胞外基质是胶原蛋白、蛋白聚糖和糖蛋白的复杂复合体,为细胞的增殖、分化、衰老和凋亡提供了一个特殊的微环境,此外,通过成骨细胞中的成骨细胞信号传导途径,提供成骨细胞的基本信号传导途径[1]。而成牙骨质细胞在细胞特征及功能上与成骨细胞具有许多相似性,其功能受到多种成骨相关蛋白的调控[2]。人牙骨质主要由羟基磷灰石、胶原和非胶原蛋白构成,这些蛋白在牙齿的矫正及修复过程中具有重要作用[3]。Notch信号通路是一种高度保守的分子细胞信号通路,由Notch受体(1,2,3,4型)、Notch配体(DSL蛋白)和细胞内效应分子(CSL-DNA结合蛋白)组成,在多细胞生物的增殖、干细胞维持、细胞命运调控、分化和内环境稳定中发挥重要作用[4]。既往研究发现,Notch信号通路参与了成骨细胞分化过程,Notch信号通路被激活,可促进成骨细胞分化[5]。有研究发现,过表达的整合素金属蛋白酶10可通过激活Notch信号通路相关蛋白的表达,从而促进牙周膜干细胞成骨分化[6]。牛膝具有补肝肾、强筋骨等功效,目前在临床上主要用于骨质疏松症的治疗[7]。牛膝主要含有牛膝甾酮、蜕皮甾酮和香豆素等物质,已有研究报道显示,牛膝甾酮对于骨形成具有一定的促进作用[8]。但是目前关于牛膝甾酮对成牙骨质细胞成骨效应的影响还未见报道,且牛膝甾酮对Notch信号通路相关蛋白表达的影响还不清楚。因此本研究分析了牛膝甾酮对成牙骨质细胞成骨效应的影响并探讨其相关机制,以期为临床提供参考。
1 材料与方法
1.1 材料、试药与仪器
1.1.1 细胞:成牙骨质样细胞株OCCM-30,购自武汉普诺赛生命科技有限公司。
1.1.2 试剂和药物:DMEM培养液(批号:612456)、胎牛血清(批号:648412)、胰蛋白酶(批号:201645)购自美国Sigma公司;牛膝甾酮粉末(批号:549123)购自南京建成生物有限公司;RNA提取试剂盒(批号:865431)购自上海优宁维生物有限公司;RNA反转录试剂盒(批号:845615)购自上海优宁维生物有限公司;RT-qPCR试剂盒(批号:612334)购自上海优宁维生物有限公司;Notch1(批号:587254)、DSL(批号:254354)、CSL(批号:754245)和β-actin(批号:253341)蛋白抗体购自美国Abcam公司;二抗(山羊抗兔,批号:235687)购自于武汉三鹰生物有限公司。
1.1.3 仪器:BSC-1100IIB2-X生物安全柜(中国博科公司);博科300LCO2细胞培养箱(中国博科公司);5320R4℃离心机(德国徕卡公司);伯乐Mini-PRO TEAN电泳仪(美国伯乐公司);EVOS M7000倒置荧光显微镜(意大利赛默飞公司);BKQ-B75高压蒸汽灭菌锅(中国博科公司);LAS 4000成像系统(GE Health care公司,美国)。
1.2 细胞培养和分组
将细胞冻存管从液氮罐中取出,于37℃水浴锅中解冻后,倒入装有8ml培养基的15ml离心管中离心5min(1 000r/min),弃上清,加入1ml培养基重悬细胞后倒入加有10ml培养基的培养皿中,轻微摇晃使细胞均匀分布在培养基中,然后放入CO2培养箱中培养(37℃),细胞覆盖率达到80%时进行传代以及后续试验。采用培养基将牛膝甾酮配置成10.0mg/L溶液,高剂量组直接使用即可,其余各组按比例稀释。根据牛膝甾酮干预剂量的不同将细胞分为空白对照组(0mg/L)、牛膝甾酮低剂量组(2.5mg/L)、牛膝甾酮中剂量组(5.0mg/L)、牛膝甾酮高剂量组(10.0mg/L)[9],各组均培养24h后进行后续试验。
1.3 CCK-8法检测细胞增殖水平
取各组对数生长期的OCCM-30细胞,在培养皿中加入1ml胰蛋白酶轻微吹打2min,使细胞完全悬浮。将悬浮的细胞转移到1.5ml离心管中离心(2 000rpm,10min),弃上清液,加入1ml RPMI 1640培养基,并轻微吹打细胞,使细胞充分悬浮,将细胞悬液转移到96孔板中,每孔100μl,在培养箱中培养24h,弃去96孔板中的培养基,再每孔中依次加入新的RPMI 1640培养基,各组6个复孔,培养24h,去除培养液。每孔加入100μl培养液和10μl CCK-8溶液,持续培养3h,使用Bio-Rad微孔板阅读器读取450nm处的吸光度,重复三次,通过吸光度计算细胞增殖率。
1.4 细胞内钙离子检测
采用Fluo-3 AM探针检测细胞内钙离子荧光强度:取对数生长期的OCCM-30,PBS冲洗三次,采用无钙离子的培养基将细胞重悬,细胞涂片于病理玻片上,玻片放置于培养皿中,培养皿加入无钙离子的培养基,在培养箱中培养24h,加入Hank’s平衡液清洗玻片三次,然后加入Fluo-3 AM工作液(1∶5稀释),避光孵育30min,采用中性树脂封片,最后于倒置荧光显微镜下进行观察,400倍视野下随机选择5个视野,并采用Image J软件进行图片分析,依据图片中的荧光强度计算钙离子荧光强度数值。
1.5 流式细胞术检测细胞凋亡率
使用FITC凋亡试剂盒,将OCCM-30细胞(PBS)洗涤两次,用1×结合缓冲液在1×106细胞/ml浓度下悬浮于400μl V-FITC溶液中,黑暗中室温孵育15min,然后加入PI(10μl),4°C避光孵育5min,立即用流式细胞仪分析细胞,重复6次。
1.6 RNA提取及RT-qPCR
取出培养皿放入无菌操作台,弃去培养皿中的培养液。根据RNA提取试剂盒说明步骤提取细胞总RNA,并利用反转录试剂盒得到cDNA保存至-80℃备用。RT-qPCR体系:SYBR Green qPCR SuperMix 16.25μl,特异性引物2.0μl,模板cDNA 3.25μl,DEPC水补足至30μl。反应条件为:95℃,10min;95℃,10s;60℃,30s;70℃,30s;共40个循环。设置6个复孔,以GADPH为内参,根据公式(2-ΔΔCt法)计算Notch1、DSL、CSL mRNA表达。各引物序列表1。

表1 各基因引物序列
1.7 Western Bloting检测细胞相关蛋白表达
取出培养皿放入无菌操作台,弃去培养皿中的培养液,并加入1ml PBS和100μl蛋白酶K溶液,使细胞悬浮,超声细胞破碎仪作用2min破碎细胞,3 000rpm 4℃离心20min,取上清于一支新的1.5ml EP管中,然后采用蛋白定量试剂盒检测每个样本吸光度(450nm波长),根据标准曲线计算每个样品的蛋白浓度,根据定量结果将每个样品的蛋白浓度定量至3μg/μl,每孔上样10μl,经SDS-PAGE电泳分离、转模和封闭后用特异性抗体Notch1、DSL、CSL(1∶5 000),在4℃条件下孵育12h,孵育后的条带清洗三次(1%吐温),二抗(山羊抗兔,1∶1 000)孵育2h,LAS 4000成像并观察结果,采用β-actin作为内参进行灰度值比较。
1.8 统计学处理

2 结 果
2.1 牛膝甾酮对细胞增殖率的影响
四组细胞增殖率比较,差异有统计学意义(P<0.05)。与空白对照组比较,牛膝甾酮各剂量组OCCM-30细胞增殖率显著升高,且牛膝甾酮各剂量组OCCM-30细胞增殖率呈低剂量组<中剂量组<高剂量组 (t均>5.018,P<0.05),见表2。
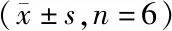
表2 各组细胞增殖率比较
2.2 牛膝甾酮对细胞内钙离子的影响
四组细胞内钙离子荧光强度比较,差异有统计学意义(P<0.05)。牛膝甾酮各剂量组OCCM-30细胞内钙离子荧光强度显著高于空白对照组,且牛膝甾酮各剂量组OCCM-30细胞内钙离子荧光强度呈低剂量组<中剂量组<高剂量组(t均>14.402,P<0.01),见表3和图1。
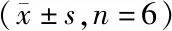
表3 各组细胞钙离子检测结果比较

图1 各组细胞内钙离子荧光强度(荧光显微镜,×400)
2.3 牛膝甾酮对细胞凋亡的影响
四组细胞凋亡率比较,差异有统计学意义(P<0.01)。牛膝甾酮各剂量组OCCM-30细胞凋亡率显著低于空白对照组,且牛膝甾酮各剂量组OCCM-30细胞凋亡率呈低剂量组>中剂量组>高剂量组(t均>14.584,P<0.01),见图2和表4。
2.4 牛膝甾酮对细胞Notch1、DSL、CSL mRNA表达的影响
四组细胞Notch1、DSL、CSL mRNA表达水平比较,差异有统计学意义(P<0.05)。与空白对照组比较,牛膝甾酮各剂量组OCCM-30细胞内Notch1、DSL、CSL mRNA表达水平均显著升高,且牛膝甾酮各剂量组OCCM-30细胞内Notch1、DSL、CSL mRNA表达水平呈低剂量组<中剂量组<高剂量组(t均>3.315,均P<0.05),见表5。
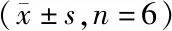
表4 各组细胞凋亡率结果比较

注:A,空白对照组 ;B,牛膝甾酮低剂量组; C,牛膝甾酮中剂量组; D,牛膝甾酮高剂量组
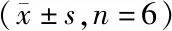
表5 各组细胞Notch1、DSL、CSL mRNA水平比较
2.5 牛膝甾酮对细胞Notch1、DSL、CSL蛋白表达的影响
四组细胞Notch1、DSL、CSL 蛋白表达水平比较,差异有统计学意义(P<0.01)。与空白对照组比较,牛膝甾酮各剂量组OCCM-30细胞内Notch1、DSL、CSL蛋白表达水平均显著升高,且牛膝甾酮各剂量组OCCM-30细胞内Notch1、DSL、CSL蛋白表达呈低剂量组<中剂量组<高剂量组(t均>6.790,均P<0.01),见图3和表6。
虽然覆盖在牙齿根部表面的牙骨质是一种钙化的牙齿成分,但它被归类为牙周组织,因为它与牙周膜和牙槽骨有共同的起源。由于它在牙齿支抗系统中起着关键作用,因此了解成牙骨质细胞生成牙骨质对于再生功能性牙齿至关重要[10]。尽管牙骨质与骨有几个方面的共同点,包括其生化成分,但其不同之处在于,牙骨质在组织学上没有血管和神经,几乎没有重塑能力,而骨有组织良好的系统,可通过成骨细胞、骨细胞和破骨细胞进行再生[11]。体外和体内研究都表明,成牙骨质细胞合成非胶原蛋白,如碱性磷酸酶(ALP)、骨唾液蛋白(BSP)和骨钙素(OCN),在骨形态发生蛋白诱导的分化过程中,发现成牙骨质细胞的相关基因表达发生改变[12]。然而,关于成牙骨质细胞分化过程的详细分子机制知之甚少。
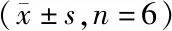
表6 各组细胞Notch1、DSL、CSL蛋白水平比较
本文对永生化小鼠成牙骨质细胞系OCCM-30的相关研究显示,牛膝甾酮的干预改变了成牙骨质细胞的分化。在中医上牛膝是治疗骨质疏松症的常用药物之一,主要分布在中国山西、陕西、山东等地,中医上主要用于治疗筋骨无力、头痛及吐血等症状。其主要成分牛膝甾酮具有促进蛋白合成,降低血糖等作用,有研究发现,其对于骨形成具有一定的促进作用[13]。牛膝甾酮是牛膝的主要活性成分之一,具有促进骨样细胞增殖的功效[14]。且在目前的临床应用当中,未见明显副作用,安全性较高。本研究采用不同浓度的牛膝甾酮作用于OCCM-30细胞,结果显示,牛膝甾酮可有效促进OCCM-30细胞增殖,同时降低OCCM-30细胞凋亡,且随着牛膝甾酮的干预剂量增加,OCCM-30细胞增殖率越高,凋亡率越低,提示牛膝甾酮可有效促进OCCM-30细胞的生长,并减少其凋亡,具有促进骨样细胞增殖的功效。细胞内钙离子水平可反映细胞成骨细胞分化水平[15]。本文通过Fluo-3 AM探针技术检测了细胞内钙离子水平,结果发现牛膝甾酮干预可以显著增加OCCM-30细胞内钙离子水平,且具有量效关系,表明牛膝甾酮可能通过激活细胞钙离子通道,提高细胞钙离子水平,从而促进细胞成骨分化。
Notch信号通路在牙周组织的修复和改建过程中具有重要作用。有研究显示,当大鼠牙髓和牙周组织受损时,在组织的修复过程中Notch信号通路被激活,提示Notch信号通路的激活可能与牙周组织的修复过程密切相关[16]。在干细胞骨分化的过程中,Notch信号通路同样起到了重要作用,有研究发现,在体外培养的骨髓干细胞中,通过激活Notch信号通路,可以使骨髓干细胞分化水平增加,促进细胞成骨分化[17]。既往研究显示,当采用抑制剂抑制Notch信号通路相关蛋白的表达时,骨髓干细胞成骨能力显著下降[18]。结合牛膝甾酮促进骨样细胞增殖的功效,提示牛膝甾酮可能对Notch信号通路相关蛋白的表达具有一定的影响,从而影响OCCM-30细胞成骨效应。为了探讨Notch信号通路对成牙骨质细胞成骨分化的影响,本研究检测了Notch信号通路相关蛋白Notch1、DSL、CSL的表达水平,结果发现随着牛膝甾酮干预剂量的增加,Notch1、DSL、CSL的表达水平均显著升高,同时结合OCCM-30细胞增殖、凋亡及钙离子水平的结果,提示Notch信号通路相关蛋白的表达水平与OCCM-30细胞成骨效应密切相关,其机制可能是牛膝甾酮可激活Notch信号通路相关蛋白的表达水平,从而调节细胞增殖、凋亡及钙离子水平,使得OCCM-30细胞成骨效应增强。
综上所述,牛膝甾酮可激活Notch信号通路相关蛋白表达,促进OCCM-30细胞增殖和钙离子水平,并抑制OCCM-30细胞凋亡,从而促进成牙骨质细胞成骨效应。
◀
本文第一作者简介:
韦 敏(1987-),女,汉族,研究方向:口腔疾病的诊断和治疗