AG490改善缺血性脑卒中后神经功能的机制研究
张薇,辛灵,阎涛,2
(天津医科大学总医院1.神经病学研究所;2.神经内科,天津 300052)
脑卒中是导致全球患者死亡和残疾的主要病因,显著增加了患者家庭和社会的经济负担。缺血性脑卒中是最常见的卒中亚型,缺血性脑卒中诱导损伤相关分子模式(damage-associated molecular pattern molecules,DAMPs)的激活,在损伤的大脑区域引发局部炎症,这种局灶性炎症进一步加剧血脑屏障损伤、微血管衰竭、脑水肿和氧化应激并直接诱导神经元死亡,加重脑损伤[1]。目前对急性缺血性脑卒中最有效的治疗主要是组织纤溶酶原激活物溶栓治疗或血管内机械再通治疗[2-3]。然而,相当部分患者到达医院时已错过最佳的治疗时间窗,导致不同程度的神经功能障碍。许多分子靶点的药物在减轻卒中动物模型的神经损伤方面显示出巨大的潜力,但大多在临床试验中失败。因此,寻找缺血性脑卒中治疗的新靶点来改善治疗效果至关重要。Janus激酶2(Janus kinase2,JAK2)是蛋白酪氨酸激酶家族成员之一,调节下游信号转导与转录激活因子(STAT1、STAT3和STAT5)等信号分子的激活[4]。JAK2/STAT3是JAK-STAT信号转导途径家族中最重要的途径,通过多种生长因子和细胞因子的信号级联反应,参与调控细胞存活、增殖和分化的病理生理过程。AG490是一种酪氨酸激酶抑制剂,应用于抑制JAK1、2。在脑缺血大鼠模型中,AG490治疗可改善卒中后脑水肿、氧化应激、炎症水平[5]。有研究报道,自噬相关信号通路的激活参与卒中的病理生理变化过程,并发挥神经保护作用[6]。然而AG490能否通过抑制JAK2/STAT3降低卒中后炎性反应、调节自噬减轻血脑屏障损伤、改善神经功能损伤尚缺乏相关研究。本研究旨在探讨AG490对缺血性脑卒中后小鼠神经功能改善的机制,为JAK1/2抑制剂成为未来缺血性脑卒中新的治疗药物奠定理论基础。
1 材料与方法
1.1 实验动物及分组 成年雄性C57BL/6J小鼠,20~22 g,6~8周龄,购买自北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2016-0006,批号:110011200109844553]。造模后随机分为Control组、Stroke组、DMSO组、AG490组(AG490,JAK1/2抑制剂,购自美国MCE公司),每组18只。Control组为正常对照组,Stroke组不给予任何治疗,DMSO组注射等量的DMSO溶剂,AG490组在造模后1 h、24 h及48 h腹腔注射AG490(5 mg/kg,溶解于5%DMSO+40%PEG300+55%NaCl)。所有小鼠提供充足的食物和水,并维持昼夜节律的稳定。
1.2 方法
1.2.1 缺血性脑卒中模型及动物处理 采用光化学法诱导局灶性大脑皮层缺血性脑卒中模型。主要步骤:称重小鼠,在术前5 min腹腔注射玫瑰红染料(50 mg/kg,0.9%生理盐水溶解)。腹腔注射5%水合氯醛(70 μL/10 g)麻醉小鼠,之后将麻醉的小鼠固定于立体定位仪上,放置小鼠体温维持板以维持体温。沿颅骨中缝切开小鼠颅骨表面皮肤,约1 cm,暴露并标记梗塞部位的颅骨外骨膜。将绿光源的光纤探头固定于标记部位,开启绿光光源照射25 min,注意监测小鼠生命体征。结束照射后缝合切口,碘伏再次对缝合伤口消毒,维持小鼠体温至彻底清醒,恢复自由进食水。造模成功率:95%,造模成功标准:小鼠造模后前肢和后肢屈曲,不能正常走直线,头部在30 s内偏离垂直轴>10°,向轻瘫侧倾倒。
1.2.2 神经功能评估 采用足错步实验评价其运动功能,判断缺血性脑损伤后损伤程度和恢复情况。在完成造模后第1、3、7、14天的固定时间,让小鼠在不规则的铁网上行走,记录小鼠行走100步中偏瘫侧掉落网格的数目,对掉落网格的比例进行统计,结果表示为(错步/总步)%。
1.2.3 RT-PCR检测 目的基因的表达在造模后72 h处死小鼠,取新鲜脑组织,加入TRIzol裂解液,研碎充分,制备RNA,使用逆转录试剂盒将RNA逆转录成cDNA。20 μL的反应体系由2.5 μL的cDNA、1.25 μL的正向引物、1.25 μL的反向引物、5.0 μL的无酶水和10 μL的SYBR green PCR Master Mix组成。通过RT-PCR检测目的基因的表达水平。通过与内参基因Ct值之间的差值来计算基因表达差异,即2-△△Ct。引物序列见表1。

表1 引物序列Tab 1 primer sequences
1.2.4 蛋白质免疫印迹检测 目的蛋白的表达在造模后72 h处死小鼠,收集缺血侧皮质组织,称重后放入加有裂解液的研磨管匀浆,匀浆后的组织裂解物脉冲超声处理30 s,然后以13 000 r/min 4℃离心15 min。收获上清液并用Nanodrop测定蛋白质浓度。提取的蛋白质在10% SDS-PAGE凝胶上进行电泳,随后转移到PVDF膜上,用含有5% BSA的0.1% Tween-TBS封闭膜,一抗[Claudin5(1∶1 000)、ZO-1(1∶1 000)、Occludin(1∶1 000)、LC3Ⅱ/Ⅰ(1∶1 000)、P62/SQSTM1(1∶1 000)、Beclin-1(1∶1 000)]4℃过夜孵育,抗小鼠GAPDH用作对照。用发光试剂盒检测二抗结合的一抗。使用ImageJ软件扫描和量化免疫反应条带。目的蛋白的相对表达量=目的条带的灰度值/内参的灰度值。
1.3 统计学处理 利用Graphpad Prism9.0进行统计分析,符合正态分布数据以±sx表示。多组间比较采用单因素方差分析,组内进一步两两比较采用Bonferroni检验。P<0.05为差异有统计学意义。
2 结果
2.1 AG490改善小鼠缺血性脑卒中后的神经功能如图1所示,与Control相比,DMSO组和Stroke组的错步/总步比例在卒中后各时间点显著增加,而在第3天、7天和14天,AG490组小鼠比DMSO组和Stroke组的错步/总步比例降低(F=3.704、9.199、10.83,均P<0.05)。

图1 AG490改善小鼠缺血性脑卒中后的神经功能Fig 1 AG490 improves neurological function after ischemic stroke in mice
2.2 AG490抑制JAK2-STAT3的表达 如图2所示,与Control相比,DMSO组和Stroke组小鼠脑组织中的JAK2、STAT3的mRNA表达水平上调(F=8.718、12.12,均P<0.05),而与DMSO组和Stroke组相比,AG490组小鼠JAK2和STAT3的mRNA水平表达下调(F=6.331、7.168,均P<0.05)。
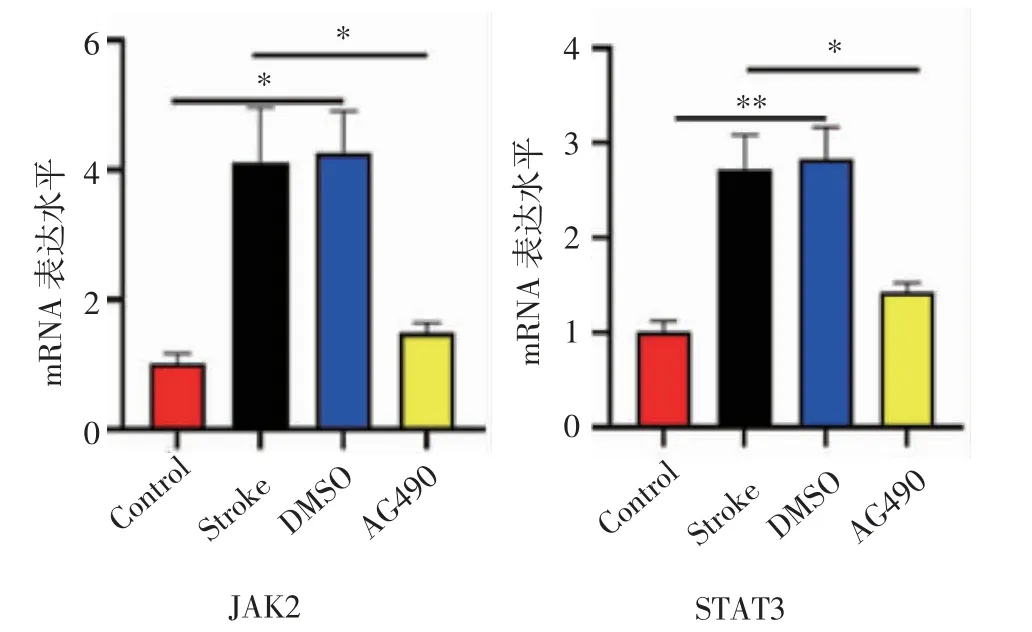
图2 AG490抑制JAK2-STAT3的表达Fig 2 AG490 inhibits the expression of JAK2-STAT3
2.3 AG490改善小鼠缺血性脑卒中后的血脑屏障图3A~3C显示,与Control组相比,DMSO组和Stroke组小鼠脑组织中的Occludin、Claudin5和ZO-1的mRNA表 达 明 显 降 低(F=29.83、25.22、20.49,均P<0.05),而MMP-9的mRNA表达明显升高(F=17.06,P<0.05),而与DMSO组和Stroke组小鼠相比,AG490组小鼠脑组织中的Occludin、Claudin5和ZO-1的mRNA表达明显上调(F=7.648、29.83、25.08,均P<0.05),同时MMP-9的mRNA表达明显降低(F=9.790,P<0.01)。图3F~3H结果显示,与Control组相比,DMSO组和Stroke组小鼠脑组织中的Occludin、Claudin5和ZO-1的蛋白表达明显降低(F=14.05、57.83、22.75,均P<0.05),而与DMSO组和Stroke组小鼠比较,AG490组小鼠脑组织中的Occludin、Claudin5和ZO-1的蛋白表达明显上调(F=12.42、10.88、14.32,均P<0.05)。

图3 AG490改善小鼠缺血性卒中后的血脑屏障损伤Fig 3 AG490 ameliorates blood-brain barrier disruption after ischemic stroke
2.4 AG490降低缺血性脑卒中后炎症因子的表达水平 图4显示,与Control组相比,DMSO组和Stroke组小鼠IL-1α、MCP-1和C1q的水平升高(F=8.451、18.55、6.380,均P<0.05),而与DMSO组和Stroke组相比,AG490组小鼠IL-1α、MCP-1和C1q的水平显著降低(F=5.486、5.455、4.862,均P<0.05)。
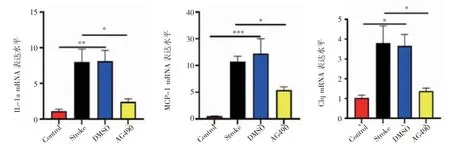
图4 AG490降低缺血性脑卒中后炎症因子的表达水平Fig 4 AG490 reduces the expression levels of inflammatory factors after ischemic stroke
2.5 AG490促进缺血性脑卒中小鼠的自噬 如图5所示,与Control组相比,DMSO和Stroke组脑组织中的LC3Ⅱ/LC3Ⅰ和Beclin-1轻度增加(F=95.85、20.07,均P<0.05),而P62/SQSTM1降低(F=6.322,P<0.05),与DMSO和Stroke组相比,AG490组LC3Ⅱ/LC3Ⅰ和Beclin-1的表达水平增加(F=6.092、15.52,均P<0.05),而P62/SQSTM1的表达降低(F=8.143,P<0.05)。

图5 AG490促进缺血性脑卒中小鼠的自噬Fig 5 AG490 promotes autophagy in ischemic stroke mice
3 讨论
质膜中的STAT3在各种细胞因子和生长因子刺激下被JAK2磷酸化,二聚化后移位入细胞核中,结合RelA/p65促进核因子-κB的激活,参与免疫细胞的分化并介导炎性因子产生,进一步传播和放大炎性损伤过程[7]。研究表明,脑卒中患者循环中JAK2、STAT3显著上调[8],STAT3基因敲除的卒中小鼠表现出较小的梗死面积、较轻的神经功能缺损[9]。在过氧化氢诱导的细胞氧化应激模型中,AG490的使用改善了细胞氧化损伤,同时下调了p-JAK2和p-STAT3的表达[10]。针对JAK2-STAT3信号通路的抗神经元凋亡疗法可以增加卒中小鼠的存活率[11]。本研究通过光化学法诱导局灶性大脑皮层缺血性脑卒中模型,应用AG490治疗脑卒中小鼠,结果显示AG490显著改善小鼠卒中后神经功能并同时降低卒中小鼠JAK2和STAT3表达水平。
缺血性脑卒中后,神经血管单元的损伤导致血脑屏障破坏以及炎症细胞和炎症因子从体循环中流入,导致脑水肿和神经元损伤并促进出血转化,最终增加死亡率。同时,脑损伤激活的内皮细胞通过分泌MMPs介导紧密连接蛋白(tight junction,TJs)的降解导致血脑屏障进一步破坏,促进白细胞募集到缺血后脑组织中增强神经炎症反应,进一步加速脑损伤[12]。在胶质母细胞瘤模型中,IL-6诱导的JAK/STAT3通路激活降低了TJs的表达,而AG490的治疗恢复了血脑屏障的功能[13]。在本研究中,缺血性脑卒中导致小鼠的Occludin、Claudin-5和ZO-1的降解,而AG490治疗逆转了Occludin、Claudin-5和ZO-1的表达。同时,卒中后MMP-9表达上调,MMP-9可通过增加卒中后血脑屏障的开放增加出血转化风险,而AG490可部分抑制MMP-9的表达,进一步表明AG490可通过改善血脑屏障介导部分神经保护作用。
卒中后神经损伤激活损伤相关的分子模式,导致小胶质细胞激活以及中性粒细胞浸润,释放促炎细胞因子以及趋化因子[14]。研究表明,IL-1α、MCP-1、C1q等炎症因子参与脑损伤的病理进展并与预后相关[15-17]。IL-1α可促进脑内巨噬细胞的活化,在缺血24 h后,IL-1α的表达与局灶性血脑屏障破坏和神经元死亡密切相关[15]。MCP-1参与卒中后锥体神经元延迟性死亡的病理过程,并促进卒中的复发事件[16]。而脑损伤后C1q的表达通过促进小胶质细胞突触吞噬和突触丢失显著增加了小鼠的神经系统损伤[17]。本研究发现,IL-1α、MCP-1和C1q在卒中后脑组织中表达上调,而IL-1α、MCP-1和C1q的水平在AG490治疗显著降低。表明AG490可通过降低卒中后炎症因子的表达介导神经保护作用。
自噬是细胞在应激或损伤状态下通过清除导致细胞功能障碍的受损细胞成分维持细胞稳态的生物过程。卒中可影响自噬的转录调控机制诱导自噬发生,抑制细胞凋亡、增加卒中后神经元的活力[6,18]。自噬受损会导致衔接蛋白p62积累,促进TRAF6寡聚化激活转录因子NF-κB[19],调节炎症的发生。研究表明,抑制JAK2/STAT3的激活可促进小鼠腹主动脉瘤形成过程中的自噬[20]。此外,细胞质STAT3通过与PKR结合抑制自噬[21]。本研究发现,LC3-Ⅱ/Ⅰ作为自噬激活的标志物在卒中后轻度增加,p62的表达在卒中后降低,而AG490的治疗上调了LC3-Ⅱ/Ⅰ、Beclin-1的表达,降低了P62的表达,表明AG490促进卒中后的自噬。而AG490可以抑制JAK2-STAT3的表达,表明AG490通过抑制JAK2-STAT3的表达促进卒中后的自噬过程。此外,相关研究发现抑制自噬会加剧缺血/再灌注(ischemia/reperfusion,I/R)诱导的血脑屏障损伤,而在激活自噬后可通过促进ZO-1在细胞膜上的重新定位显著逆转I/R后的ZO-1的表达[22]。本研究发现,AG490可促进自噬的发生并逆转紧密连接蛋白的表达,表明AG490可能间接影响卒中后的自噬过程,抑制紧密连接蛋白的降解来改善血脑屏障功能障碍。综上所述,AG490可通过促进自噬间接调控神经炎症、改善血脑屏障功能障碍来介导卒中后的神经保护作用。
总之,本研究表明,AG490抑制JAK2/STAT3通路激活,对脑缺血性损伤具有神经保护作用,这可能是由减轻神经炎症、促进卒中后的自噬以及改善血脑屏障损伤介导的。JAK2/STAT3通路介导卒中后神经损伤机制的研究为脑缺血提供了新的见解和治疗靶点,未来应关注JAK2/STAT3作为缺血性脑卒中治疗靶点的进一步研究和临床转化。

