高效液相色谱法对小麦粉及其制品中硫脲的测定
王 邱,何海彤,李锦清,周铭林,刘德群
(广东产品质量监督检验研究院,广东 佛山 528322)
硫脲(thiourea)是一种含硫化合物,白色而有光泽的晶体,又称为硫代尿素,因其还原性、抗氧化和漂白作用,广泛用于纺织业,也可用作兽药的生产原料。还曾一度作为防腐剂,应用于各类需要保鲜、防腐以及漂白的食品中[1-2]。有研究表明,硫脲虽然一次作用时毒性小,反复作用可抑制甲状腺和造血器官的机能,进而引起变态反应,长期接触可能出现头痛、无力、嗜睡、血压下降、基础代谢降低、白细胞减少等症状[3],因此我国不允许其作为食品添加剂作用于食品中。有关部门在日常监督抽检或风险监测工作中发现有部分生产厂家向小麦粉及其制品中添加硫脲,以达到漂白、增筋的目的。由于小麦粉及其制品是人民群众主要的食品及原料,受众面十分广泛,因此为保障人民群众食品安全,迫切需要建立高效、快速检测小麦粉及其制品中硫脲的方法。
目前,测定硫脲的分析方法主要有分光光度法、离子色谱法、高效液相色谱法以及高效液相色谱-质谱联用法[1-13]。离子色谱法主要用于水样中硫脲含量的测定,谭炯等[10]运用离子色谱对水样中硫脲含量进行了研究,先用高锰酸钾将硫脲中的硫羰基氧化为,再用离子色谱对进行测定得到其浓度,最后根据生成的与硫脲的关系来计算出硫脲的含量。小麦粉及其制品相较于水而言基质复杂得多,高效液相色谱法以及高效液相色谱-质谱联用法的前处理及上机检测更加简便、高效、快捷,因此已经成为硫脲的主要检测手段。何瑞云等[3]运用高效液相色谱法建立了面粉及其制品中硫脲的测定方法,以水为样品提取液,用Inertsil CX阳离子交换柱进行分离,得到方法检出限(S/N=3)为2.0 mg/kg。目前暂时还没有关于硫脲检测的国家标准,仅有国家食品药品监督管理局发布的补充检验方法《总局关于发布食品中那非类物质的测定和小麦粉中硫脲的测定2项检验方法的公告(2016年第196号)》[14]—小麦粉中硫脲的测定BJS 201602,此方法仅适用于小麦粉中硫脲的测定,并不确定是否适用于小麦粉制品,且色谱柱的使用也比较局限(HILIC亲水柱)。
本实验对小麦粉及其制品中硫脲的测定条件进行了研究,对样品前处理条件和上机条件均进行了优化,重点研究了前处理各方面的选择,旨在建立一种更高效、便捷、灵敏的检测方法。
1 材料与方法
1.1 仪器与材料
LC-30AD超高效液相色谱仪(配有二极管阵列检测器):日本岛津公司;JJ500Y型百分位电子天平:富阳腾辉电子科技有限公司;ME204/02型万分位电子天平:瑞士梅特勒托利多公司;JP-C400型超声波清洗器:广州市吉普超声波电子设备有限公司;centrifuge 5804R型高速冷冻离心机:广东省中科进出口有限公司。
硫脲标准品(纯度≥99%):上海安谱实验科技股份有限公司;磷酸二氢铵(分析纯):阿法埃莎(中国)化学有限公司;磷酸(色谱纯):天津市科密欧化学试剂有限公司;甲醇(色谱纯):赛默飞世尔科技(中国)有限公司;实验用水为超纯水。
0.02 mol/L磷酸二氢铵溶液(pH=3.0):准确称取磷酸二氢铵2.4 g于1 000 mL流动相瓶中,加入900 mL超纯水,超声溶解,静置后用磷酸调节pH至3.0(大约1 mL磷酸),再加超纯水至1 000 mL刻度,混匀后过0.45 μm滤膜备用。
小麦粉及挂面样品,购买于本市批发市场。
1.2 实验方法
1.2.1 标准溶液的配制
精密称取硫脲标准品10 mg于100 mL容量瓶中,加水溶解并稀释至刻度,得到浓度为100 μg/mL的硫脲标准储备液,分别移取 0.1、0.25、0.5、2.5、5.0、10.0 mL 标准储备液于 50 mL容量瓶中,用水稀释至刻度,得到浓度分别为0.2、0.5、1.0、5.0、10.0、20.0 μg/mL 的系列标准工作溶液,将纯水(0 μg/mL,排除试剂干扰)和系列标准工作溶液按照浓度由稀至浓依次进样,可获得空白溶液图谱、标准溶液图谱以及校正曲线。
1.2.2 样品前处理
先将挂面样品用粉碎机粉碎,全部通过 40目筛,备用。准确称取小麦粉样品和挂面样品约2 g于50 mL容量瓶中,加入超纯水20 mL混匀,在25 ℃下超声15 min,定容,混匀,转移至50 mL离心管中,10 000 r/min离心2 min,上清液过滤膜上机待测。
1.2.3 仪器条件
色谱柱:Agilent ZORBAX SB-C18(5 μm,4.6×250 mm);流动相:A:甲醇,B:0.02 mol/L磷酸二氢铵溶液,A+B=2+98,等度洗脱,流速为0.5 mL/min,柱温:25 ℃;进样量:10 μL;检测波长为236 nm。
2 结果与分析
2.1 样品前处理条件的优化
2.1.1 提取试剂的选择
根据参考文献[1]可知硫脲的提取溶液一般为水、甲醇、乙腈和乙醇,本实验对这几种试剂的提取效果进行了比较。选取小麦粉和挂面样品各一个,每个样品称取同质量的4份,分别加入等量的硫脲标准储备液,再分别以水、甲醇、乙腈和乙醇作为提取溶剂,再按照 2.2.2所述前处理方法进行操作,最后上机测定。根据加标样品的硫脲峰面积大小来对比提取效果。实验结果(见图1)显示对小麦粉和挂面提取效果最佳的均为水,其次为乙腈、甲醇,乙醇效果相对最弱。因此选择水为提取溶剂,同时可将水定为硫脲标准品溶解和稀释的溶剂。硫脲的标准溶液经二极管阵列检测器在190~800 nm进行全波段扫描后,发现硫脲在236 nm处有最大吸收(见图2,硫脲在水中的最大吸收波长为 236 nm、乙腈为238 nm、甲醇为240 nm、乙醇为246 nm),因此选定236 nm为硫脲液相色谱法的检测波长。
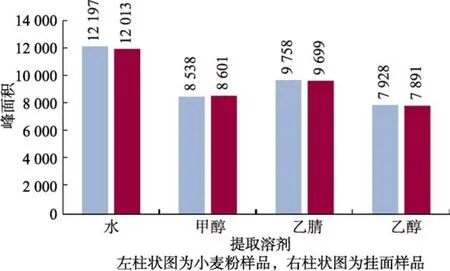
图1 不同提取溶剂的加标样品的峰面积柱状图Fig.1 Histogram of peak area of labeled sampleswith different extraction solvents
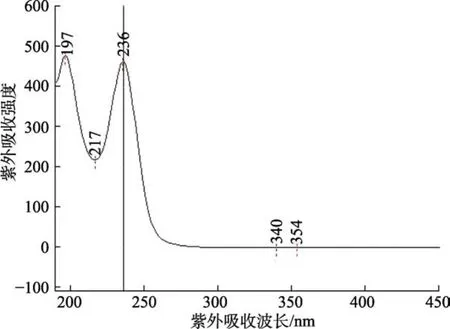
图2 硫脲标准溶液的紫外吸收光谱图Fig.2 Thiourea ultraviolet absorption spectra of the standard solution
2.1.2 超声提取温度的选择
选取一个小麦粉样品和一个挂面样品,均称取等量的5份,分别加入等量的硫脲标准储备液,以水作为提取溶剂,分别在 20、25、30、35、40 ℃温度下超声15 min,按照1.2.2所述进行操作,最后上机待测,根据各样品的硫脲峰面积大小来比较提取效果。实验结果(见图3)表明小麦粉样品与挂面样品的提取温度在 25 ℃时峰面积大于在 20 ℃时的峰面积,但 25 ℃之后,随着提取温度的升高峰面积变化并不大,在 40 ℃时出现峰面积变小的情况,可能是因为温度过高造成了硫脲的降解。因此本实验选择 25 ℃为超声提取温度。
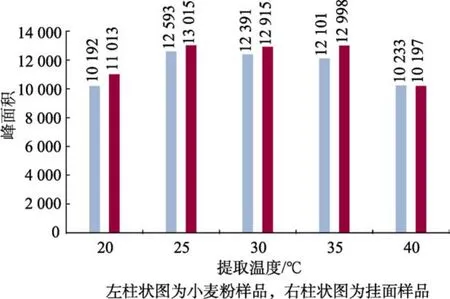
图3 不同提取温度的加标样品的峰面积柱状图Fig.3 Histogram of peak area of labeled samples at different extraction temperatures
2.1.3 超声提取时间的选择
选取一个小麦粉样品和一个挂面样品,均称取等量的5份,分别加入等量的硫脲标准储备液,以水作为提取溶剂,在25 ℃下分别超声提取10、15、20、25、30 min,按照1.2.2所述进行操作,最后上机待测,根据各样品的硫脲峰面积大小来比较提取效果。实验结果(见图4)表明小麦粉样品和挂面样品超声时间在 15 min时峰面积明显大于在 10 min时的峰面积,但在提取时间为15 min之后峰面积变化不大,因此本实验选择15 min为样品的超声提取时间。
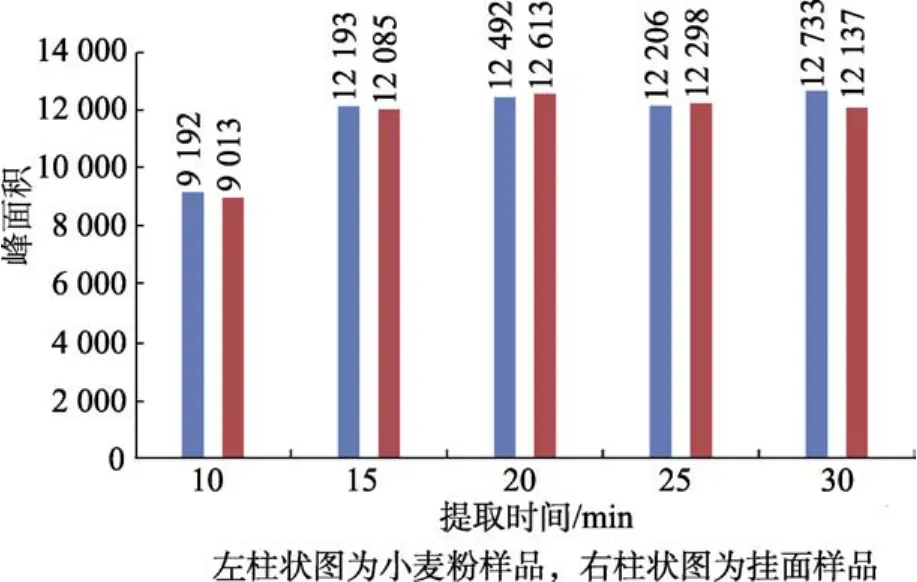
图4 不同提取时间的加标样品的峰面积柱状图Fig.4 Histogram of peak area of labeled samples at different extraction times
综上所述,本实验的前处理方法为:以水为提取溶剂,在25 ℃条件下超声提取15 min,再以10 000 r/min的速度离心2 min后,上清液过滤膜上机测定。
2.2 高效液相色谱仪器条件的优化
2.2.1 流动相的选择
根据参考文献[3]可知硫脲的流动相一般为甲醇-水、乙腈-水体系,对这两种流动相体系进行了考察(见图5-a、图5-b),由于硫脲的极性偏大,即使甲醇或乙腈的比例较低,在反相色谱柱上的保留均不理想,出峰较快,且峰形较差,因此考虑使用流动相添加剂。本次实验比较了在水相中加乙酸-乙酸铵缓冲盐/甲醇和磷酸-磷酸二氢铵缓冲盐/甲醇对硫脲色谱峰的影响(见图5-c、图5-d),发现在水相中添加0.02 mol/L磷酸-磷酸二氢铵缓冲盐(用磷酸调节pH至3.0)时峰形最佳,最终确定流动相体系为0.02 mol/L磷酸-磷酸二氢铵+甲醇=98+2,在流速为0.5 mL/min时仍有较好的峰形,实验采用等度洗脱,有助于稳定出峰时间,大批量样品进样时,每相隔十针左右需设置甲醇水的梯度冲柱程序,以便及时冲洗色谱柱,避免柱头污染,造成对目标峰的干扰,同时还能延长色谱柱的使用寿命。
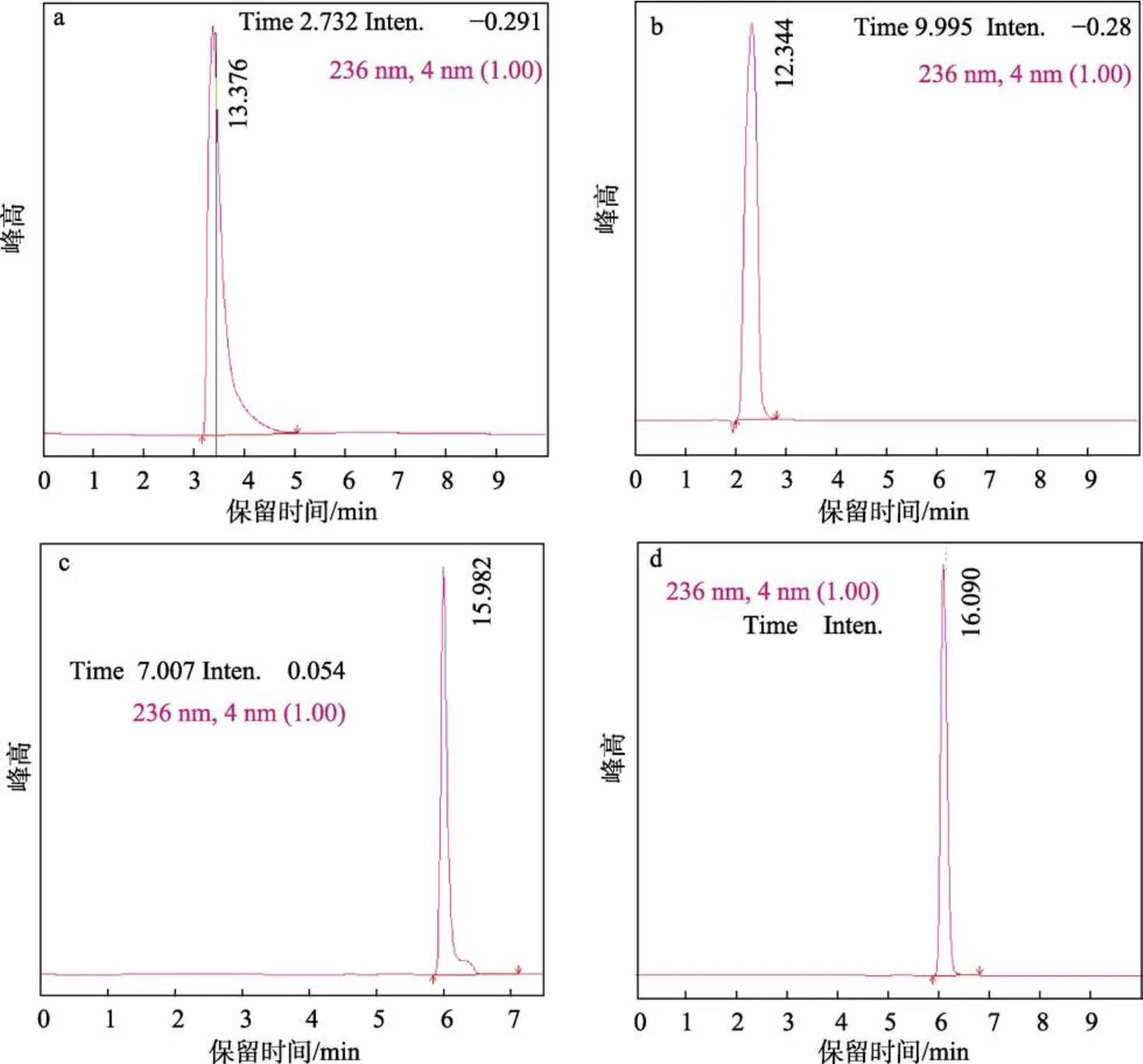
图5 不同流动相的硫脲的色谱图Fig.5 Chromatograms of thiourea in different mobile phases
2.2.2 色谱柱的选择
当实验选择甲醇-水或乙腈-水作为流动相体系时,即使是柱长为250 mm的C18柱,硫脲的保留均不理想,出峰较快,峰形较差,或与溶剂峰叠加。按照BJS 201602方法中所述,将色谱柱更换为HILIC柱,但必须将样品的提取溶剂和标准品的稀释溶剂更换为乙醇,才能在流动相为乙腈+水=90+10时,获得较为满意的保留时间和峰形,但如 2.1.1中所述,乙醇的提取效果是四种提取溶剂中相对最弱的,可能会造成痕量硫脲不易检出的情况。当选择磷酸-磷酸二氢铵缓冲盐+甲醇流动相体系时,即使是普通的 C18柱,也能获得较好的峰形,本次实验选择了 Agilent ZORBAX SB-C18(5 μm 150×4.6 mm)柱、Agilent Poroshell 120 EC-C18(4 μm 150×4.6 mm)柱和Agilent ZORBAX SB-C18(5 μm 250×4.6 mm)柱三种色谱柱来测试硫脲的峰形(结果见图6),Agilent ZORBAX SB-C18(5 μm 250×4.6 mm)柱具有更长的保留时间,有利于将硫脲与杂质峰分开,因此本次实验最终选择的色谱柱为 Agilent ZORBAX SB-C18(5 μm 250×4.6 mm)色谱柱。

图6 不同色谱柱的硫脲色谱峰Fig.6 The chromatographic peaks of thiourea on different chromatographic columns
2.2.3 色谱柱柱温的选择
在同一流动相体系和色谱柱条件下,对比了硫脲标准溶液(20.0 μg/mL)在 25、30和 40 ℃下对目标峰的保留时间和峰形的影响。实验结果表明色谱峰的保留时间和峰形在不同柱温下基本没有变化,因此本次选择25 ℃为色谱柱柱温(见表1)。

表1 硫脲标准溶液在不同柱温时的峰面积Table 1 Peak areas of thiourea standard solution at different column temperatures
2.3 方法学考察
2.3.1 校准曲线的绘制
本实验选取的线性范围为0~20 μg/mL。分别移取0.1、0.25、0.5、2.5、5.0、10.0 mL标准储备液于50 mL容量瓶中,用水稀释至刻度,得到浓度分别为 0.2、0.5、1.0、5.0、10.0、20.0 μg/mL的系列标准工作溶液,将纯水(0 μg/mL)和系列标准工作溶液按照浓度由稀至浓依次进样,以硫脲的浓度(X,μg/mL)为横坐标,峰面积(Y)为纵坐标,绘制校准曲线,得到回归方程和相关系数(r)。回归方程为Y=177 636X–616.712(r=0.999 99),表明硫脲在0~20.0 μg/mL的浓度范围内线性良好。
2.3.2 检出限和定量限
将硫脲标准溶液用水逐级稀释,高效液相色谱测定,3倍信噪比时(S/N=3)硫脲标准溶液浓度为0.02 μg/mL,对应的样品含量为0.5 mg/kg,10倍信噪比时(S/N=10)硫脲标准溶液浓度为0.06 μg/mL,对应的样品含量为1.5 mg/kg。因此,当称样量为2.0 g,定容体积为50 mL时,本方法检出限为0.5 mg/kg,定量限为1.5 mg/kg。
2.3.3 加标回收率
对于食品中的禁用物质,加标回收实验应在方法检出限、2倍方法检出限、10方法检出限进行3水平测试。将小麦粉样品和挂面样品先按照1.2.2处理后上机选出硫脲含量为未检出的阴性样品作为空白基质样品,称取小麦粉阴性样品和挂面阴性样品各9份,分别加入50、100、500 μL浓度为 20.0 μg/mL(即0.5、1.0、5.0 mg/kg三个水平)的标准溶液,每个浓度水平加标3次,前处理后上机测定,加标回收率实验结果见表2。
实验结果表明小麦粉和挂面样品的硫脲加标回收率均符合 GB/T 24704—2008实验《实验室质量控制规范 食品理化检测》附录 F中回收率的要求,证明该方法准确、可靠。2.3.4 方法精密度
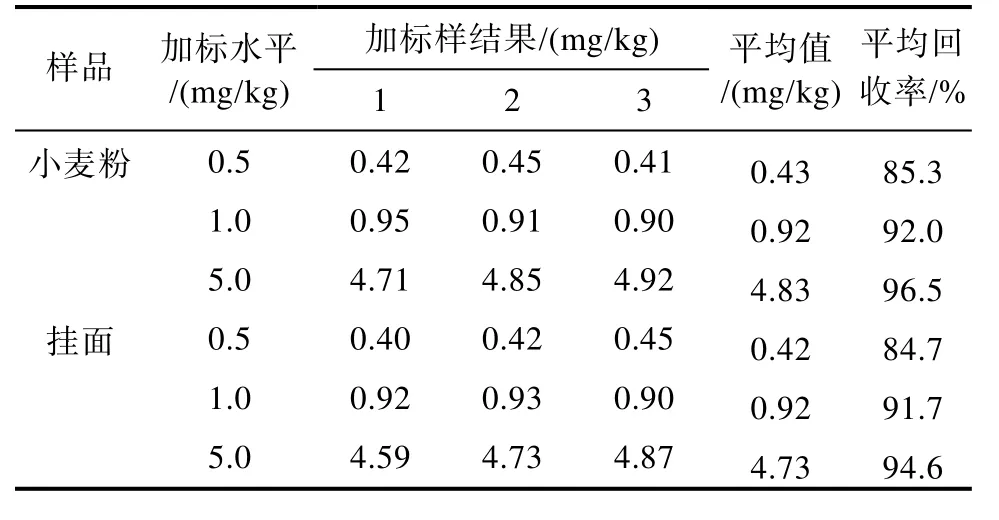
表2 硫脲加标回收率实验结果Table 2 Thiourea standard addition recovery rate test results
对于食品中的禁用物质,精密度实验应在方法检出限、2倍方法检出限、10方法检出限进行3水平测试,每个水平做6次平行实验,计算其相对标准偏差(RSD)。硫脲精密度实验测定结果见表3。
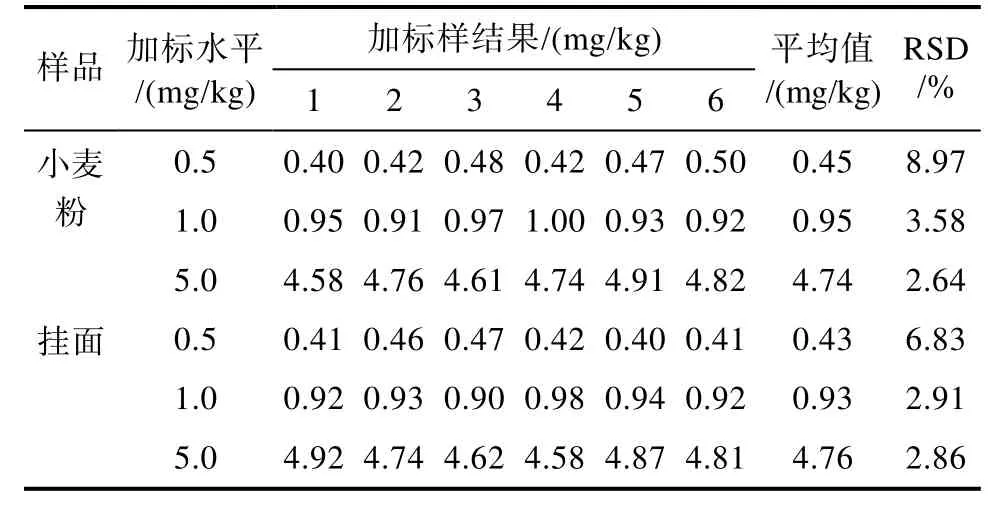
表3 硫脲精密度实验测定结果Table 3 Results of precision test of thiourea
精密度实验结果符合 GB/T 27404—2008实验《实验室质量控制规范 食品理化检测》附录F中精密度的要求,证明该方法稳定、可靠。
2.4 实际样品的测定
按照建立的方法对购买于本地批发市场的20份小麦粉样品和10份挂面样品进行处理和测定,发现所有样品中硫脲的含量均低于检出限,即未检出。对其中一份小麦粉样品和一份挂面样品进行加标回收实验,添加水平均为1.0 mg/kg,加标回收率结果分别为 93.1%和 94.8%。硫脲标准品色谱图、小麦粉样品色谱图以及小麦粉加标样品色谱图见图7(挂面样品以及挂面加标样品的色谱图与小麦粉基本一致)。
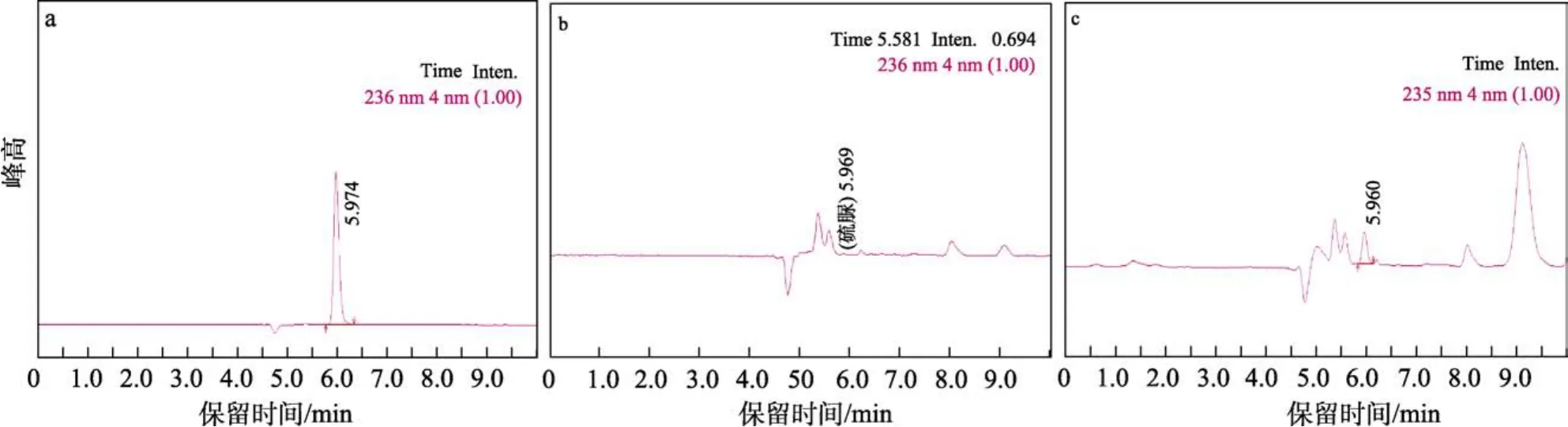
图7 硫脲标准品、小麦粉样品、小麦粉加标样品色谱图Fig.7 Chromatograms of thiourea standard, wheat flour sample and wheat flour standard sample
3 结论
本方法通过比较四种溶剂(水、乙腈、甲醇和乙醇)对硫脲的提取效果,选择水为小麦粉及其制品的提取溶剂,最大吸收波长为236 nm。通过比较各流动相体系对硫脲的保留时间以及峰形的影响,选择0.02 mol/L磷酸-磷酸二氢铵缓冲液+甲醇=98+2为流动相,色谱柱为Agilent ZORBAX SB-C18柱。该方法具有更低的检出限和定量限,分别为0.5 mg/kg和1.5 mg/kg。对本实验进行的方法学考察表明硫脲在0~20.0 μg/mL的范围内线性良好,相关系数r=0.999 99,该方法的加标回收实验和精密度实验结果均符合 GB/T 27404—2008附录F的要求,证明该方法能够准确、稳定可靠地检测小麦粉及其制品中的硫脲成分。
备注:本文的彩色图表可从本刊官网(http//lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。

