基于转录组测序分析骨髓间充质干细胞对子宫内膜癌细胞的影响
蒙妮 赵冰冰 隆曜先 何珊 张洁清 李力
作者单位:530021 南宁 1广西医科大学附属肿瘤医院妇科;400038 重庆 2第三军医大学陆军特色医学中心妇产科;646000 四川 3西南医科大学附属医院妇科
子宫内膜癌是常见的女性生殖道恶性肿瘤,早期子宫内膜癌以手术联合放化疗为主要治疗手段,治疗效果良好,但晚期及复发性患者治疗效果欠佳。近年来,肿瘤靶向治疗日益受到关注,研究发现间充质干细胞(mesenchymal stem cell,MSC)对多种肿瘤具有趋化性,可能作为靶向治疗的载体[1-2]。骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)虽然目前主要应用于骨骼再生修复、骨关节炎、缺血性心脏病等[3-5],但其在靶向治疗中也显示出一定优势。然而BMSCs对肿瘤的作用仍存在争议,如有研究报道BMSCs可能参与肿瘤发展,主要发挥促进肿瘤迁移、侵袭作用[6],但部分研究发现其衍生的外泌体可抑制肿瘤增殖和转移[7]。为了进一步明确BMSCs在子宫内膜癌中的作用及其机制,尤其是常见的Ⅰ型雌激素依赖型子宫内膜癌,本研究选择雌激素和孕激素受体表达均阳性的Ishikawa细胞与BMSCs接触共培养,然后对共培养后的癌细胞进行转录组测序分析,以探索BMSCs对子宫内膜癌细胞转录水平的影响及潜在机制。
1 材料与方法
1.1 主要材料与试剂
Ishikawa细胞购自北纳生物,人BMSCs、干细胞专用培养基购自上海赛百康生物科技有限公司,Lenti-EGFP慢病毒和Polybrene购自上海锐赛生物技术有限公司,高糖DMEM培养基购自江苏凯基生物技术股份有限公司,灭稻瘟素(blasticidin S,BSD)购自美国Millipore公司,10%胎牛血清(FBS)购自美国Gemini公司,0.25%胰酶、青霉素-链霉素溶液(P/S)、RIPA裂解液、BCA蛋白定量试剂盒、超敏ECL化学发光试剂盒购自上海碧云天公司,TRIzol总RNA抽提盒、反转录试剂盒购自日本Takara公司,SYBR Green荧光定量试剂盒、PCR仪购自美国赛默飞公司,荧光激活细胞分选仪购自BD公司(BD AccuriTMC6),兔抗人ETS1、细胞周期蛋白依赖性激酶抑制剂1A(cyclin dependent kinase inhibitor 1A,CDKN1A)、GAPDH抗体、辣根过氧化物酶(HRP)标记的二抗(兔抗)购自英国Abcam公司,qPCR引物由上海生工有限公司合成。
1.2 方法
1.2.1 慢病毒感染及筛选稳定转染细胞株 将Ishikawa细胞接种于T25培养瓶中,加入5 mL含10%FBS+1%P/S的DMEM完全培养基,并置于37℃、5% CO2培养箱培养。当细胞融合至80%左右,重新消化、离心、重悬,按2×106/孔接种到含DMEM完全培养基的10 cm培养皿中,当细胞融合率达50%时,加入MOI=50的Lenti-EGFP慢病毒液,并加入8µg/mL的Polybrene增强感染。当感染效率大于70%时,加入2.0µg/mL的BSD进行筛选,第4天将BSD浓度降到1.0µg/mL,第14天将稳定表达增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)的 Ishikawa细胞(即Ishikawa-EGFP细胞)扩增。
1.2.2 细胞培养和荧光激活细胞分选 实验分为3组:⑴空白组,未感染慢病毒的Ishikawa细胞;⑵Ishikawa-EGFP单独培养组,Ishikawa-EGFP细胞接种于含DMEM完全培养基的10 cm培养皿中,置于37℃、5% CO2培养;⑶Ishikawa-EGFP+BMSCs接触共培养组,Ishikawa-EGFP细胞和BMSCs按1∶3比例接种到10 cm培养皿中,干细胞专用培养基与DMEM培养基按1∶1比例混合[8]。培养1~4 d,荧光显微镜观察并计数共培养组的荧光细胞数量。
第4天分别收集3组细胞,制备成单细胞悬液。通过BD AccuriTMC6在488 nm波长激发光下分离Ishikawa-EGFP+BMSCs组中EGFP阳性(EGFP+)和EGFP-细胞。空白组作为阴性对照样本调试电压,上样后调节细胞流速,维持在2 500 events/s左右,根据细胞大小和颗粒度选择Forward Scatter(FSC)和Side Scatter(SSC)范围,调整门的位置、大小和形状,调节荧光通道电压。取下对照样品管,上共培养组样品,开始采样。取有EGFP+细胞的采样管,10 000 r/min离心5 min,弃上清,PBS清洗1遍,再次离心后弃上清液。然后收集共培养后的Ishikawa-EGFP细胞,液氮速冻后于-80℃保存。将单独培养和共培养后的Ishikawa-EGFP细胞送上海美吉生物医药科技有限公司进行转录组测序分析。
1.2.3 转录组测序及数据分析 本研究数据来源于Illumina Novaseq 6000测序平台。测序内容包括mRNA和miRNA。分别采用Truseq RNA sample Prep Kit和TruSeq Small RNA sample Prep Kit进行mRNA、miRNA文库构建,文库质检后上机测序。下机测序数据经过质控、序列比对,然后获得mRNA、miRNA注释信息。再用RSEM(v1.3.1)对mRNA和miRNA进行表达量统计,并进行TPM均一化处理。使用R语言DESeq2包[9]进行差异表达分析,设置参数P<0.05和上/下调差异倍数≥2(即|Log2FC|≥1)。用miRWalk在线软件(http://mirwalk.umm.uni-heidelberg.de/searchmirnas/)预测差异miRNA靶基因,用R语言VennDiagram包对二者取交集基因后进行GO和KEGG富集分析;STRING在线软件(https://string-db.org/)进行蛋白网络互作(protein-protein interaction network,PPI)分析;Cytoscape软件绘制miRNA-mRNA可视化网络图。
1.2.4 qRT-PCR验证共培养后的Ishikawa-EGFP细胞中CDKN1A和hsa-let-7e-5p的表达水平 采用TRIzol总RNA抽提盒提取总RNA,并参照反转录试剂盒说明书将RNA反转录成cDNA,再配置RT-PCR反应体系:稀释25倍的cDNA模板(5µL),2 mmol/L上、下游引物(各 0.5 µL),2×SYBR Green Mix(10µL),ddH2O(4µL)。在荧光定量PCR仪上进行荧光定量分析。PCR反应条件:95℃预变性5 min,95℃10 s、60℃30 s,共40个循环,记录循环阈值(即Ct值)。以GAPDH、U6为内参,每组设3个复孔,重复实验3次,用2-ΔΔCt分析基因相对表达量。用NCBI Primer-BLAST在线设计引物,引物序列见表1。

表1 qRT-PCR引物信息Tab.1 qRT-PCR primer information
1.2.5 Western blot验证共培养后的Ishikawa-EGFP细胞中CDKN1A蛋白的表达水平 收集细胞后用RIPA裂解液提取总蛋白,12 000 r/min离心15 min,根据BCA法测定总蛋白浓度后,按4∶1混匀蛋白提取液和5×蛋白上样缓冲液,于100℃煮沸5 min;采用10%SDS-PADGE凝胶电泳分离蛋白,转至PVDF膜,室温下用5%脱脂奶粉封闭2 h后,分别加入一抗(P21、内参GAPDH抗体稀释密度均为1∶1 000),4℃摇床孵育过夜;TBST洗膜后,加入二抗(稀释密度1∶2 000),室温孵育1 h,TBST洗膜后,用ECL显色,曝光拍照。
1.3 统计学方法
采用SPSS 23.0及GraphPad Prism 8.0统计软件进行分析,计量资料以均数±标准差(±s)表示,两组间比较采用两独立样本t检验。双侧P<0.05表示差异有统计学意义。
2 结果
2.1 Ishikawa-EGFP细胞共培养后的增殖情况
采用荧光显微镜观察共培养组第1~4天的绿色荧光细胞状态并计数,结果显示,EGFP标记的Ishikawa细胞数分别为94个、99个、145个、203个,表明共培养1~4 d的Ishikawa-EGFP细胞保持增殖趋势,于第4天收集生长状态良好的细胞进行分选。见图1。

图1 共培养组Ishikawa-EGFP细胞的增殖情况Fig.1 Proliferation of Ishikawa-EGFP cells in co-culture
2.2 荧光激活细胞分选共培养后的Ishikawa-EGFP细胞
在BD AccuriTMC6分选仪上设门圈出空白组的Ishikawa细胞群,该群占细胞总数82.1%,见图2A;再以相应参数分选出Ishikawa-EGFP+BMSCs共培养组中带绿色荧光的Ishikawa-EGFP细胞,结果显示,Ishikawa-EGFP阴性细胞占细胞总数的10.5%,Ishikawa-EGFP阳性细胞占细胞总数的33.6%,见图2B。
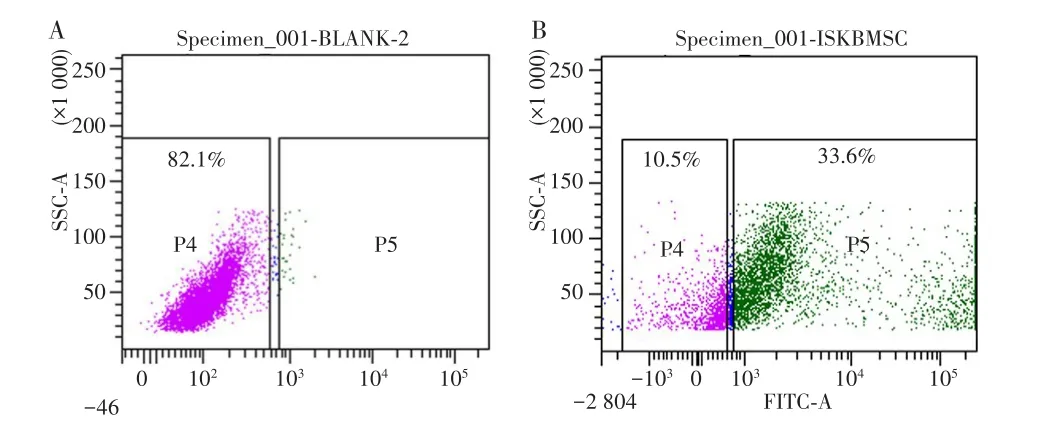
图2 荧光激活细胞分选Ishikawa-EGFP阳性细胞Fig.2 Ishikawa-EGFP positive cells sorted out by fluorescence activated cell sorting
2.3 筛选差异表达的mRNA和miRNA
原始测序数据按上述流程处理后,共筛选出5 928个差异表达mRNA,111个差异表达miRNA,且仅有65个miRNA在miRWalk中可匹配到靶基因,其中表达下调16个,表达上调49个;共富集到2 701个靶基因,韦恩图显示其与差异表达mRNA有852个交集基因,其中548个表达上调,304个表达下调,见图3。PPI分析结果显示交集基因表达的蛋白之间相互作用(|Log2FC|≥2,P<0.05,蛋白互作分数=0.95),共有79个节点,68条边(即节点互作关系)。核心节点包括CDKN1A、JAK1、COL1A1、VCAN 等,其中 COL1A1与 P4HA2、COL4A1、COL4A2之间存在互作关系(见图4A),且P4HA2、COL4A1、COL4A2表达上调(见图4B)。选取下调的16个差异表达miRNA及其预测到的交集基因,利用Cytoscape绘制miRNA-mRNA网络图,结果显示:hsa-let-7e-5p、hsa-let-7a-5p、hsa-let-7b-5p调控大量靶基因,其中hsa-let-7e-5p潜在靶基因包括CDKN1A,见图4B。

图3 交集基因韦恩图Fig.3 Venn diagram of intersection genes
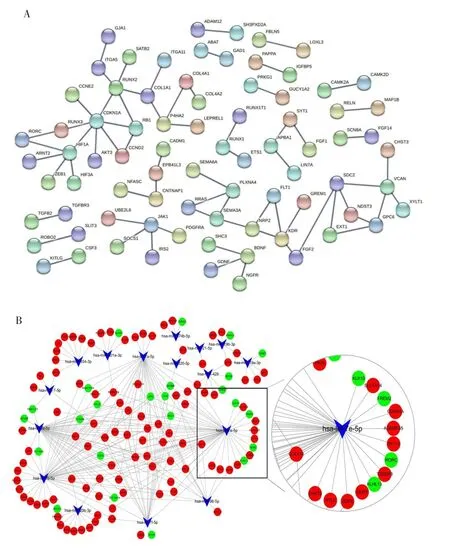
图4 交集基因PPI及miRNA-mRNA网络图Fig.4 PPI of intersection genes and miRNA-mRNA network
2.4 GO功能分析和KEGG富集分析结果
GO分析结果显示,上调的交集基因主要参与细胞外基质(extracellular matrix,ECM)结构、细胞膜结构、细胞黏附分子结合等,而下调交集基因则主要参与轴突发生、突触前活动区、生殖系统发育等,见图5;KEGG富集分析结果提示,上调差异基因主要富集在PI3K-Akt、黏着斑、MAPK、癌症中的miRNA、JAK-STAT、Ras等信号通路上,下调差异基因则主要富集在前列腺癌、EGFR酪氨酸激酶抑制剂耐药等通路,见图6。

图5 上调和下调交集基因的GO分析Fig.5 GO analysis of up-regulated and down-regulated intersection genes

图6 上调和下调交集基因的KEGG分析Fig.6 KEGG analysis of up-regulated and down-regulated intersection genes
2.5 验证共培养后Ishikawa-EGFP细胞中CDKN1A和hsa-let-7e-5p的表达水平
为验证上述测序结果,根据PPI分析结果选择节点互作关系最多的CDKN1A进行qRT-PCR和Western blot验证,同时根据miRNA-mRNA网络图选取与CDKN1A有潜在靶向调控作用的hsa-let-7e-5p进行qPCR验证。qPCR结果显示,相比单独培养组,共培养后Ishikawa细胞的CDKN1A表达升高(t=-6.612,P=0.003),见图7A;hsa-let-7e-5p表达下降(t=3.157,P=0.034),见图7B。Western blot结果显示,共培养后CDKN1A蛋白表达水平较单独培养组上调(t=6.125,P=0.025),见图7C~D。
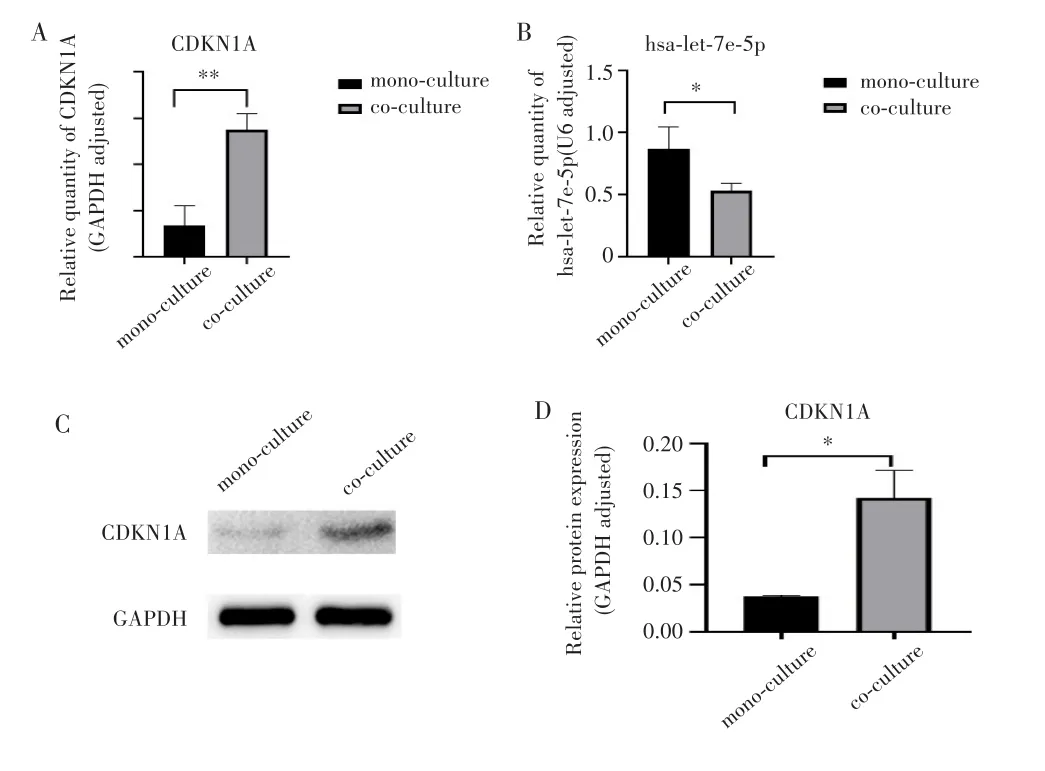
图7 共培养后Ishikawa-EGFP细胞中CDKN1A和hsa-let-7e-5p的表达水平Fig.7 CDKN1A and hsa-let-7e-5p expression levels in co-cultured Ishikawa-EGFP cells
3 讨论
BMSCs是骨髓基质细胞中具有多向分化潜能的成体干细胞,它可以向骨、软骨、脂肪、神经等多种组织分化,是组织修复和再生医学的理想种子来源。BMSCs能抑制细胞毒性T细胞对异体移植细胞的反应,加强修复受损组织[10]。BMSCs在宫腔黏连治疗方面也有促进子宫内膜再生的潜在作用[11]。近年来,研究发现BMSCs有肿瘤趋向性,其可以逃避免疫识别而迁移至靶组织,并通过分泌细胞因子、趋化因子等调节局部微环境[12]。BMSCs也与多种肿瘤有关,如可通过激活IL-6/STAT3信号通路并促进肝癌细胞侵袭[13]。在胃癌中,BMSCs可以迁移到胃癌组织,分泌白细胞介素6(interleukin 6,IL-6)并激活Src信号通路,从而促进胃癌发生发展[14]。SO等[15]将人羊水、脐带、骨髓来源的间充质干细胞与卵巢癌、子宫内膜癌细胞接触共培养后,发现上清液中的IL-6、CXC基序趋化因子配体1(C-X-C motif chemokine ligand 1,CXCL1)、CXCL8均显著增加,并促进两者侵袭和迁移。但是,BMSCs在子宫内膜癌中确切的作用及其机制并不明确。本研究通过构建Ishikawa-EGFP细胞与BMSCs接触共培养模型进行探索BMSCs与子宫内膜癌的关系,结果发现BMSCs可能促进子宫内膜癌细胞增殖。进一步进行转录组测序分析和生物信息学分析发现上调的交集基因主要富集在PI3K-Akt、MAPK、JAK-STAT等信号通路上,因此推测共培养后可能通过激活以上通路从而促进细胞增殖。此外,本研究还发现下调交集基因主要富集在EGFR酪氨酸激酶抑制剂耐药通路上,因此BMSCs能否促进耐药癌细胞增殖也值得深入探讨。同时选择CDKN1A和hsa-let-7e-5p验证测序结果的准确性,结果发现共培养后子宫内膜癌细胞中的CDKN1A表达上调,而hsa-let-7e-5p表达下调,与测序结果相符。CDKN1A也称p21,在肿瘤中具有双重作用。如当DNA损伤时,p53可直接诱导其下游的p21表达,从而使细胞周期阻滞至DNA修复完成[16]。但是也有研究报道,p21可作为致癌因子促进肿瘤迁移、分化[17]。hsa-let-7e-5p属于miRNA let-7家族的一员。既往研究显示,let-7e沉默后可激活p21信号,从而抑制卵巢颗粒细胞增殖并增强细胞自噬[18]。还有研究报道,CDKN1A在子宫内膜癌中低表达且与不良预后有关,同时可能受LncRNACARLo-5非编码RNA网络调控[19]。本研究在miRNA-mRNA网络图中发现CDKN1A和hsa-let-7e-5p存在潜在靶向关系,因此在子宫内膜癌中hsa-let-7e-5p是否通过靶向调控CDKN1A而发挥作用值得进一步深入研究。
本研究将子宫内膜癌细胞与BMSCs接触共培养后,癌细胞中mRNA和miRNA的差异表达分析显示胶原合成关键酶P4HA2以及胶原蛋白编码基因COL4A1、COL4A2等表达上调,PPI网络显示三者存在互作关系,由此推测,BMSCs可能参与了共培养体系中微环境的调节。肿瘤微环境是由ECM蛋白和内皮细胞、成纤维细胞、免疫细胞和炎症细胞等构成。胶原蛋白是ECM的主要结构蛋白,可以参与ECM重塑而改变肿瘤微环境,从而促进肿瘤细胞转移[20]。GHOSH等[21]发现,衰老的间充质干细胞可以重塑ECM,从而促进胶原蛋白沉积,进而增强乳腺癌细胞侵袭性。本研究通过GO分析发现上调交集基因参与ECM的构成、细胞黏附分子结合等,提示BMSCs可能通过直接接触诱导子宫内膜癌细胞表达更多的胶原蛋白,从而使ECM硬化,使之更利于子宫内膜癌的迁移、侵袭。
综上所述,本研究基于转录组分析发现接触共培养后子宫内膜癌细胞中的上调基因主要富集在PI3K-Akt、MAPK等信号通路,并参与ECM构成等,BMSCs可能通过细胞间的相互作用调节肿瘤局部微环境并促进子宫内膜癌发生发展。

